Bruke Tg (Vtg1:mcherry) Sebrafisk embryoer å teste estrogenic effekten av endokrine forstyrre forbindelser
Summary
Til stede her er en detaljert protokoll for bruk av sebrafisk embryoer Tg (vtg1: mCherry) for påvisning av estrogenic effekter. Protokollen dekker forplantning av fisk og behandling av embryoer, og understreker deteksjon, dokumentasjon og evaluering av fluorescerende signaler indusert av endokrine forstyrreforbindelser (EDC).
Abstract
Det er mange endokrine forstyrreforbindelser (EDC) i miljøet, spesielt estrogenic stoffer. Påvisning av disse stoffene er vanskelig på grunn av deres kjemiske mangfold; Derfor brukes stadig mer effektoppdagende metoder, for eksempel estrogenic effektfølsomme biomonitor / bioindicator organismer. Disse biomonitoring organismer inkluderer flere fiskemodeller. Denne protokollen dekker bruk av sebrafisk Tg(vtg1: mCherry) transgene linje som en biomonitoring organisme, inkludert forplantning av fisk og behandling av embryoer, med vekt på påvisning, dokumentasjon, og evaluering av fluorescerende signaler indusert av EDC. Målet med arbeidet er demonstrasjon av bruk av Tg(vtg1: mCherry) transgene linje embryoer for å oppdage estrogenic effekter. Dette arbeidet dokumenterer bruk av transgene sebrafisk embryoer Tg (vtg1: mCherry) for påvisning av estrogenic effekter ved å teste to estrogenic stoffer, α- og β-zearalenol. Den beskrevne protokollen er bare et grunnlag for å designe analyser; testmetoden kan varieres i henhold til testendepunktene og prøvene. Videre kan den kombineres med andre analysemetoder, og dermed lette fremtidig bruk av den transgene linjen.
Introduction
Det er et betydelig antall endokrine forstyrrende forbindelser (EDC) som er blant de farligste stoffene i vårt miljø. Dette er hovedsakelig estrogenic forbindelser som forurenser vann fra naturressurser. Det kjemiske mangfoldet av stoffene som tilhører gruppen gjør testing for deres tilstedeværelse vanskelig, da forskjellige analytiske metoder er nødvendig for deres deteksjon. Basert på deres kjemiske struktur er det svært vanskelig å avgjøre om et stoff faktisk er i stand til å fungere som et østrogen. I tillegg er disse stoffene aldri tilstede i ren form i miljøet, så deres effekter kan påvirkes av andre forbindelser, for1. Dette problemet kan løses ved effektdetekterende metoder, for eksempel bruk av biomonitor / bioindicator organismer som viser estrogenic effekter2,3,4,5.
Nylig, en rekke celle linje6 og gjær-baserte testsystemer2,3 har blitt utviklet for å oppdage estrogenic effekter. Disse er imidlertid vanligvis bare i stand til å oppdage bindingen av stoffet til østrogenreseptoren2,3. I tillegg er de ikke i stand til å modellere komplekse fysiologiske prosesser i organismen, eller for å oppdage hormonfølsomme faser av livsstadier; dermed fører de ofte til falske resultater.
Det er kjent at visse gener reagerer følsomt på østrogen i levende organismer7. Påvisning av genprodukter ved molekylærbiologi metoder er også mulig på protein eller mRNA nivå8,9, men vanligvis innebærer dyr offer. Dyrevernslover har blitt strengere, og det er en økende etterspørsel etter alternative testsystemer som minimerer antall og lidelser av dyr som brukes i eksperimenter eller utskifting av dyremodellen med et annet modellsystem10. Med oppdagelsen av fluorescerende proteiner og etableringen av biomarkørlinjer, gir transgene teknologier et godt alternativ11. Med disse linjene kan aktiveringen av et østrogenfølsomt gen testes in vivo.
Blant virveldyr er potensialet for fisk i miljørisikovurdering enestående. De tilbyr mange fordeler fremfor pattedyrmodeller: å være vannlevende organismer, de er i stand til å absorbere forurensende stoffer gjennom hele kroppen, produsere et stort antall avkom, og noen av deres arter er preget av kort generasjonstid. Deres endokrine system og fysiologiske prosesser viser store likheter med andre virveldyr og selv med pattedyr, inkludert mennesker12.
Flere gener for påvisning av estrogenic effekter i fisk er også kjent. Det viktigste er østrogen reseptorer aromatase-b, choriogenin-H, og vitellogenin (vtg)7,13. Nylig har flere østrogenproduserende biosensorlinjer også blitt opprettet fra fiskemodeller som brukes i laboratoriet, for eksempel fra sebrafisk (Danio rerio)4,5,14,15,16,17. Den største fordelen med sebrafisk i å skape biosensorlinjer er den gjennomsiktige kroppen til embryoer og larver, fordi det fluorescerende reportersignalet deretter lett kan studeres in vivo uten å ofre dyret10. I tillegg til dyrevern er det også en verdifull funksjon som det gjør det mulig å studere reaksjonen til samme person på forskjellige tider av behandlingen18.
Disse eksperimentene bruker en vitellogenin reporter transgen sebrafisk linje15. Transgene konstruksjonen som brukes til utvikling av Tg(vtg1:mCherry) har en lang (3,4 kbp) naturlig vitellogenin-1 arrangør. Østrogen reseptor (ER) er en enhancer protein aktivert av ligander som er en representant for steroid/kjernefysisk reseptor superfamilie. ER binder seg til spesifikke DNA-sekvenser kalt østrogenresponselementer (ERE) med høy affinitet og transaktiverer genuttrykk som svar på østradiol og andre estrogenic stoffer, slik at jo mer ERE i arrangøren forårsaker en sterkere respons19. Det er 17 ERE nettsteder i arrangørregionen av Tg (vtg1:mCherry) transgene konstruere og de forventes å etterligne uttrykket av den innfødte vtg genet15. Det er et kontinuerlig uttrykk for det fluorescerende signalet hos seksuelt modnede kvinner. Men hos menn og embryo er uttrykket i leveren bare synlig ved behandling med estrogenic stoffer (figur 1).
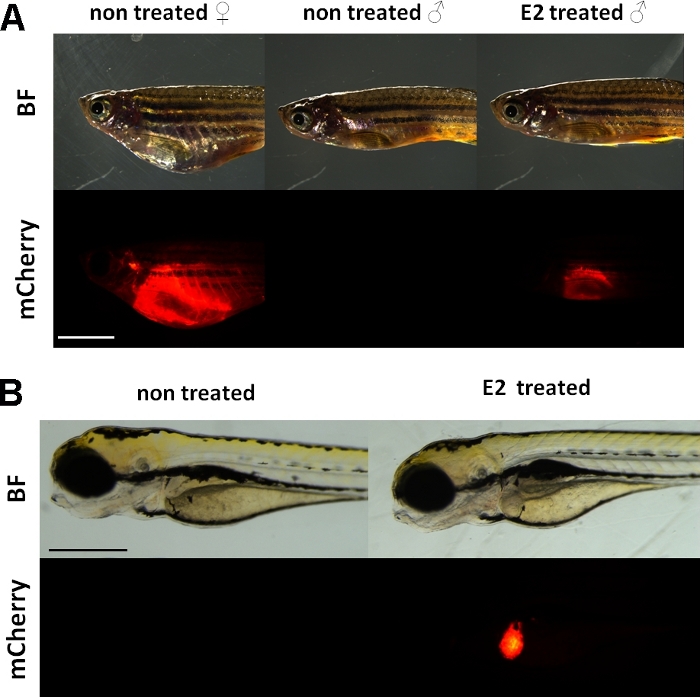
Figur 1: Rødt fluorescerende signal i leveren av vtg1:mCherry transgene voksne sebrafisk og 5 dpf embryoer, etter 17-ß-østradiol (E2) induksjon. Hos kvinner og hos hann behandlet med E2 (25 μg/l eksponeringstid:48 timer) er sterk fluorescens i leveren synlig selv gjennom den pigmenterte huden. Ingen fluorescerende signal er synlig hos ubehandlet mann (A). Etter E2 induksjon (50 μg/l eksponeringstid: 0-120 hkf), kan et rødt fluorescerende signal i leveren på 5 dpf embryoer også observeres, noe som ikke er synlig i kontrollembryoer (B). Mens fluorescerende signalet er kontinuerlig til stede hos voksne kvinner, er primært menn og embryoer i linjen egnet for å oppdage estrogenic effekter. (BF: bright field, mCherry: rød fluorescerende filtervisning, enkle slettebilder, Skala bar A: 5mm, skala bar B: 250 μm) Vennligst klikk her for å se en større versjon av dette tallet.
I likhet med den endogene vitellogenin, er mCherry reporter bare uttrykt i leveren. Fordi vitellogenin bare produseres i nærvær av østrogen, er det ingen fluorescerende signal i kontrollene. Fordi uttrykket er bare i leveren, er evalueringen av resultatene mye enklere15.
Følsomheten og brukervennligheten til denne linjens embryoer har blitt undersøkt på ulike estrogenic sammensatte blandinger og også på miljøprøver15,,20, og i de fleste tilfeller dose-respons relasjoner ble dokumentert (Figur 2). Men i tilfelle av svært giftig, hovedsakelig hepatotoksisk, stoffer (f.eks zearalenone), bare et svært svakt fluorescerende signal kan være synlig i leveren av behandlede embryoer og maksimal intensitet fluorescerende signal forårsaket kan nås innenfor et svært lite konsentrasjonsområde, noe som gjør det vanskelig å etablere dose-effekt relasjoner20.
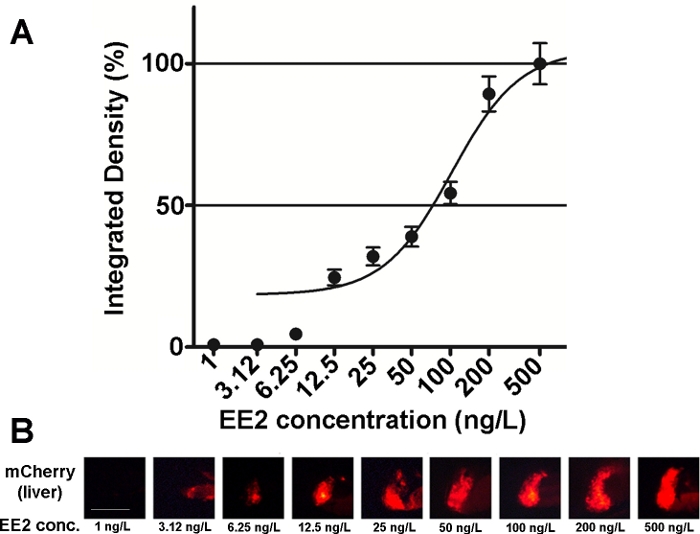
Figur 2: Doseresponsdiagram (A) og fluorescerende bilder (mCherry) i leveren (B) eksponert for 17-α-ethynilestradiol (EE2), i 5 dpf vtg1:mCherry larver. Resultatene uttrykkes som integrert tetthet generert fra signalstyrken og størrelsen på det berørte området (±SEM, n = 60). 100 % refererer til det observerte maksimumet. Fluorescerende signalintensitet økte gradvis med konsentrasjon. Skala bar = 250 μm. Klikk her for å se en større versjon av dette tallet.
Det er flere estrogenic stoffer tilstede i miljøet, som 17-β-østradiol (miljøkonsentrasjon: 0,1–5,1 ng/l)21,17-α-ethynylestradiol (miljøkonsentrasjon: 0,16–0,2 μg/L)22, zearalenone (miljøkonsentrasjon: 0.095–0.22 μg/L)23, bisfenol-A (miljøkonsentrasjon: 0.45–17.2 mg/L)24. Ved testing av disse stoffene i ren aktiv form ved hjelp av mCherry transgene embryoer var de laveste observerte effektkonsentrasjonene (LOEC) for fluorescerende tegndeteksjon 100 ng/l for 17-ß-østradiol, 1 ng/l for 17-α-ethynilestradiol, 100 ng/l for zearalenon, og 1 mg/l for bisfenol-A (96–120 hpf behandling), som er svært nær eller innenfor rekkevidden av miljøkonsentrasjoner av stoffene15. Tg(vtg1:mCherry) transgene linjen kan bidra til å oppdage estrogenicity i avløpsvannprøver etter direkte eksponering. Linjen er like følsom som den vanlige gjær østrogen test, bioluminiscent gjær østrogen (BLYES) analyse15. Ved hjelp av denne linjen har de beskyttende effektene av beta-cyklodekstrin mot zearalenon-indusert toksisitet blitt bekreftet ved hjelp av kjemiske blandinger20.
I en fersk rapport ble in vivo bruk av den transgene linjen demonstrert ved hjelp av to estrogenic zearalenone (ZEA) metabolitter, α- og β-zearalenol (α-ZOL og β-ZOL)25. Protokollen baseline er hensiktsmessig å studere estrogenic effekten av flere forbindelser eller miljøprøver på Tg (vtg1:mCherry) embryoer.
Protocol
Representative Results
Discussion
Bruken av biomonitorer/bioindicatorer for estrogenic effekter har blitt spredt i toksikologiske studier. In vivo-modeller spiller en enestående rolle, fordi i motsetning til in vitro-tester, gir de ikke bare informasjon om responsen fra en celle eller en reseptor, men tillater også undersøkelse av komplekse prosesser i organismen. Flere transgene linjer for å studere estrogenic effekter har blitt produsert fra sebrafisk, hvorav Tg (vtg1:mCherry) ble brukt til disse studiene. Metoden som er beskrevet her illu…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av National Research, Development and Innovation Office (NKFIH) fra National Research, Development and Innovation Fund (NKFIA); Grant Agreement: NVKP_16-1-2016-0003, EFOP-3.6.3-VEKOP-16-2017-00008 prosjekt co-finansiert av EU, og Thematic Excellence Program NKFIH-831-10/2019 av Szent István University, tildelt av Ministry for Innovation and Technology.
Materials
| 24 well tissue culture plate | Jet Biofil | TCP011024 | |
| Calcium-chloride (CaCl2) | Reanal Laborvegyszer Ltd. | 16383-0-27-39 | |
| GraphPad Prism 6.01 software | GraphPad Software Inc. | ||
| ImageJ software | National Institutes of Health, USA | Public access software, downloadable from: http://imagej.nih.gov/ | |
| Leica Application Suite X calibrated software | Leica Microsystems GmbH. | We used the softver described in the experiments, but any photographic software complies with the tests | |
| Leica M205 FA stereomicroscope, Leica DFC 7000T camera | Leica Microsystems GmbH. | We used the equipments described in the experiments, but any fluorescent stereomicroscope is suitable for the tests | |
| Magnesium-sulphate (MgSO4) | Reanal Laborvegyszer Ltd. | 20342-0-27-38 | |
| mCherry filter | Leica Microsystems GmbH. | ||
| Mehyl-cellulose | Sigma Aldrich Ltd. | 274429 | |
| Microloader pipette tip | Eppendorf GmbH. | 5242956003 | |
| Pasteur pipette | VWR International LLC. | 612-1684 | |
| Petri-dish | Jet Biofil | TCD000060 | |
| Potassium-chloride (KCl) | Reanal Laborvegyszer Ltd. | 18050-0-01-33 | |
| Sodium-chloride (NaCl) | Reanal Laborvegyszer Ltd. | 24640-0-01-38 | |
| Tricane-methanesulfonate (MS-222) | Sigma Aldrich Ltd. | E10521 |
References
- Sumpter, J. P. Endocrine Disrupters in the Aquatic Environment : An Overview. Acta Hydrochimica et Hydrobiologica. 33 (1), 9-16 (2005).
- Routledge, E. J., Sumpter, J. P. Estrogenic activity of surfactants and some of their degradation products assessed using a recombinant yeast screen. Environmental Toxicology and Chemistry. 15 (3), 241-248 (1996).
- Sanseverino, J., et al. Use of Saccharomyces cerevisiae BLYES Expressing Bacterial Bioluminescence for Rapid, Sensitive Detection of Estrogenic Compounds. Applied and Environmental Microbiology. 71 (8), 4455-4460 (2008).
- Fetter, E., et al. Effect-directed analysis for estrogenic compounds in a fluvial sediment sample using transgenic cyp19a1b-GFP zebrafish embryos. Aquatic Toxicology. 154, 221-229 (2014).
- Gorelick, D. A., Halpern, M. E. Visualization of estrogen receptor transcriptional activation in zebrafish. Endocrinology. 152 (7), 2690-2703 (2011).
- Rider, C. V., Hartig, P. C., Cardon, M. C., Wilson, V. S. Development of a competitive binding assay system with recombinant estrogen receptors from multiple species. Toxicology Letters. 184 (2), 85-89 (2009).
- Gunnarsson, L., Kristiansson, E., Förlin, L., Nerman, O., Larsson, J. Sensitive and robust gene expression changes in fish exposed to estrogen – a microarray approach. BMC Genomics. 8 (149), 1-9 (2007).
- Vander Ven, L. T. M., et al. Vitellogenin expression in zebrafish Danio rerio evaluation by histochemistry, immunohistochemistry, and in situ mRNA hybridisation. Aquatic Toxicology. 65 (1), 1-11 (2003).
- Bakos, K., et al. Developmental toxicity and estrogenic potency of zearalenone in zebrafish (Danio rerio). Aquatic Toxicology. 136-137, 13-21 (2013).
- Strähle, U., et al. Zebrafish embryos as an alternative to animal experiments – A commentary on the definition of the onset of protected life stages in animal welfare regulations. Reproductive Toxicology. 33 (2), 128-132 (2012).
- Tsang, M. Zebrafish : A Tool for Chemical Screens. Birth Defects Research, Part C. 90 (3), 185-192 (2010).
- Hill, A. J., Teraoka, H., Heideman, W., Peterson, R. E. Zebrafish as a model vertebrate for investigating chemical toxicity. Toxicological Sciences. 86 (1), 6-19 (2005).
- Lee, C., Na, J. G., Lee, K., Park, K. Choriogenin mRNA induction in male medaka, Oryzias latipes as a biomarker of endocrine disruption. Aquatic Toxicology. 61 (3-4), 233-241 (2002).
- Chen, H., et al. Generation of a fluorescent transgenic zebrafish for detection of environmental estrogens. Aquatic Toxicology. 96 (1), 53-61 (2010).
- Bakos, K., et al. Estrogen sensitive liver transgenic zebrafish (Danio rerio) line (Tg(vtg1:mCherry)) suitable for the direct detection of estrogenicity in environmental samples. Aquatic Toxicology. 208, 157-167 (2019).
- Abdelmoneim, A., Clark, C., Mukai, M. Fluorescent reporter zebrafish line for estrogenic compound screening generated using a CRISPR/Cas9-mediated knock-in system. Toxicological Sciences. 173 (2), 336-346 (2019).
- Tong, S. K., et al. A cyp19a1b-GFP (aromatase B) transgenic zebrafish line that expresses GFP in radial glial cells. Genesis. 47 (2), 67-73 (2009).
- Segner, H. Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology. 149 (2), 187-195 (2009).
- Klinge, C. M. Estrogen receptor interaction with estrogen response elements. Nucleic Acids Res. 29 (14), 2905-2919 (2001).
- Faisal, Z., et al. Protective effects of beta-cyclodextrins vs. zearalenone-induced toxicity in HeLa cells and Tg(vtg1:mCherry) zebrafish embryos. Chemosphere. 240, 1-11 (2020).
- Kolpin, D. W., et al. Pharmaceuticals, hormones, and other organic wastewater contaminants in U.S. streams, 1999-2000: A national reconnaissance. Environmental Science and Technology. 36 (6), 1202-1211 (2002).
- Kuch, H. M., Ballschmiter, K. Determination of endocrine-disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range. Environmental Science and Technology. 35 (15), 3201-3206 (2001).
- Lundgren, M. S., Novak, P. J. Quantification of phytoestrogens in industrial waste streams. Environmental Toxicology and Chemistry. 28 (11), 2318-2323 (2009).
- Masoner, J. R., Kolpin, D. W., Furlong, E. T., Cozzarelli, I. M., Gray, J. L. Landfill leachate as a mirror of today’s disposable society: Pharmaceuticals and other contaminants of emerging concern in final leachate from landfills in the conterminous United States. Environmental Toxicology and Chemistry. 35 (4), 906-918 (2016).
- Panel on Additives and Products or Substances used in Animal Feed (FEEDA). EFSA Statement on the establishment of guidelines for the assessment of additives from the functional group ‘substances for reduction of the contamination of feed by mycotoxins’ 1 EFSA. EFSA Journal. 8 (7), 1-8 (2010).
- Braunbeck, T., et al. Towards an alternative for the acute fish LC(50) test in chemical assessment: the fish embryo toxicity test goes multi-species – an update. Altex. 22 (50), 87-102 (2005).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ober, E. A., Field, H. A., Stainier, D. Y. R. From endoderm formation to liver and pancreas development in zebrafish. Mechanisms of Development. 120 (1), 5-18 (2003).
- Tao, T., Peng, J. Liver development in zebrafish (Danio rerio). Journal of Genetics and Genomics. 36 (6), 325-334 (2009).
- Shier, W. T., Shier, A. C., Xie, W., Mirocha, C. J. Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins. Toxicon. 39 (9), 1435-1438 (2001).
- Panel, E., Chain, F. Appropriateness to set a group health-based guidance value for zearalenone and its modified forms EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA Journal. 14, 4425 (2016).
- Binder, E. M. Managing the risk of mycotoxins in modern feed production. Animal Feed Science and Technology. 133 (1-2), 149-166 (2007).
- Risa, A., Krifaton, C., Kukolya, J., Kriszt, B., Cserháti, M., Táncsics, A. Aflatoxin B1 and Zearalenone-Detoxifying Profile of Rhodococcus Type Strains. Current Microbiology. 75 (7), 907-917 (2018).

