石英晶体微平衡测量中的蛋白质吸附和聚合物力学的样品制备
Summary
石英晶体微平衡可为微米或亚微米范围内的薄膜提供精确的质量和粘弹性特性,与生物医学和环境传感、涂料和聚合物科学的研究相关。样品厚度影响可以从与传感器接触的材料中获得哪些信息。
Abstract
在这项研究中,我们提供了各种例子,说明石英晶体微平衡实验的薄膜制备如何为数据的适当建模提供信息,并确定可以量化薄膜的特性。石英晶体微平衡通过观察石英晶体在高频振荡的机械共振变化,为测量应用薄膜的质量变化和/或机械性能提供了一个独特的敏感平台。这种方法的优点包括其实验多功能性、研究各种实验时间长度内性能变化的能力,以及使用小样本尺寸。我们证明,根据沉积在传感器上的层的厚度和剪切模量,我们可以从材料中获得不同的信息。在这里,这一概念被专门用于显示实验参数,从而在膨胀期间对黄金和聚电解质复合物的吸附胶原蛋白进行质量和粘弹性计算,作为盐浓度的函数。
Introduction
石英晶体微平衡 (QCM) 利用石英晶体的压电效应来监测其谐振频率,该频率取决于附着在表面的质量。该技术将 AT 切割石英晶体传感器(通常在 5 MHz 范围内)1在空气或流体中的谐振频率和带宽与薄膜沉积后传感器的频率和带宽进行比较。使用 QCM 研究薄膜特性和界面有几个好处,包括对质量的高灵敏度和潜在的粘弹性特性变化(取决于样品均匀性和厚度),在原位2处进行研究的能力,以及比传统的流变流变学或动态机械分析 (DMA) 更短的流变时间刻度的能力。探测一个较短的流变时间刻度可以观察这个时间尺度的响应在极短(ms)3和长(年)持续时间4中的变化。这种能力有利于研究各种动力学过程,也是传统测变技术5,6的有用延伸。
QCM 的高灵敏度也导致其大量用于研究极小生物分子基本相互作用的生物应用。未涂布或功能化的传感器表面可用于研究蛋白质吸附;更进一步说,通过酶、抗体和贴合剂之间的复杂结合事件进行生物感应,可以根据质量7、8、9的变化进行检测。例如,该技术已经用于了解囊泡到平面脂质双层的转化,作为吸附含液体的囊泡到刚性结构的两相过程,通过观察相关的频率和粘弹性10的变化。近年来,QCM还提供了一个强大的平台来监测囊泡或纳米粒子11的药物输送。在材料工程与分子和细胞生物学的交叉点,我们可以使用QCM阐明材料与蛋白质、核酸、脂质体和细胞等生物活性成分之间的关键相互作用。例如,蛋白质吸附到生物材料中调解下游细胞反应,如炎症,并经常用作生物相容性的积极指标,而在其他情况下,细胞外蛋白附着在涂层上,与血液结合,可诱导血管中危险的凝血。因此,QCM 可用作选择最适合不同需求的候选者的工具。
执行QCM实验的两种常见方法从实验中收集类似的数据:第一种方法记录电导峰值的频率偏移和半带宽(+)。第二种方法,具有耗散的QCM(QCM-D),通过方程1、14记录频率偏移和耗散因子,这与α成正比
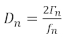 (1)
(1)
其中D是耗散因子,而 * 是频率。D和+都与薄膜对传感器的阻尼效应有关,后者指示薄膜的刚度。下标n表示频率泛音或谐波,即石英传感器的奇数谐振频率(n = 1、3、5、7…)。在约翰斯曼14和舒尔组15、16、17、18的回顾中,可以进一步讨论使用多谐波来获得薄膜质量和粘弹性特性的模型。
准备 QCM 样品的一个关键考虑因素是如何将薄膜涂在传感器表面。一些常见的方法包括旋转涂层,浸渍涂层,滴涂层,或吸附膜到传感器表面的实验19,20。QCM 样品有四个区域:绍尔布雷极限、粘弹性制度、散装制度和过度阻尼制度。对于足够薄的薄膜,应用 Sauerbrey 限制,其中频率偏移(μ+)提供薄膜的表面质量密度。在Sauerbrey极限内,频率偏移与谐振谐波、n和阻尼因子(D或d+)的变化一般较小。”在此制度下,没有作出其他假设,就没有足够的信息来唯一地确定层的经变性质。此制度中的数据用于计算薄膜的表面质量密度(或厚度,如果密度已知为先验) 。在与晶体接触的介质足够厚的散装体中,消逝的剪切波在被完全阻尼之前传播到介质中。在这里,不能使用α获得质量信息。然而,在这个区域,粘弹性特性是使用β和+15、18的组合可靠地确定的。在散装系统中,如果介质太硬,薄膜会抑制传感器的谐振,从而阻止从 QCM 收集任何可靠数据。粘弹性系统是薄膜足够薄,使剪切波在薄膜中完全传播的中间体,对阻尼因子具有可靠的值。阻尼因子和α可用于确定薄膜的粘弹性特性及其质量。在这里,粘弹性特性由复杂剪切模量的密度和幅度的乘积给出|G|p和由 [ = 弧形 (G’ / G’) 给出的相位角度。当薄膜在Sauerbrey极限下制备时,单位面积的质量可以直接根据低于21所示的Sauerbrey方程计算。
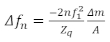 (2)
(2)
其中μ n是谐振频率的变化,n是感兴趣的泛音,α1是传感器的谐振频率,μm / A是薄膜每个区域的质量,Zq是石英的声学阻抗,对于 AT 切割石英的声阻抗是Zq = 8.84 x 106kg / m2s。 粘弹性系统最适合于聚合物薄膜的研究,体积极限可用于研究粘性聚合物22或蛋白质溶液16。不同的制度取决于感兴趣材料的特性,全粘弹性和质量表征的最佳厚度通常随着薄膜刚度的增加而增加。图 1描述了薄膜的虚密度、复杂剪切模量和相角的四个区域,其中我们假定相角和薄膜刚度之间存在特定关系,已证明与此类材料相关。许多实际感兴趣的薄膜太厚,无法用QCM研究粘弹性特性,例如某些生物膜,其厚度在几十至几百微米23。这种厚膜通常不适合使用QCM进行研究,但可以使用低频率的共振器(如扭转共振器)23进行测量,使剪切波进一步传播到薄膜中。
要确定哪种系统与给定的QCM样品相关,必须了解d/+n参数,即石英晶体传感器(μn)15、16、18的膜厚度(d)与机械振荡的剪切波长之比。理想的粘弹性机制是d / μn = 0.05 – 0.218,其中低于 0.05 的值在 Sauerbrey 限制内,高于 0.2 的值接近散装系统。d /=n的更严格描述在别处提供了15、18,但它是一个定量参数,用于描述 Sauerbrey 极限和粘弹性极限。下面使用的分析程序直接提供此参数。
使用 QCM 分析薄膜还有一些额外的限制。Sauerbrey 和粘弹性计算假定薄膜在整个薄膜厚度和在 QCM 的电极表面横向均质。虽然这一假设使得研究存在空隙或填充物的薄膜变得具有挑战性,但一些QCM对由移植纳米粒子6组成的薄膜进行了一些QCM调查。如果异质性与整体薄膜厚度相比较小,则仍可获得复合材料系统的可靠粘弹性特性。对于更多异构系统,应始终非常谨慎地看待从粘弹性分析中获得的值。理想情况下,从未知异质性系统获得的结果应针对已知均质的系统进行验证。这是我们在本文描述的示例系统中采用的方法。
本文中阐述的一个重要点是,在频域(报告*)中进行的 QCM 测量与时域实验(其中D报告)之间的精确对应关系。介绍了两个不同的QCM实验的结果,一个时域和一个频域,每个实验都涉及一个不同的但概念上相关的模型系统。第一个系统是胶原蛋白附着到传感器上的一个简单示例,用于说明在时域 (QCM-D) 测量期间具有代表性的绑定动力学和随着时间的推移的吸附平衡。胶原蛋白是体内最丰富的蛋白质,以其结合行为和形态的多功能性而闻名。此处使用的胶原蛋白溶液不需要传感器的黄金表面进行额外的功能化,以诱导吸附9。第二个实验系统是一种聚电解质复合物(PEC),由阴离子聚苯乙烯磺酸(PSS)和阳离子聚苯甲酸酯(二甲基氨)(PDADMA)组成,其制备方式与萨德曼等人22号相同。这些材料在盐中膨胀并变得柔软(本例中为KBr),为使用频域方法(QCM-Z)研究聚合物力学提供了一个简单的平台。对于每个协议,准备、获取和分析测量的过程如图2 所示。原理图表明,QCM-Z和QCM-D方法的主要区别在于数据收集步骤和实验中使用的仪器。所有上述样品制备技术都与这两种方法兼容,每种方法都可以分析图1所示的三个区域中的样本。
我们的数据表明,样品的制备,无论是通过传感器涂层在测量之前还是在测量过程中,决定了提取系统粘弹性特性的能力。通过适当地设计实验的早期阶段,我们可以确定在分析步骤中我们可以准确收集哪些信息。
Protocol
Representative Results
Discussion
胶原蛋白吸附结果跨越绍尔布雷和粘弹性机制。通过绘制标准化到相应谐波数的频率偏移图,我们观察到 Sauerbrey 限值在大约测量的前 2 小时内适用。然而,随着传感器质量的增大,第三次和第五次谐波的标准化频率变化开始彼此偏离(t > 2 h),表明能够确定吸附膜的粘弹性特性。
软件的粘弹性建模结果与 Shull 组中的功率定律建模之间的直接比较表明计算材料属性存?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
这项工作得到了 NSF (DMR-1710491, OISE-1743748) 的支持。J.R. 和 E.S. 感谢 NSF (DMR-1751308) 的支持。
Materials
| Acetic acid | Sigma-Aldrich | A6283 | For collagen adsorption |
| Ammonium hydroxide solution | Sigma-Aldrich | 221228 | For collagen adsorption |
| Aqueous QCM probe | AWSensors | CLS 00050 A | For polyelectrolyte swelling |
| Collagen I Rat Protein, Tail | Thermo Fisher Scientific | A1048301 | For collagen adsorption |
| Distilled water | Sigma-Aldrich | EM3234 | For polyelectrolyte swelling; generally easy to acquire in research labs, but there is a catalog number in case it is not accessible |
| Ethanol | Sigma-Aldrich | 793175-1GA-PB | For polyelectrolyte swelling |
| Gibco Phosphate Buffered Saline | Thermo Fisher Scientific | 20012-027 | For collagen adsorption |
| Hellmanex III | Sigma-Aldrich | Z805939 | For collagen adsorption |
| Hydrogen peroxide solution | Sigma-Aldrich | 216763 | For collagen adsorption |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666A | For polyelectrolyte swelling |
| NP2K VNA | Makarov Instruments | For polyelectrolyte swelling | |
| Poly(diallyldimethylammonium chloride), MW 200,000 | Sigma-Aldrich | 409022 | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Poly(styrene-sulfonate) sodium salt 30% weight in water | Sigma-Aldrich | 561967-500G | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Potassium Bromide | Sigma-Aldrich | 793604-1KG | For polyelectrolyte swelling |
| QSense QCM Explorer System | Biolin Scientific | For collagen adsorption | |
| Sodium acetate, anhydrous | Sigma-Aldrich | S2889 | For collagen adsorption |
| Spin coater, Model WS-650MZ-23NPP | Laurell technologies | For polyelectrolyte swelling |
References
- Marx, K. A. Quartz crystal microbalance: A useful tool for studying thin polymer films and complex biomolecular systems at the solution – Surface interface. Biomacromolecules. 4 (5), 1099-1120 (2003).
- Kleber, C., Hilfrich, U., Schreiner, M. In situ QCM and TM-AFM investigations of the early stages of degradation of silver and copper surfaces. Applied Surface Science. 253 (7), 3712-3721 (2007).
- Yeh, C. J., Hu, M., Shull, K. R. Oxygen Inhibition of Radical Polymerizations Investigated with the Rheometric Quartz Crystal Microbalance. Macromolecules. 51 (15), 5511-5518 (2018).
- Sturdy, L. F., Yee, A., Casadio, F., Shull, K. R. Quantitative characterization of alkyd cure kinetics with the quartz crystal microbalance. Polymer. 103, 387-396 (2016).
- Delgado, D. E., Sturdy, L. F., Burkhart, C. W., Shull, K. R. Validation of quartz crystal rheometry in the megahertz frequency regime. Journal of Polymer Science, Part B: Polymer Physics. , 1-9 (2019).
- Bilchak, C. R., Huang, Y., Benicewicz, B. C., Durning, C. J., Kumar, S. K. High-Frequency Mechanical Behavior of Pure Polymer-Grafted Nanoparticle Constructs. ACS Macro Letters. 8 (3), 294-298 (2019).
- Hook, F., Rodahl, M., Brzezinski, P., Kasemo, B. Energy dissipation kinetics for protein and antibody-antigen adsorption under shear oscillation on a quartz crystal microbalance. Langmuir. 14, 729-734 (1998).
- Liss, M., Petersen, B., Wolf, H., Prohaska, E. An aptamer-based quartz crystal protein biosensor. Analytical Chemistry. 74 (17), 4488-4495 (2002).
- Felgueiras, H. P., Murthy, N. S., Sommerfeld, S. D., Brás, M. M., Migonney, V., Kohn, J. Competitive Adsorption of Plasma Proteins Using a Quartz Crystal Microbalance. ACS Applied Materials and Interfaces. 8 (21), 13207-13217 (2016).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical Journal. 75, 1397-1402 (1998).
- Olsson, A. L. J., Quevedo, I. R., He, D., Basnet, M., Tufenkji, N. Using the quartz crystal microbalance with dissipation monitoring to evaluate the size of nanoparticles deposited on surfaces. ACS Nano. 7 (9), 7833-7843 (2013).
- Xu, X., Zhang, C., Zhou, Y., Cheng, Q. L. J., Yao, K., Chen, Q. Quartz crystal microbalance study of protein adsorption on chitosan, chitosan/poly(vinyl pyrrolidone) blends and chitosan-graft-poly(vinyl pyrrolidone) surfaces. Journal of Bioactive and Compatible Polymers. 22, 195-206 (2007).
- Weber, N., Pesnell, A., Bolikal, D., Zeltinger, J., Kohn, J. Viscoelastic properties of fibrinogen adsorbed to the surface of biomaterials used in blood-contacting medical devices. Langmuir. 23, 3298-3304 (2007).
- Johannsmann, D. Viscoelastic, mechanical, and dielectric measurements on complex samples with the quartz crystal microbalance. Physical Chemistry Chemical Physics. 10 (31), 4516-4534 (2008).
- Denolf, G. C., Sturdy, L. F., Shull, K. R. High-frequency rheological characterization of homogeneous polymer films with the quartz crystal microbalance. Langmuir. 30 (32), 9731-9740 (2014).
- Martin, E. J., Mathew, M. T., Shull, K. R. Viscoelastic properties of electrochemically deposited protein/metal complexes. Langmuir. 31 (13), 4008-4017 (2015).
- Sturdy, L., Casadio, F., Kokkori, M., Muir, K., Shull, K. R. Quartz crystal rheometry: A quantitative technique for studying curing and aging in artists’ paints. Polymer Degradation and Stability. 107, 348-355 (2014).
- Sadman, K., Wiener, C. G., Weiss, R. A., White, C. C., Shull, K. R., Vogt, B. D. Quantitative Rheometry of Thin Soft Materials Using the Quartz Crystal Microbalance with Dissipation. Analytical Chemistry. 90 (6), 4079-4088 (2018).
- Wasilewski, T., Szulczyński, B., Kamysz, W., Gębicki, J., Namieśnik, J. Evaluation of three peptide immobilization techniques on a qcm surface related to acetaldehyde responses in the gas phase. Sensors (Switzerland). 18 (11), 1-15 (2018).
- Lvov, Y., Ariga, K., Kunitake, T., Ichinose, I. Assembly of Multicomponent Protein Films by Means of Electrostatic Layer-by-Layer Adsorption. Journal of the American Chemical Society. 117 (22), 6117-6123 (1995).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik. 155 (2), 206-222 (1959).
- Sadman, K., Wang, Q., Chen, Y., Keshavarz, B., Jiang, Z., Shull, K. R. Influence of Hydrophobicity on Polyelectrolyte Complexation. Macromolecules. 50 (23), 9417-9426 (2017).
- Sievers, P., Moß, C., Schröder, U., Johannsmann, D. Use of torsional resonators to monitor electroactive biofilms. Biosensors and Bioelectronics. 110, 225-232 (2018).
- Ringberg, J. Q-Sense Explorer Operator Manual. Biolin Scientific. , (2017).
- Ringberg, J. Q-Sense User Guide: Instrument care and sensor pre-cleaning. Biolin Scientific. , (2015).
- Kern, W. The Evolution of Silicon Wafer Cleaning Technology. Journal of The Electrochemical Society. 137 (6), 1887 (1990).
- Sadman, K. . sadmankazi/QCM-D-Analysis-GUI: QCMD-Analyze. , (2018).

