Preparação de amostras em medições de microequilíbrio de cristal de quartzo de adsorção de proteínas e mecânica de polímeros
Summary
O microequilíbrio de cristal de quartzo pode fornecer propriedades precisas de massa e viscoelásticas para filmes na faixa de mícrons ou submicron, o que é relevante para investigações em sensoriamento biomédico e ambiental, revestimentos e ciência de polímeros. A espessura da amostra influencia quais informações podem ser obtidas a partir do material em contato com o sensor.
Abstract
Neste estudo, apresentamos vários exemplos de como a preparação fina do filme para experimentos de microequilíbrio de cristal de quartzo informa a modelagem adequada dos dados e determina quais propriedades do filme podem ser quantificadas. O microequilíbrio de cristal de quartzo oferece uma plataforma exclusivamente sensível para medir mudanças finas em propriedades de massa e/ou mecânicas de um filme aplicado, observando as mudanças na ressonância mecânica de um cristal de quartzo oscilando em alta freqüência. As vantagens dessa abordagem incluem sua versatilidade experimental, capacidade de estudar mudanças nas propriedades ao longo de uma ampla gama de comprimentos de tempo experimentais e o uso de pequenos tamanhos de amostra. Demonstramos que, com base na espessura e no modulus de cisalhamento da camada depositada no sensor, podemos adquirir informações diferentes do material. Aqui, este conceito é especificamente explorado para exibir parâmetros experimentais, resultando em cálculos em massa e viscoelásticos de colágeno adsorlado em complexos de ouro e polieletrólitos durante o inchaço em função da concentração de sal.
Introduction
O microequilíbrio de cristal de quartzo (QCM) aproveita o efeito piezoelétrico de um cristal de quartzo para monitorar sua frequência ressonante, que depende da massa aderida à superfície. A técnica compara a freqüência ressonante e largura de banda de um sensor de cristal de quartzo at corte (normalmente na faixa de 5 MHz)1 no ar ou um fluido para a freqüência e largura de banda do sensor após a deposição de um filme. Existem vários benefícios para o uso do QCM para estudar propriedades e interfaces de película fina, incluindo a alta sensibilidade à massa e potencialmente a mudanças de propriedade viscoelásticas (dependendo da uniformidade e espessura da amostra), a capacidade de realizar estudos in situ2,e a capacidade de sondar uma escala de tempo reológica muito mais curta do que a reologia tradicional da tesoura ou análise dinâmica mecânica (DMA). Sondar um curto calendário reológico permite a observação de como a resposta neste período de tempo muda tanto ao longo de durações extremamente curtas (ms)3 e longas (anos)4. Esta capacidade é benéfica para o estudo de uma variedade de processos cinéticos e também é uma extensão útil das técnicas rheométricas tradicionais5,6.
A alta sensibilidade do QCM também levou ao seu uso pesado em aplicações biológicas estudando as interações fundamentais de biomoléculas extremamente pequenas. Uma superfície de sensor não revestida ou funcionalizada pode ser usada para investigar a adsorção de proteínas; ainda mais, biosensoriar através de eventos de ligação complexos entre enzimas, anticorpos e aptamers pode ser examinado com base em mudanças na massa7,8,9. Por exemplo, a técnica tem sido usada para entender a transformação das vesículas em um bilayer lipídico planar como um processo de duas fases de adsorção de vesículas contendo fluidos para uma estrutura rígida, observando mudanças correlacionantes na frequência e viscoelasticidade10. Nos últimos anos, o QCM também ofereceu uma plataforma robusta para monitorar a entrega de drogas por vesículas ou nanopartículas11. Na interseção da engenharia de materiais e da biologia molecular e celular, podemos usar o QCM para elucidar as principais interações entre materiais e componentes bioativos, como proteínas, ácidos nucleicos, lipossomos e células. Por exemplo, adsorção de proteína a um biomaterial medeia respostas celulares a jusante, como inflamação e é frequentemente usada como um indicador positivo de biocompatibilidade, enquanto em outros casos o apego de proteína extracelular a revestimentos que a interface com o sangue pode induzir coagulação perigosa nos vasos12,13. O QCM pode, portanto, ser usado como uma ferramenta para selecionar candidatos ideal para diferentes necessidades.
Duas abordagens comuns para a realização de experimentos de QCM coletam dados análogos do experimento: a primeira abordagem registra a mudança de frequência e a meia largura de banda(Γ)do pico de condução. A segunda abordagem, O QCM com dissipação (QCM-D), registra a mudança de frequência e o fator de dissipação, que é diretamente proporcional ao Γ por meio da equação 1,14
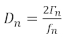 (1)
(1)
onde D é o fator de dissipação e dilema é a freqüência. Tanto D quanto Γ estão relacionados ao efeito de amortecimento que o filme tem no sensor, o que dá uma indicação da rigidez do filme. O subscript n denota o tom de freqüência ou harmônico, que são as freqüências ressonantes ímpares do sensor de quartzo (n = 1, 3, 5, 7…). Uma discussão mais adicional dos modelos que usam harmônicos múltiplos para obter as propriedades maciças e viscoelastic de uma película pode ser encontrada em uma revisão por Johannsmann14 e em papéis precedentes do grupo de Shull15,16,17,18.
Uma consideração fundamental para a preparação de amostras QCM é como aplicar a película fina na superfície do sensor. Alguns métodos comuns incluem revestimento de rotação, revestimento de mergulho, revestimento de gota ou adsorção do filme na superfície do sensor durante o experimento19,20. Há quatro regiões para amostras de QCM: o limite de Sauerbrey, o regime viscoelastic, o regime maioria, e o regime overdamped. Para filmes suficientemente finos, o limite sauerbrey se aplica, onde a mudança de freqüência(δ)fornece a densidade de massa superficial do filme. Dentro do limite sauerbrey, as escalas de deslocamento de freqüência linearmente com o harmônico ressonante, n, e as mudanças no fator de amortecimento (D ou Γ) são geralmente pequenas. Neste regime, não há informações suficientes para determinar exclusivamente as propriedades reológicas da camada sem fazer suposições adicionais. Os dados deste regime são usados para calcular a densidade de massa superficial (ou espessura se a densidade é conhecida a priori) do filme. No regime a granel, onde o meio em contato com o cristal é suficientemente grosso, a onda de cisalhamento evanescente se propaga para o meio antes de ser completamente atenuada. Aqui, nenhuma informação de massa pode ser obtida usando δ. No entanto, nesta região, as propriedades viscoelásticas são determinadas de forma confiável usando a combinação de Δdecidida e ΔΓ 15,18. No regime a granel, se o meio for muito rígido, o filme vai amortecer a ressonância do sensor, impedindo a coleta de quaisquer dados confiáveis do QCM. O regime viscoelástico é o regime intermediário onde o filme é fino o suficiente para ter a onda de cisalhamento totalmente propagar através do filme, bem como têm valores confiáveis para o fator de amortecimento. O fator de amortecimento e δpodem então ser usados para determinar as propriedades viscoelásticas do filme, bem como a sua massa. Aqui, as propriedades viscoelásticas são dadas pelo produto da densidade e da magnitude do complexo modulus cisalhamento | G*| G *| p e o ângulo de fase dado por Φ = arctan (G” / G’). Quando os filmes são preparados no limite de Sauerbrey, a massa por unidade pode ser calculada diretamente com base na equação sauerbrey mostrada abaixo de21,
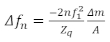 (2)
(2)
onde Δn é a mudança na frequência ressonante, n é o tom de interesse, hidrobordo1 é a frequência ressonante do sensor, Δm/A é a massa por área do filme, e Z q é a impedância acústica de quartzo, que para o quartzo cortado at é Z q = 8,84 x 106kg / m2s. O regime viscoelástico é mais apropriado para o estudo de filmes de polímeros, e o limite de massa é útil para estudar polímero viscoso22 ou soluções proteicas16. Os diferentes regimes dependem das propriedades do material de interesse, com a espessura ideal para caracterização viscoelástica e em massa geralmente aumentando com a rigidez do filme. A Figura 1 descreve as quatro regiões com relação à densidade areal do filme, modulus cisalhamento complexo e ângulo de fase, onde assumimos uma relação específica entre o ângulo de fase e a rigidez do filme que se mostrou relevante para materiais deste tipo. Muitos filmes de interesse prático são muito grossos para estudar as propriedades viscoelásticas com QCM, como certos biofilmes, onde as espessuras estão na ordem de dezenas a centenas de mícrons23. Tais filmes grossos geralmente não são apropriados para estudar usando o QCM, mas podem ser medidos usando ressonadores de frequência muito mais baixa (como ressonadores torsionais)23,permitindo que a onda de cisalhamento se propague ainda mais no filme.
Para determinar qual regime é relevante para uma determinada amostra de QCM, é importante entender o parâmetro d/λ n, que é a razão da espessura do filme(d)para o comprimento de onda de cisalhamento da oscilação mecânica do sensor de cristal de quartzo (λn)15,16,18. O regime viscoelástico ideal é d / λn = 0,05 – 0,218, onde os valores abaixo de 0,05 estão dentro do limite sauerbrey e valores acima de 0,2 abordagem do regime a granel. Uma descrição mais rigorosa de d / λn é fornecido em outros lugares15,18, mas é um parâmetro quantitativo delineando o limite Sauerbrey e o limite viscoelástico. Os programas de análise usados abaixo fornecem esse parâmetro diretamente.
Existem algumas limitações adicionais para analisar filmes finos com o QCM. Os cálculos sauerbrey e viscoelásticos assumem que o filme é homogêneo tanto ao longo da espessura do filme quanto lateralmente na superfície do eletrodo do QCM. Embora essa suposição torne difícil estudar filmes que tenham vazios ou enchimentos presentes, houve algumas investigações da QCM em filmes que consistem em nanopartículas enxertadas6. Se as heterogeneidades são pequenas em comparação com a espessura geral do filme, propriedades viscoelásticas confiáveis do sistema composto ainda podem ser obtidas. Para sistemas mais heterogêneos, os valores obtidos a partir de uma análise viscoelástica devem ser sempre vistos com grande cautela. Idealmente, os resultados obtidos a partir de sistemas com heterogeneidade desconhecida devem ser validados contra sistemas que são conhecidos por serem homogêneos. Esta é a abordagem que tomamos no sistema de exemplo descrito neste artigo.
Um ponto importante que ilustramos neste artigo é a correspondência exata entre as medições de QCM feitas no domínio de frequência (onde o Γ é relatado) e os experimentos de domínio do tempo (onde D é relatado). Resultados de dois experimentos diferentes de QCM, domínio de uma vez e um domínio de frequência, são descritos, cada um envolvendo um sistema de modelo diferente, mas conceitualmente relacionado. O primeiro sistema é um exemplo simples de apego de colágeno ao sensor para ilustrar cinética sem ligarepresentativa e equilíbrio de adsorção ao longo do tempo durante uma medição de domínio de tempo (QCM-D). O colágeno é a proteína mais abundante no corpo, conhecida por sua versatilidade de comportamentos de ligação e morfologia. A solução de colágeno usada aqui não requer funcionalização adicional da superfície de ouro do sensor para induzir adsorção9. O segundo sistema experimental é um complexo de polieletrólito (PEC) composto por sulfona de poliestireno aniônico (PSS) e poli cationic (diallyldimethylammonium) (PDADMA) preparado da mesma forma que Sadman et al.22. Estes materiais incham e tornam-se macios em soluções de sal (KBr neste caso), oferecendo uma plataforma simples para estudar a mecânica de polímeros usando uma abordagem de domínio de frequência (QCM-Z). Para cada protocolo, o processo de preparação, tomada e análise de uma medição é mostrado na Figura 2. O esquema mostra que a principal diferença entre as abordagens QCM-Z e QCM-D está na etapa de coleta de dados e na instrumentação utilizada no experimento. Todas as técnicas de preparação de amostras mencionadas são compatíveis com ambas as abordagens, e cada abordagem pode analisar amostras nas três regiões descritas na Figura 1.
Nossos dados demonstram que a preparação das amostras, seja pelo revestimento do sensor antes ou durante uma medição, dita a capacidade de extrair as propriedades viscoelásticas de um sistema. Ao projetar os estágios iniciais de um experimento adequadamente, podemos determinar quais informações podemos coletar com precisão durante a etapa de análise.
Protocol
Representative Results
Discussion
Os resultados da adsorção de colágeno abrangem os regimes sauerbrey e viscoelásticos. Ao traçar as mudanças de frequência normalizadas para o número harmônico correspondente, observamos que o limite de Sauerbrey é válido para aproximadamente os primeiros 2 h da medição. Com o aumento da adesão em massa ao sensor, no entanto, as mudanças de frequência normalizadas para o terceiro e quinto harmônicos começam a desviar-se um do outro(t > 2 h), indicando uma capacidade de determinar propriedades vi…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pelo NSF (DMR-1710491, OISE-1743748). J.R. e E.S. reconhecem o apoio da NSF (DMR-1751308).
Materials
| Acetic acid | Sigma-Aldrich | A6283 | For collagen adsorption |
| Ammonium hydroxide solution | Sigma-Aldrich | 221228 | For collagen adsorption |
| Aqueous QCM probe | AWSensors | CLS 00050 A | For polyelectrolyte swelling |
| Collagen I Rat Protein, Tail | Thermo Fisher Scientific | A1048301 | For collagen adsorption |
| Distilled water | Sigma-Aldrich | EM3234 | For polyelectrolyte swelling; generally easy to acquire in research labs, but there is a catalog number in case it is not accessible |
| Ethanol | Sigma-Aldrich | 793175-1GA-PB | For polyelectrolyte swelling |
| Gibco Phosphate Buffered Saline | Thermo Fisher Scientific | 20012-027 | For collagen adsorption |
| Hellmanex III | Sigma-Aldrich | Z805939 | For collagen adsorption |
| Hydrogen peroxide solution | Sigma-Aldrich | 216763 | For collagen adsorption |
| Kimberly-Clark Professional Kimtech Science Kimwipes Delicate Task Wipers, 1-Ply | Fisher Scientific | 06-666A | For polyelectrolyte swelling |
| NP2K VNA | Makarov Instruments | For polyelectrolyte swelling | |
| Poly(diallyldimethylammonium chloride), MW 200,000 | Sigma-Aldrich | 409022 | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Poly(styrene-sulfonate) sodium salt 30% weight in water | Sigma-Aldrich | 561967-500G | For polyelectrolyte swelling; for full synthesis procedure see Sadman et al. |
| Potassium Bromide | Sigma-Aldrich | 793604-1KG | For polyelectrolyte swelling |
| QSense QCM Explorer System | Biolin Scientific | For collagen adsorption | |
| Sodium acetate, anhydrous | Sigma-Aldrich | S2889 | For collagen adsorption |
| Spin coater, Model WS-650MZ-23NPP | Laurell technologies | For polyelectrolyte swelling |
References
- Marx, K. A. Quartz crystal microbalance: A useful tool for studying thin polymer films and complex biomolecular systems at the solution – Surface interface. Biomacromolecules. 4 (5), 1099-1120 (2003).
- Kleber, C., Hilfrich, U., Schreiner, M. In situ QCM and TM-AFM investigations of the early stages of degradation of silver and copper surfaces. Applied Surface Science. 253 (7), 3712-3721 (2007).
- Yeh, C. J., Hu, M., Shull, K. R. Oxygen Inhibition of Radical Polymerizations Investigated with the Rheometric Quartz Crystal Microbalance. Macromolecules. 51 (15), 5511-5518 (2018).
- Sturdy, L. F., Yee, A., Casadio, F., Shull, K. R. Quantitative characterization of alkyd cure kinetics with the quartz crystal microbalance. Polymer. 103, 387-396 (2016).
- Delgado, D. E., Sturdy, L. F., Burkhart, C. W., Shull, K. R. Validation of quartz crystal rheometry in the megahertz frequency regime. Journal of Polymer Science, Part B: Polymer Physics. , 1-9 (2019).
- Bilchak, C. R., Huang, Y., Benicewicz, B. C., Durning, C. J., Kumar, S. K. High-Frequency Mechanical Behavior of Pure Polymer-Grafted Nanoparticle Constructs. ACS Macro Letters. 8 (3), 294-298 (2019).
- Hook, F., Rodahl, M., Brzezinski, P., Kasemo, B. Energy dissipation kinetics for protein and antibody-antigen adsorption under shear oscillation on a quartz crystal microbalance. Langmuir. 14, 729-734 (1998).
- Liss, M., Petersen, B., Wolf, H., Prohaska, E. An aptamer-based quartz crystal protein biosensor. Analytical Chemistry. 74 (17), 4488-4495 (2002).
- Felgueiras, H. P., Murthy, N. S., Sommerfeld, S. D., Brás, M. M., Migonney, V., Kohn, J. Competitive Adsorption of Plasma Proteins Using a Quartz Crystal Microbalance. ACS Applied Materials and Interfaces. 8 (21), 13207-13217 (2016).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical Journal. 75, 1397-1402 (1998).
- Olsson, A. L. J., Quevedo, I. R., He, D., Basnet, M., Tufenkji, N. Using the quartz crystal microbalance with dissipation monitoring to evaluate the size of nanoparticles deposited on surfaces. ACS Nano. 7 (9), 7833-7843 (2013).
- Xu, X., Zhang, C., Zhou, Y., Cheng, Q. L. J., Yao, K., Chen, Q. Quartz crystal microbalance study of protein adsorption on chitosan, chitosan/poly(vinyl pyrrolidone) blends and chitosan-graft-poly(vinyl pyrrolidone) surfaces. Journal of Bioactive and Compatible Polymers. 22, 195-206 (2007).
- Weber, N., Pesnell, A., Bolikal, D., Zeltinger, J., Kohn, J. Viscoelastic properties of fibrinogen adsorbed to the surface of biomaterials used in blood-contacting medical devices. Langmuir. 23, 3298-3304 (2007).
- Johannsmann, D. Viscoelastic, mechanical, and dielectric measurements on complex samples with the quartz crystal microbalance. Physical Chemistry Chemical Physics. 10 (31), 4516-4534 (2008).
- Denolf, G. C., Sturdy, L. F., Shull, K. R. High-frequency rheological characterization of homogeneous polymer films with the quartz crystal microbalance. Langmuir. 30 (32), 9731-9740 (2014).
- Martin, E. J., Mathew, M. T., Shull, K. R. Viscoelastic properties of electrochemically deposited protein/metal complexes. Langmuir. 31 (13), 4008-4017 (2015).
- Sturdy, L., Casadio, F., Kokkori, M., Muir, K., Shull, K. R. Quartz crystal rheometry: A quantitative technique for studying curing and aging in artists’ paints. Polymer Degradation and Stability. 107, 348-355 (2014).
- Sadman, K., Wiener, C. G., Weiss, R. A., White, C. C., Shull, K. R., Vogt, B. D. Quantitative Rheometry of Thin Soft Materials Using the Quartz Crystal Microbalance with Dissipation. Analytical Chemistry. 90 (6), 4079-4088 (2018).
- Wasilewski, T., Szulczyński, B., Kamysz, W., Gębicki, J., Namieśnik, J. Evaluation of three peptide immobilization techniques on a qcm surface related to acetaldehyde responses in the gas phase. Sensors (Switzerland). 18 (11), 1-15 (2018).
- Lvov, Y., Ariga, K., Kunitake, T., Ichinose, I. Assembly of Multicomponent Protein Films by Means of Electrostatic Layer-by-Layer Adsorption. Journal of the American Chemical Society. 117 (22), 6117-6123 (1995).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik. 155 (2), 206-222 (1959).
- Sadman, K., Wang, Q., Chen, Y., Keshavarz, B., Jiang, Z., Shull, K. R. Influence of Hydrophobicity on Polyelectrolyte Complexation. Macromolecules. 50 (23), 9417-9426 (2017).
- Sievers, P., Moß, C., Schröder, U., Johannsmann, D. Use of torsional resonators to monitor electroactive biofilms. Biosensors and Bioelectronics. 110, 225-232 (2018).
- Ringberg, J. Q-Sense Explorer Operator Manual. Biolin Scientific. , (2017).
- Ringberg, J. Q-Sense User Guide: Instrument care and sensor pre-cleaning. Biolin Scientific. , (2015).
- Kern, W. The Evolution of Silicon Wafer Cleaning Technology. Journal of The Electrochemical Society. 137 (6), 1887 (1990).
- Sadman, K. . sadmankazi/QCM-D-Analysis-GUI: QCMD-Analyze. , (2018).

