Visualizzazione dell'interazione delle proteine di riparazione del DNA per immunofluorescenza
Summary
In seguito al danno al DNA, le cellule umane attivano percorsi di riparazione essenziali per ripristinare l’integrità del loro genoma. Qui, descriviamo il metodo dell’immunofluorescenza indiretta come mezzo per rilevare le proteine di riparazione del DNA, analizzare il loro reclutamento spaziale e temporale e contribuire a interrogare l’interazione proteina-proteina nei siti di danno al DNA.
Abstract
Le cellule dei mammiferi sono costantemente esposte a sostanze chimiche, radiazioni e sotto-prodotti metabolici naturali, che creano tipi specifici di insulti al DNA. Gli agenti genotossici possono danneggiare la spina dorsale del DNA, romperla o modificare la natura chimica delle singole basi. In seguito all’insulto al DNA, vengono attivati percorsi di risposta al danno del DNA (DDR) e vengono reclutate proteine coinvolte nella riparazione. Una pletora di fattori sono coinvolti nel rilevamento del tipo di danno e nell’attivazione della risposta di riparazione appropriata. La mancata attivazione e reclutamento dei fattori DDR può portare all’instabilità genomica, che sta alla base di molte patologie umane, tra cui il cancro. Studi sulle proteine DDR possono fornire informazioni sulla risposta ai farmaci genotossici e sui meccanismi cellulari della resistenza ai farmaci.
Ci sono due modi principali per visualizzare le proteine in vivo:l’osservazione diretta, etichettando la proteina di interesse con una proteina fluorescente e seguendola mediante imaging dal vivo, o immunofluorescenza indiretta su campioni fissi. Mentre la visualizzazione delle proteine con tag fluorescenti consente un monitoraggio preciso nel tempo, l’etichettatura diretta in N- o C-terminus può interferire con la localizzazione o la funzione delle proteine. L’osservazione delle proteine nella loro versione non modificata ed endogena è preferita. Quando le proteine di riparazione del DNA vengono reclutate nell’insulto del DNA, la loro concentrazione aumenta localmente e formano gruppi, o “foci”, che possono essere visualizzati dall’immunofluorescenza indiretta utilizzando anticorpi specifici.
Anche se il rilevamento di proteine foci non fornisce una prova definitiva di interazione diretta, la co-localizzazione delle proteine nelle cellule indica che si raggruppano al sito del danno e possono informare della sequenza degli eventi necessari per la formazione complessa. Un’attenta analisi della sovrapposizione spaziale dei foci nelle cellule che esprimono versioni di tipo selvaggio o mutante di una proteina può fornire preziosi indizi su domini funzionali importanti per la funzione di riparazione del DNA. Infine, la co-localizzazione delle proteine indica possibili interazioni dirette che possono essere verificate dalla co-immunoprecipizione nelle cellule o dal pulldown diretto utilizzando proteine purificate.
Introduction
Le cellule umane sono costantemente esposte a una varietà di agenti dannosi per il DNA di varie origini. Le fonti esogene sono per lo più costituite da esposizione a radiazioni, sostanze chimiche (compresi agenti chemioterapici e alcuni antibiotici), e virus, mentre le principali fonti endogene includono errori nella replicazione del DNA e nello stress ossidativo. Gli effetti diretti dell’esposizione genotossica possono variare da una base modificata a una rottura del doppio filamento del DNA potenzialmente letale (DSB), a seconda dello stress e della dose di esposizione. In definitiva, danni al DNA non riparati o riparati in modo improprio possono portare all’accumulo di mutazioni, riarrangiamenti genomici, instabilità del genoma e alla fine portare alla carcinogenesi1. Le cellule dei mammiferi hanno sviluppato percorsi complessi per riconoscere specifici tipi di danni al DNA2,3 e ripararli in modo tempestivo, sincronizzati con la progressione del ciclo cellulare.
Le radiazioni ionizzanti (IR) danneggiano la doppia elica del DNA e creano rotture a doppio filamento (DSB), una delle forme più deleteri di danno al DNA. Il complesso MRN (MRE11, RAD50, NBS1) funziona come un sensore di DNA termina e attiva la proteina chinasi ataxia telangiectasia mutato (ATM)4,5. Dopo l’attivazione iniziale di ATM da fini dna, ATM innesca una cascata di eventi DDR sul sito della rottura, avviando con un evento chiave, la fosforilazione della variante istone H2AX6. La fosforilazione H2AX sui residui S139 la attiva in γH2AX, che si estende su regioni fino a megabase intorno alla lesione del DNA6,7,8,9. Questo evento aumenta l’accessibilità del DNA, portando al reclutamento e all’accumulo di altre proteine di riparazione del DNA7. Poiché γH2AX è abbondantemente e specificamente indotto DSBs circostanti, può essere facilmente visualizzata utilizzando anticorpi specifici, ed è comunemente usato come marcatore surrogato per DSB nel campo di riparazione del DNA. Una volta segnalata la rottura, le cellule attivano le loro vie di riparazione del DNA ed elaborano il danno al DNA. La proteina MDC1 (mediatore della proteina checkpoint del danno al DNA 1) lega direttamente γH2AX10,interagisce con ATM11 e anche con NBS112,,13. Contribuisce ad aumentare la concentrazione del complesso MRN presso il DSB e ad avviare un ciclo di feedback ATM positivo. γH2AX viene rapidamente rimosso una volta riparata la rottura, consentendo di conseguenza il monitoraggio dell’autorizzazione DSB. Seguita dalla microscopia, la diminuzione della γH2AX nel tempo fornisce una misurazione indiretta delle rotture residue e dell’efficienza di riparazione del DNA.
Le cellule eucariotiche possono riparare i DSB da diversi percorsi, mentre le due principali sono l’unione finale non omologa (NHEJ) e la ricombinazione omologa (HR) (Figura 1). NHEJ lega essenzialmente il DNA a doppio filamento termina senza l’uso di omologia estesa e opera per tutto il ciclocellulare 14,15. HR diventa predominante durante le fasi S e G2, ed è altrimenti represso, dal momento che richiede una sorella cromata come modello omologa per lariparazione 14,16. La scelta del percorso tra NHEJ e HR dipende non solo dalla vicinanza fisica della sorella cromatica, ma anche dall’estensione della resezione finale del DNA17, che inibisce NHEJ.
La riparazione DSB dipendente dall’omologia inizia con la degradazione nucleolitica del filamento 5′ dalle estremità di rottura per generare code di DNA a 3′ filamento singolo (ssDNA), un processo denominato resezione 5′-3′. Il complesso MRN avvia la resezione finale del DNA e l’ulteriore resezione viene elaborata in combinazione con BLM/EXO1 (Proteina sindrome di Bloom/esonucleasi 1) o BLM/DNA2 (replicazione del DNA Elicase/nucleasi dipendente da ATP)18,19,20,21,22. La resezione finale del DNA è potenziata dal CtIP (proteina che interagisce con il CtBP) attraverso la sua interazione diretta con il complesso MRN23 e il reclutamento di BRCA1 (proteina di suscettibilità al tipo 1 del cancro al seno)24,25. La proteina di replica A (RPA) si lega prontamente alla ssDNA esposta e viene quindi spostata dalla proteina ricombinata RAD51 per formare un filamento nucleoproteina che catalizza la ricerca omologa e l’invasionedel filamento 26,27,28.
L’avvio della resezione è un passo critico per la scelta del percorso di riparazione. Una volta avviata la resezione, le estremità del DNA diventano substrati poveri per la legazione da parte dell’eterodimero Ku70/Ku80 (componente del percorso NHEJ) e le cellule sono impegnate in HR17,29,30. L’eterodimero Ku70/Ku80 si lega alle estremità DSB, reclutando DNA-PKcs e p53 Binding Protein 1 (53BP1)29,30. 53BP1 agisce come una barriera alla resezione in G1, bloccando così le risorse umane durante la promozione di NHEJ31,32, ma viene rimosso in modo dipendente da BRCA1 nella fase S, consentendo di conseguenza la resezione33,34. Pertanto, 53BP1 e BRCA1 svolgono ruoli opposti nella riparazione DSB, con 53BP1 essendo un facilitatore NHEJ mentre BRCA1 agisce consentendo interruzioni per la riparazione attraverso HR.
In laboratorio, la formazione di DSB può essere indotta da radiazioni ionizzanti (IR). Mentre questo esempio utilizza una dose elevata di 4 Gy, 1 Gy e 2 Gy anche creare una quantità significativa di DSB, adatto per l’analisi della formazione di foci da proteine abbondanti. È importante notare che il tipo e la dose di radiazioni utilizzate possono portare a diverse lesioni nel DNA e nella cellula: mentre l’IR induce ISB, può anche causare rotture di singoli filamenti o modificazione della base (vedi35,36 per un riferimento sul trasferimento di energia lineare di irradiazione (LET) e sul tipo di danno al DNA). Per determinare la cinetica della formazione di foci ionizzanti indotta da radiazioni (IRIF) e la loro distanza, che indicano la riparazione del danno e l’inversione del DDRattivato 8,9,37,38, la formazione di foci può essere monitorata in diversi punti di tempo dopo la radiazione ionizzante. La tempistica di attivazione e di sgombero di tutte le principali proteine danno del DNAè nota 39, e molti sono studiati come marcatori surrogati di eventi chiave. Ad esempio, pRPA, che possiede un’elevata affinità per ssDNA viene utilizzato come surrogato della resezione di rottura, le proteine MRN (MRE11, RAD50, NBS1) e le esonucleasi possono essere utilizzate anche per valutare l’efficienza della resezione. Mentre RAD51, BRCA1, BRCA2 (proteina di suscettibilità al cancro al seno 2) e PALB2 (partner e localizzatore di BRCA2) possono essere monitorati per valutare l’efficienza delle risorse umane, la presenza delle proteine Ku o 53BP1, vengono utilizzati come marcatori di NHEJ(Figura 1).
Poiché le proteine del macchinario per la riparazione del DNA si reclutano a vicenda per la rottura e l’assemblaggio in super-complessi, le interazioni DNA-proteina e proteina-proteina possono essere dedotte seguendo la loro localizzazione individuale nel tempo e analizzando la co-localizzazione delle proteine, come viene visualizzazioneto da segnali sovrapposti nella cella40,41,42. Nelle linee cellulari, l’introduzione di mutazioni puntino o la cancellazione in specifici geni di riparazione del DNA sia attraverso l’editing del genoma, sia per sovraespressione di mutanti a base di plasmidi, consente di eseguire lo studio di residui specifici e del loro possibile ruolo nel riconoscimento del danno al DNA (ad esempio, la co-localizzazione con γH2AX) o di un assemblaggio complesso (co-localizzazione con un’altra o più proteine), nonché il loro impatto sulla riparazione del DNA. Qui, usiamo l’immunofluorescenza indiretta come mezzo per studiare la formazione e la risoluzione dei DSB seguendo γH2AX foci nel tempo. Presentiamo anche un esempio di formazione di foci e analisi di co-localizzazione da parte di un attore importante nella riparazione DSB: p53 Binding Protein 1 (53BP1)32. Come accennato in precedenza, 53BP1 è considerato centrale per la scelta del percorso di riparazione del DNA. Dopo l’accumulo di 53BP1 e la sua co-localizzazione con γH2AX fornisce preziose informazioni sulla fase del ciclo cellulare, l’accumulo di danni al DNA e il percorso utilizzato per riparare i DSB. Lo scopo dell’immunolocalizzazione indiretta è quello di valutare l’efficienza della riparazione dei danni al DNA nelle linee cellulari, seguendo IR come in questo studio, o dopo l’esposizione a varie sollecitazioni nelle cellule, dal collegamento incrociato del DNA al blocco della forchetta di replica (un elenco di agenti dannosi per il DNA è fornito nella tabella 1).
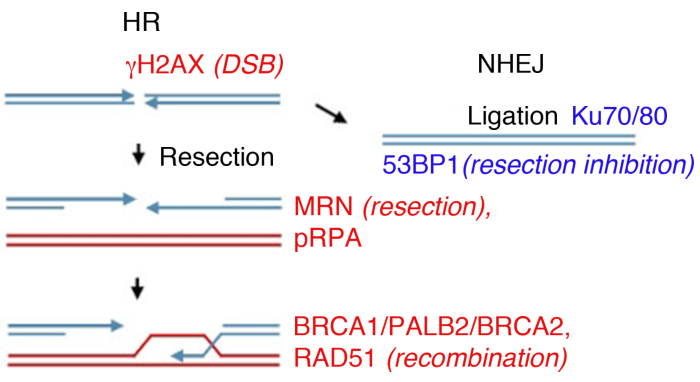
Figura 1: Vie di riparazione del doppio filamento del DNA (DSB).
La riparazione DSB prevede due percorsi principali: la ricombinazione omologa (HR, a sinistra) e l’end-joining non omologho (NHEJ, a destra). Dopo la pausa, le proteine si attivano per contrassegnare la rottura (γH2AX), partecipare alla resezione finale (MRN), rivestire la ssDNA resected (pRPA), promuovere la ricombinazione (BRCA1, PALB2, BRCA2, RAD51) o limitare la resezione e promuovere NHEJ (53BP1). Altre proteine partecipano alla riparazione dei danni, ma le proteine elencate sono regolarmente seguite dall’immunofluorescenza indiretta. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
| Agente dannoso del DNA | Meccanismo d’azione | Dose raccomandata |
| γ/raggi X | Radiazione Formazione di rotture a doppio filamento con alcuni effetti cellulari incontrollati |
1-4 Gy |
| Il numero 36 del 36 Ar ioni | Radiazione Formazione di rotture a doppio filamento |
270 keV/m |
| particelle z | Radiazione Formazione di rotture a doppio filamento |
116 keV/m |
| Bleomicina | Inibitore della sintesi del DNA | 0,4-2 g/mL |
| Camptothecin | Inibitore della topoisomerasi I | 10-200 nM |
| Cisplatino | Agente di Alkylating (inducendo collegamenti incrociati intrastranti) |
0,25-2 M |
| Doxorubicina | Agente intercalante Inibitore della topoisomera II |
10-200 nM |
| Etoposide | Inibitore della topoisomera II | 10 SM |
| Hydroxyurea | Inibitore della sintesi del DNA (per ribonucleotide reductase) |
10-200 M |
| Metano metilesulfonato | Agente di Alkylating | 0,25-2 mM |
| Mitomicina C | Agente di Alkylating | 0,25-2 M |
| Luce ultravioletta (UV) | Formazione di dimeri di timodina (generando distorsione della catena del DNA) |
50-100 mJ/cm2 |
Tabella 1: agenti genotossici. Esempi di agenti dannosi per il DNA, il loro meccanismo d’azione e il danno indotto sulla base della concentrazione di lavoro suggerita.
Protocol
Representative Results
Discussion
L’analisi dei tempi e dell’efficienza della riparazione dei danni al DNA tramite microscopia si è dimostrata essenziale per capire come funziona il macchinario per la riparazione del DNA, nelle cellule normali e nelle patologie umane come il cancro.
Lo sviluppo di anticorpi specifici che consentono il rilevamento di proteine attivate nella loro versione fosforicolata (come γH2AX, pRPA, pRAD50 e altri10,,23,<sup class="xref…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato sostenuto da una sovvenzione della Fondazione Area San Antonio. Il Mays Cancer Center è supportato dalla sovvenzione core di supporto al centro oncologico NCI P30 CA054174. Vorremmo ringraziare Stephen Holloway per il suo aiuto nell’approvvigionamento delle reagenti e il laboratorio Sung per aver fornito spazio e capacità di microscopia.
Materials
| 16% (v/v) paraformaldehyde (PFA) aqueous solution | Electron Microscopy Sciences | 15710 | Microscopy quality of the PFA ensures best images. If using "home-made PFA", filter prior to use. |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A3059 | Heat-shock fraction is recommended, to avoid precipitation/background. |
| Coverglass #1, 18 mm round (coverslips) | Neuvitro | NC0308920 | Coverslips need to be cleaned and sterilized prior using, with HCl or ethanol. |
| DMEM, High Glucose [(+) 4.5 g/L D-Glucose, (+) L-Glutamine, (-) Sodium Pyruvate] | Gibco | 11965118 | Adjust the growing media to the needs of cell line used. |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | PBS for tissue culture. |
| Ethylene glycol-bis(β-aminoethyl ether)-N,N,N′,N′-tetraacetic acid (EGTA) | Research Products International | E57060 | Nuclear extraction buffer. |
| Fetal Bovine Serum (FBS) | Life Technologies | 104370028 | The quality of FBS can be assessed by testing gH2AX foci formation. If traces of genotoxic endotoxin are present in the batch, gH2AX will be positive in the absence of stress. |
| Magnesium chloride (MgCl2) | Research Products International | M24000 | Nuclear extraction buffer. |
| Piperazine-N,N′-bis(2-ethanesulfonic acid) (PIPES) | Research Products International | P40150 | Nuclear extraction buffer. |
| SlowFade Diamond Antifade Mountant with DAPI | Invitrogen | S36973 | 300 nM DAPI with VECTASHIELD Antifade Mounting Medium can be used instead. |
| Sodium chloride (NaCl) | Research Products International | S23020 | Nuclear extraction buffer. |
| Sucrose | Research Products International | S24060 | Nuclear extraction buffer. |
| Superfrost Plus Microscope Slides | Fisherbrand | 1255015 | Polysine Slides can be used instead. |
| TC-Treated Multiple Well Plates, size 12 wells | Costar | 3513 | Seeding on coverslips is done in 12-wells plate. |
| Triton X-100 | AmericanBio | AB02025 | Nuclear extraction buffer. |
| TrypLE Express Enzyme (1X), No Phenol Red | Gibco | 12604021 | Trypsin-EDTA can be used instead. |
| Trypsin-EDTA (0.5%), No Phenol Red | Gibco | 15400054 | TrypLE can be used instead. |
References
- Prakash, R., Zhang, Y., Feng, W., Jasin, M. Homologous recombination and human health: the roles of BRCA1, BRCA2, and associated proteins. Cold Spring Harbor Perspectives in Biology. 7 (4), 016600 (2015).
- Jalan, M., Olsen, K. S., Powell, S. N. Emerging Roles of RAD52 in Genome Maintenance. Cancers (Basel). 11 (7), (2019).
- Oh, J., Symington, L. S. Role of the Mre11 Complex in Preserving Genome Integrity. Genes (Basel). 9 (12), (2018).
- Uziel, T., et al. Requirement of the MRN complex for ATM activation by DNA damage. The EMBO Journal. 22 (20), 5612-5621 (2003).
- Lee, J. H., Paull, T. T. ATM activation by DNA double-strand breaks through the Mre11-Rad50-Nbs1 complex. Science. 308 (5721), 551-554 (2005).
- Rogakou, E. P., Pilch, D. R., Orr, A. H., Ivanova, V. S., Bonner, W. M. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. Journal of Biological Chemistry. 273, 5858-5868 (1998).
- Kinner, A., Wu, W., Staudt, C., Iliakis, G. γ-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin. Nucleic Acids Research. 36 (17), 5678-5694 (2008).
- Martin, O. A., Pilch, D. R., Redon, C., Bonner, W. M. Histone H2AX in DNA damage repair. Cancer Biology & Therapy. 2 (3), 233-235 (2003).
- Rogakou, E. P., Boon, C., Redon, C., Bonner, W. M. Megabase chromatin domains involved in DNA double-strand breaks in vivo. Journal of Cell Biology. 146 (5), 905-916 (1999).
- Stucki, M., et al. MDC1 directly binds phosphorylated histone H2AX to regulate cellular responses to DNA double-strand breaks. Cell. 123 (7), 1213-1226 (2005).
- Lou, Z., et al. MDC1 maintains genomic stability by participating in the amplification of ATM-dependent DNA damage signals. Molecular Cell. 21 (2), 187-200 (2006).
- Chapman, J. R., Jackson, S. P. Phospho-dependent interaction between NBS1 and MDC1 mediate chromatin retention of the MRN complex at sites of DNA damage. EMBO Reports. 9 (8), 795-801 (2008).
- Melander, F., et al. Phosphorylation of SDT repeats in the MDC1 N terminus triggers retention of NBS1 at the DNA damage-modified chromatin. Journal of Cell Biology. 181 (2), 213-226 (2008).
- Branzei, D., Foiani, M. Regulation of DNA repair throughout the cell cycle. Nature Review. Molecular Cell Biology. 9 (4), 297-308 (2008).
- Chiruvella, K. K., Liang, Z., Wilson, T. E. Repair of double-strand breaks by end joining. Cold Spring Harbor Perspectives in Biology. 5 (5), 012757 (2013).
- Mehta, A., Haber, J. E. Sources of DNA double-strand breaks and models of recombinational DNA repair. Cold Spring Harbor Perspectives in Biology. 6 (9), 016428 (2014).
- Symington, L. S., Gautier, J. Double-strand break end resection and repair pathway choice. Annual Review of Genetics. 45, 247-271 (2011).
- Huertas, P. DNA resection in eukaryotes: deciding how to fix the break. Nature Structural & Molecular Biology. 17 (1), 11-16 (2010).
- Nimonkar, A. V., et al. BLM-DNA2-RPA-MRN and EXO1-BLM-RPA-MRN constitute two DNA end resection machineries for human DNA break repair. Genes & Development. 25 (4), 350-362 (2011).
- Garcia, V., Phelps, S. E. L., Gray, S., Neale, M. J. Bidirectional resection of DNA double-strand breaks by Mre11 and Exo1. Nature. 479 (7372), 241-244 (2011).
- Sturzenegger, A., et al. DNA2 cooperates with the WRN and BLM RecQ helicases to mediate long-range DNA end resection in human cells. Journal of Biological Chemistry. 289 (39), 27314-27326 (2014).
- Daley, J. M., Niu, H., Miller, A. S., Sung, P. Biochemical mechanism of DSB end resection and its regulation. DNA Repair. 32, 66-74 (2015).
- Sartori, A. A., et al. Human CtIP promotes DNA end resection. Nature. 450 (7169), 509-514 (2007).
- Chen, L., Nievera, C. J., Lee, A. Y. L., Wu, X. Cell cycle-dependent complex formation of BRCA1-CtIP-MRN is important for DNA double-strand break repair. Journal of Biological Chemistry. 283, 7713-7720 (2008).
- Yun, M. H., Hiom, K. CtIP-BRCA1 modulates the choice of DNA double-strand break repair pathway throughout the cell cycle. Nature. 459 (7245), 460-463 (2009).
- Sung, P., Klein, H. Mechanism of homologous recombination: mediators and helicases take on regulatory functions. Nature Review. Molecular Cell Biology. 7, 739-750 (2006).
- San Filippo, J., Sung, P., Klein, H. Mechanisms of eukaryotic homologous recombination. Annual Review of Biochemistry. 77, 229-257 (2008).
- Jasin, M., Rothstein, R. Repair of strand breaks by homologous recombination. Cold Spring Harbor Perspectives in Biology. 5 (11), 012740 (2013).
- Dynan, W. S., Yoo, S. Interaction of Ku protein and DNA-dependent protein kinase catalytic subunit with nucleic acids. Nucleic Acids Research. 26 (7), 1551-1559 (1998).
- Lieber, M. R. The mechanism of double-strand DNA break repair by the nonhomologous DNA end-joining pathway. Annual Review of Biochemistry. 79, 181-211 (2010).
- Cejka, P. DNA end resection: nucleases team up with the right partners to initiate homologous recombination. Journal of Biological Chemistry. 290 (38), 22931-22938 (2015).
- Mirman, Z., de Lange, T. 53BP1: a DSB escort. Genes & Development. 34, 7-23 (2020).
- Cao, L., et al. A selective requirement for 53BP1 in the biological response to genomic instability induces by BRCA1 deficiency. Molecular Cell. 35 (4), 534-541 (2009).
- Zimmermann, M., de Lange, T. 53BP1: Pro choice in DNA repair. Trends in Cell Biology. 24 (2), 108-117 (2014).
- Mavragani, I. V., Nikitaki, Z., Kalospyros, S. A., Georgakilas, A. G. Ionizing Radiation and Complex DNA Damage: From Prediction to Detection Challenges and Biological Significance. Cancers (Basel). 11 (11), (2019).
- Nikitaki, Z., et al. Measurement of complex DNA damage induction and repair in human cellular systems after exposure to ionizing radiations of varying linear energy transfer (LET). Free Radical Research. 50, 64-78 (2016).
- Redon, C., et al. Histone H2A variants H2AX and H2AZ. Current Opinion in Genetics & Development. 12 (2), 162-169 (2002).
- Fernandez-Capetillo, O., Lee, A., Nussenzweig, M., Nussenzweig, A. H2AX: the histone guardian of the genome. DNA Repair. 3 (8-9), 959-967 (2004).
- Paull, T. T., et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Current Biology. 10 (15), 886-895 (2000).
- Sy, S. M. H., Huen, M. S. Y., Chen, J. PALB2 is an integral component of the BRCA complex required for homologous recombination repair. Proceedings of the National Academy of Sciences. 106 (17), 7155-7160 (2009).
- Buisson, R., Masson, J. Y. PALB2 self-interaction controls homologous recombination. Nucleic Acids Research. 40 (20), 10312-10323 (2012).
- Belotserkovskaya, R., et al. PALB2 chromatin recruitment restores homologous recombination in BRCA1-deficient cells depleted of 53BP1. Nature Communications. 11 (1), 819 (2020).
- Betts, J. A., et al. Long noncoding RNAs CUPID1 and CUPID2 mediate breast cancer risk at 11q13 by modulating the response to DNA damage. American Journal of Human Genetics. 101 (2), 255-266 (2017).
- Dray, E., et al. Molecular basis for enhancement of the meiotic DMC1 recombinase by RAD51 associated protein 1 (RAD51AP1). Proceedings of the National Academy of Sciences. 108 (9), 3560-3565 (2011).

