Tranches hippocampiques horizontales du cerveau de souris
Summary
Cet article vise à décrire un protocole systématique pour obtenir des tranches horizontales de cerveau hippocampal chez la souris. L’objectif de cette méthodologie est de préserver l’intégrité des voies de fibre hippocampal, telles que le chemin perforant et le tractus de fibre moussée pour évaluer les processus neurologiques liés au gyrus dentate.
Abstract
L’hippocampe est une structure très organisée dans le cerveau qui fait partie du système limbique et est impliqué dans la formation et la consolidation de la mémoire ainsi que la manifestation de troubles cérébraux graves, y compris la maladie d’Alzheimer et l’épilepsie. L’hippocampe reçoit un haut degré d’intra- et d’interconnectivité, assurant une bonne communication avec les structures cérébrales internes et externes. Cette connectivité se fait par différents flux d’information sous forme de voies fibre. Les tranches de cerveau sont une méthodologie fréquemment utilisée lors de l’exploration des fonctions neurophysiologiques de l’hippocampe. Des tranches hippocampal de cerveau peuvent être employées pour plusieurs applications différentes, y compris des enregistrements électrophysiologiques, des mesures microscopiques légères aussi bien que plusieurs techniques biologiques et histochimiques moléculaires. Par conséquent, les tranches de cerveau représentent un système modèle idéal pour évaluer les fonctions protéiques, pour étudier les processus pathophysiologiques impliqués dans les troubles neurologiques ainsi qu’à des fins de découverte de médicaments.
Il existe plusieurs façons différentes de préparer les tranches. Les préparations de tranches cérébrales avec un vibratome permettent une meilleure préservation de la structure tissulaire et garantissent un approvisionnement suffisant en oxygène lors du tranchage, qui présentent des avantages par rapport à l’utilisation traditionnelle d’un hachoir à tissus. En outre, différents plans de coupe peuvent être appliqués pour les préparations vibratomes de tranche de cerveau. Ici, un protocole détaillé pour une préparation réussie des tranches hippocampales horizontales vibratome-coupées des cerveaux de souris est fourni. Contrairement à d’autres préparations de tranches, le tranchage horizontal permet de maintenir les fibres du chemin d’entrée hippocampal (chemin perforant) dans un état entièrement intact dans une tranche, ce qui facilite l’étude des interactions entorhinal-hippocampal. Ici, nous fournissons un protocole complet pour la dissection, l’extraction, et le tranchage horizontal aigu du cerveau murin, et discutons des défis et des pièges potentiels de cette technique. Enfin, nous allons montrer quelques exemples pour l’utilisation de tranches de cerveau dans d’autres applications.
Introduction
L’exploration étendue de l’hippocampe a commencé quand Scoville et Milner ont rapporté l’incapacité d’un patient (H.M.) de former la nouvelle mémoire déclarative après déplacement chirurgical de l’hippocampe et des structures voisines de lobe temporel comme traitement pour l’épilepsie grave1. À partir de ce moment, l’hippocampe a été étudié en profondeur à partir des propriétés neuronales générales et des fonctions jusqu’au développement de troubles cérébraux graves, tels que l’épilepsie et la maladie d’Alzheimer2,3,4,5. L’hippocampe fait partie du système limbique, composé d’un groupe de structures cérébrales connexes impliquées dans la formation de l’émotion et dela mémoire 6,7. Un réseau dense de plusieurs voies de fibre accomplit une connectivité hippocampal serrée aux structures internes et externes de cerveau. Ces voies incluent le chemin perforant médial et latéral (cortex entorhinal pour bosseter le gyrus, CA3 – CA1 et subiculum)8,le chemin de fibre moussue (gyrus dentate au CA3)9 et la voie collatérale/associationnelle de Schaffer (CA3 à CA1)10 (figure 1). L’hippocampe présente l’une des zones cérébrales les plus largement explorées jusqu’à présent en raison de son organisation laminaire fortement conservée de la formation de couches neuronales, et de la possibilité d’obtenir des cultures neuronales vitales et des tranches de cerveau avec une relative facilité5.
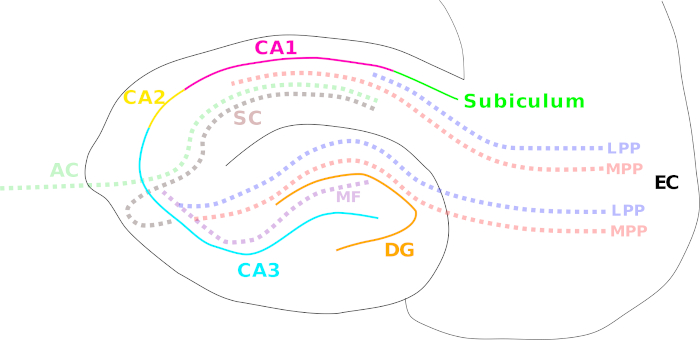
Figure 1 : Dessin animé illustrant les différentes régions hippocampiques et les voies principales de fibre. Les différentes régions hippocampales sont indiquées par des lignes de couleur solide : cortex entorhinal (EC; noir), gyrus dentate (DG; orange), Cornu Ammonis (CA) 3 (cyan), 2 (jaune), et 1 (magenta), et le subiculum (vert). Les voies de fibre sont montrées avec une ligne pointillée colorée : le chemin perforant médial (MPP, rouge) et latéral (LPP, bleu) (du cortex entorhinal au gyrus dentate, CA3, CA1 et subiculum), la voie de fibre moussée (MF, violet) (du gyrus bosselé au CA3) et la garantie Schaffer (SC, brun) (ipsilateral de CA3 à CA1)/voies commissaires associationnelles (AC, vert clair) (contralatéral de CA3 à CA1). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Les protocoles de tranche de cerveau ont souvent comme conséquence la perte des connexions des secteurs plus éloignés de cerveau à la zoned’intérêt 5. En outre, les capillaires ne sont plusfonctionnels 5 et la circulation sanguine est privée11. En dépit de ces limitations, les tranches de cerveau sont toujours principalement employées pour l’étude des fonctions neurophysiologiques de l’hippocampe dues à un certain nombre d’avantages. Tout d’abord, l’extraction de l’hippocampe estrapide 12 et ne nécessite pas beaucoup de matériaux. Les seuls instruments essentiels comprennent un kit de dissection, un bain d’eau de laboratoire, l’accès au carbogen et un microtome vibrant (vibratome)13. D’autres atouts de la technique de tranche de cerveau sont le contournement de la barrière céphalo-cérébrale (BBB) et le lavage des molécules endogènement libérées avant le début del’expérience 5, qui permet d’étudier l’effet des drogues avec le contrôle relativement précis de dosage14. En outre, les tranches de cerveau préservent la cyto-architecture et les circuits synaptiques dans l’hippocampe15,16, où la neuroanatomie et l’environnement local avec la connectivité neuronale et les interactions neuronales-glia complexes sontpréservés 4,11,17. En outre, les connexions hippocampiques de fibre sont principalement unidirectionnelles et les neurones hippocampal ont une plasticité synaptique élevée, qui simplifie énormément la collection et l’interprétation des enregistrements électrophysiologiques de haute qualité afin de comprendre des processus neurologiques18,19. Fait important, les tranches de cerveau présentent un atout précieux applicable dans un large éventail de techniques scientifiques différentes, allant des techniques biologiques moléculaires aux enregistrements d’imagerie jusqu’aux mesures électrophysiologiques12,20,21,22,23,24,25,26.
Comme indiqué ci-dessus, les tranches de cerveau hippocampal présentent un outil expérimental puissant pour étudier les caractéristiques structurelles et fonctionnelles de la connectivité synaptique. Cela offre la possibilité d’évaluer les effets des produits chimiques ou des mutations sur l’excitabilité neuronale et la plasticité16.
Les préparations aiguës en tranches cérébrales présentent une technique relativement sensible et la qualité optimale des tranches dépend fortement de conditions expérimentales idéales, y compris l’âge de l’animal, la méthode d’euthanasie, la vitesse de dissection et de tranchage, les solutions et paramètres de tranchage (p. ex., la vitesse de tranchage) ainsi que les conditions de récupérationdes tranches 4. Par conséquent, un protocole bien conçu est d’une importance absolue et assure la reproductibilité entre les différentes unités de recherche13.
Ici, nous fournissons un protocole détaillé pour les préparations horizontales aiguës de tranche d’hippocampe, dans le but de préserver l’intégrité du chemin latéral et médial hippocampal de perforant et de la voie mossy de fibre, permettant l’investigation des processus liés au gyrus debosselé 9. Nous décrirons en détail les étapes clés pour disséquer, extraire et trancher horizontalement le cerveau murin, suivis des résultats représentatifs des enregistrements calcium-microfluorimétriques et des enregistrements potentiels postsynaptiques excitatifs sur le terrain (FEPSP) dans des conditions de base et pendant les protocoles d’induction du LTP dans des tranches cérébrales de souris sauvages de type C57BL/6J.
Protocol
Representative Results
Discussion
Bien que couramment utilisés dans la communauté des neurosciences, les préparations de tranches de cerveau sont également confrontées à plusieurs inconvénients. Par exemple, les connexions d’entrée et de sortie aux zones cérébrales d’intérêt ne sont plus reliées dans une tranche de cerveau. En outre, une fois isolé, le tissu commence à se dégrader lentement au fil du temps et ce processus pourrait modifier les conditions physiologiques de la tranche du cerveau. Ce sujet en particulier est très préoccupant parce que la plupart des enregistrements de tranches de cerveau prennent plusieurs minutes à heures, ce qui se traduit par de longues journées expérimentales avec des enregistrements effectués sur des tissus qui ont été isolés jusqu’à 6-8 h avant le début de l’expérience. En outre, le liquide céphalo-rachidien et la circulation sanguine sont interrompus pendant les préparations de tranches, ce qui peut conduire à l’absence de composés endogènes importants dans une tranche de cerveau. Et le plus évidemment, la procédure de tranchage elle-même peut causer des dommages aux tissus mécaniques qui pourraient compromettre les résultats obtenus. Cependant, les avantages réels des préparations de tranches cérébrales l’emportent encore sur leurs inconvénients, c’est pourquoi ils présentent une technique très appréciée et utilisée dans la recherche en neurosciences.
Les tranches cérébrales hippocampiques aiguës présentent une technique puissante et donc largement utilisée pour étudier les processus neuronaux d’un niveau moléculaire jusqu’à des études complexes de circuits cérébraux. Ceci est basé sur la neuroanatomie idéale de l’hippocampe qui peut être facilement préservée dans une préparation de tranche18. Par conséquent, les tranches de cerveau hippocampal sont utilisées dans une grande variété de projets de recherche scientifique, y compris les dépistagesde médicaments 17, les études des propriétés neuronales et synaptiques impliquées dans les fonctions cognitives40,41, et les enquêtes sur les conditions pathologiques du cerveau14,42,43. Toutefois, un large éventail d’applications différentes provoque également un large éventail de protocoles disponibles de préparation des tranches qui peuvent différer dans divers paramètres, tels que les conditions de dissection et la coupe de l’orientation du plan, entre autres. Par conséquent, la question exacte de la recherche d’un projet scientifique doit être déterminée afin de choisir un protocole approprié de préparation des tranches.
L’hélico tissulaire présente l’une des plus anciennes techniques utilisées afin de préparer des tranches de cerveau hippocampal44,45. Les principaux avantages de cette méthode de préparation incluent le faible coût de l’hélicoptère et l’utilisation rapide et facile46. Cependant, les hachoirs de tissu causent le stress mécanique qui a comme résultat des changements morphologiques et la mortcellulaire 47. En comparaison, le vibratome est une machine assez chère et le temps de préparation des tranches est considérablement augmenté ce qui pourrait avoir un impact sur la qualité de la tranche. Cependant, le vibratome offre habituellement une manière plus douce de séparer les tranches du tissu et permet de maintenir le cerveau bien refroidi et oxygéné au-dessus de la procédure entière d’isolement, améliorant de ce fait des propriétés detranche 46. Par conséquent, plusieurs groupes emploient standardment cette technique et ont proposé des protocoles pour la préparation des tranches hippocampiques aiguës de cerveau utilisant le vibratome16,30,48. Alors que certains protocoles ne fournissent que quelques détails pour le tranchage lui-même, mais plutôt se concentrer sur une application spécifique de cette préparation tranche48, d’autres fournissent des protocoles de tranche détaillée qui diffèrent dans le plan de coupe ou d’autres détails du protocole (par exemple, l’intégration agarose ou tranche / solutions de récupération) donnée dans cet article27,30.
Le protocole décrit ici présente une méthode simple afin de préparer des tranches horizontales aiguës de haute qualité de cerveau de souris hippocampal de jeunes animaux. Le protocole est particulièrement utile pour préserver le chemin perforant (médial et latéral) qui présente la voie d’entrée hippocampale, qui projette du cortex entorhinal à l’hippocampe8,49,50. Les préparations transversales sagittales, coronal, ainsi que les préparations isolées de tranches transversales d’hippocampe ne préservent pas correctement le chemin perforant, qui provient principalement des couches II et V du cortex entorhinal et se projette dans plusieurs secteurs dans l’hippocampe18. En raison du positionnement anatomique du cortex entorhinal par rapport à l’hippocampe, les tranches horizontales de cerveau sont une nécessité afin de maintenir les fibres perforantes entièrement intactes de chemin dans la préparation de tranche31. En outre, le tranchage horizontal préserve idéalement les fibres moussus qui se projettent du gyrus bosselé aux neurones CA3 dans l’hippocampe9,30,50. Par conséquent, cette méthode de préparation est de grande valeur pour les études qui étudient les voies d’entrée hippocampal et les processus liés à la DG. En outre, ce protocole permet l’étude de la voie collatérale Schaffer50. Cependant, les préparations sagittales et coronaires de tranche de cerveau sont plus couramment employées en étudiant des projections de fibre de CA3 à CA1, vraisemblablement en raison de leur temps légèrement plus rapide de préparation qui peut augmenter le risque d’obtenir des tranches de haute qualité. Néanmoins, les préparations horizontales de tranche hippocampale présentent un outil de recherche puissant puisqu’elle permet la conservation et l’investigation de toutes les voies hippocampal de fibre dans un hémisphère de tranche. Cela peut être particulièrement utile lorsque les réponses du circuit sont étudiées, par exemple, dans des enregistrements d’analyse d’électrodes multiples.
Une préoccupation majeure lors de la préparation des tranches de cerveau est la bonne préservation du tissu cérébral. Ceci est accompli par plusieurs étapes critiques dans notre protocole, y compris une dissection rapide, l’oxygénation et le refroidissement continus et suffisants du tissu, et la protection du tissu cérébral par l’utilisation de la méthode protectrice de coupe avec une solution de découpage à faible teneur en sodium et à haut saccharose39,51. Malgré le fait que le protocole décrit ici donne un taux de réussite d’environ 90%, des mesures de protection potentiellement supplémentaires pourraient être nécessaires lorsque vous travaillez avec des tissus dérivés d’animaux plus âgés ou génétiquement diversifiés ou lorsque vous essayez de préserver une population cellulaire spécifique. Plusieurs méthodes ont déjà été rapportées pour protéger les préparations sensibles de tissu cérébral. Ces méthodes comprennent l’utilisation de solutions de tranchage à base de NMDG pour réduire la perméation du sodium52,l’utilisation de niveaux élevés de magnésium dans la solution de tranchage afin de bloquer l’activité des récepteurs NMDA53, et l’utilisation prolongée de solutions protectrices également pendant la périodede récupération 23. Toutes ces mesures se traduira par une réduction de l’excitotoxicité. En outre, une perfusion trans-cardiale avec des solutions de protection contre la glace ACSF est souvent utilisée et nécessaire lorsque vous travaillez avec des animaux plus âgés27.
Les tranches aiguës du cerveau hippocampal sont parfaitement adaptées et largement utilisées pour des études électrophysiologiques pour des raisons telles que les signaux d’amplitude élevée qui peuvent être obtenus à partir d’une tranche cérébrale aiguë relativement épaisse (300-500 μm), ce qui garantit un rapport signal/bruitélevé 11. Les applications électrophysiologiques couramment utilisées comprennent des enregistrements extracellulaires sur le terrain et des enregistrements intracellulaires à cellules entières en mode tension ou courant. Afin d’acquérir des données électrophysiologiques de haute qualité, la santé des tranches est une préoccupation primordiale et peut être garantie en suivant strictement le protocole présenté. Toutefois, comme les préparations de tranches présentent une technique très sensible, un contrôle de qualité doit être régulièrement inclus avant le début de chaque expérience. Plusieurs paramètres peuvent être utilisés comme vérification de la qualité de la tranche et sont évalués de façon standard au moyen de courbes input-output et d’enregistrements fEPSP ou EPSCde base 19. Néanmoins, il convient de noter que les propriétés électrophysiologiques sous-optimales peuvent résulter d’erreurs expérimentales telles que le positionnement des électrodes, l’orientation ou même des dommages et ne représentent pas seulement la santé de la tranche préparée. Par conséquent, il est conseillé d’effectuer des contrôles de qualité supplémentaires tels que la visualisation simple et l’évaluation des cellules sous un objectif de 40x ou une coloration du noyau DAPI. Ces contrôles de qualité peuvent être utilisés pour confirmer la santé constante des tranches au cours de plusieurs séances de préparation de tranches.
La microfluorimétrie calcique présente une technique moins couramment utilisée pour étudier les tranches de cerveau hippocampal. Cependant, cette technique est d’une valeur supplémentaire pour les enregistrements d’électrodes extracellulaires et intracellulaires standard, car elle permet de visualiser et de quantifier les flux intracellulaires de calcium, qui sont d’une grande importance dans la signalisation neuronale et synaptique. Les changements dans les concentrations intracellulaires de calcium sont impliqués dans la libération de vésicule de neurotransmetteur, la génération potentielle postsynaptique, la régulation de la plasticité synaptique et la conduction axonalede nerf 54,55,56. À titre d’illustration de cette technique (figure 4), nous avons utilisé un colorant de calcium disponible dans le commerce. Incontestablement, le traitement des tranches de tissu avec des dyes de calcium peut produire des difficultés telles qu’un délai expérimental accru ainsi qu’une charge inefficace des cellules neuronales situées inférieures. Toutefois, des variations sur cette technique pourraient être utilisées pour contourner ces défis techniques. Par exemple, il est possible de combiner des mesures de calcium et des enregistrements de pince de correction dans les tranches hippocampal. De cette façon, un colorant fluorescent de calcium pourrait être chargé dans une cellule spécifique par la pipette de correction, permettant les mesures de la dynamique de calcium dans une cellule spécifique d’intérêt57. Alternativement, les animaux génétiquement modifiés exprimant l’indicateur de calcium, GCaMP58, soit dans le cerveau entier, ou entraînés par un promoteur spécifique à la cellule, pourraient être utilisés. Fait intéressant, les tissus cérébraux provenant d’animaux GCaMP ayant un lien direct avec une protéine d’intérêt pourraient fournir des occasions de déterminer le modèle d’expression neuronale ou d’étudier la participation aux étincelles et aux ondes calciques.
Au total, nous fournissons les lignes directrices pour la préparation réussie de tranches de cerveau hippocampal horizontales saines et viables provenant de souris pour des enregistrements électrophysiologiques et d’imagerie. Cette méthodologie est très utile pour accéder aux changements neurologiques qui se produisent dans les pathologies cérébrales qui sont décrites dans le gyrus bosselé.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Nous remercions l’unité d’électrophysiologie du VIB-KU Leuven Center for Brain and Disease Research sous la supervision du Dr Keimpe Wierda et du Professeur Joris De Wit pour l’utilisation de leurs installations de recherche. En outre, nous remercions tous les membres du Laboratoire de recherche Ion Channel et du Laboratoire d’Endomètre, d’Endométriose et de médecine de la reproduction à la KU Leuven pour leurs discussions et commentaires utiles.
Ce projet a reçu des fonds de la Fondation de recherche-Flandre (G.084515N et G.0B1819N à J.V.) et du Conseil de recherche de la KU Leuven (C14/18/106 à J.V.). K.P. est boursier FWO [PEGASUS]2 Marie Skłodowska-Curie et a reçu des fonds du programme de recherche et d’innovation Horizon 2020 de l’Union européenne dans le cadre de l’accord de subvention Marie Skłodowska-Curie (665501) avec la Fondation flanders (FWO) (12T0317N). K.H. est boursier postdoctoral de la Research Foundation Flanders, Belgique (12U7918N).
Materials
| Anesthesia chamber | home made – Generic | N/A | plexiglas |
| Anesthesia vaporizer | Dräger & MSS International Ltd | Isoflurane Vapor 19.3 & MSS Isoflurane | to vaporize isoflurane for rodent anesthetization |
| Barrels for the perfusion system | TERUMO | Hypodermic syringes without needle | https://www.terumotmp.com/products/hypodermics/terumo-hypodermic-syringes-without-needle.html |
| Bicuculline methiodide | hellobio | HB0893 | https://www.hellobio.com/bicuculline-methiodide.html |
| Borosilcate glass capillaries | Science Products | GB150F-8P | https://science-products.com/en/shop/micropipette-fabrication-1/capillary-glass-for-micropipette-pullers/borosilicate-glass-capillaries/borosilicate-filament-polished |
| Calcium chlorid dihydrate | Merck | 102382 | https://www.merckmillipore.com/BE/en/product/Calcium-chloride-dihydrate,MDA_CHEM-102382?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Calcium Imaging software | Till Photonics | LiveAcquisition v2.3.0.18 | |
| Carbogen tank | Air Liquide | Alphagaz mix B50 | Gasmixture CO2/O2: 5/95, purity 5 |
| Cluster microelectrode | FHC | CE2C55 | https://www.fh-co.com/product/cluster-microelectrodes/ |
| Culture dish (35 mm) | Corning Life Sciences | 353001 | https://ecatalog.corning.com/life-sciences/b2c/US/en/Cell-Culture/Cell-Culture-Vessels/Dishes%2C-Culture/Falcon®-Cell-Culture-Dishes/p/353001 |
| Culture dish (90 mm) | Thermo Fisher Scientific | 101VR20 | https://www.thermofisher.com/order/catalog/product/101R20#/101R20 |
| Curved forceps | Fine Science tools | 11270-20 | https://www.finescience.de/de-DE/Products/Forceps-Hemostats/Dumont-Forceps/Dumont-7b-Forceps/11270-20 |
| D-AP5 | hellobio | HB0225 | https://www.hellobio.com/dap5.html |
| D-(+)-Glucose monohydrate | Sigma Aldrich | 16301 | https://www.sigmaaldrich.com/catalog/product/sial/16301?lang=en®ion=BE |
| Digital CMOS camera | HAMAMATSU | ORCA-spark C11440-36U | https://www.hamamatsu.com/eu/en/product/type/C11440-36U/index.html |
| Dissection scissors | Fine Science tools | 14058-09 | https://www.finescience.de/de-DE/Products/Scissors/Standard-Scissors/Fine-Scissors-ToughCut®/14058-09 |
| DNQX | hellobio | HB0262 | https://www.hellobio.com/dnqx-disodium-salt.html |
| EMCCD camera | Andor | iXon TM + DU-897E-CSO-#BV | https://andor.oxinst.com/products/ixon-emccd-cameras?gclid=CjwKCAjw97P5BRBQEiwAGflV6ULsKjXfhN2YZxtvsWAmF4QghyXZKuqYHVMa6KU9JyS80ATQkSKeBBoCIM0QAvD_BwE |
| EPC10 USB Double Patch Clamp Amplifier | HEKA Elektronik | 895278 | https://www.heka.com/sales/brochures_down/bro_epc10usb.pdf |
| Filter paper | VWR | 516-0818 | grade 413 |
| Fine brush | Raphael Kaerell | 8204 | Size #1 |
| 18G needle | Henke Sass Wolf Fine-Ject | 18G X 1 1/2" 4710012040 | https://www.henkesasswolf.de/cms/de/veterinaer_produkte/produkte_vet/einmalkanuelen/hsw_henke_ject_einmalkanuelen/ |
| Isoflurane | Dechra Veterinary Products | Iso-Vet 1000mg/g | 250 ml bottle |
| Loctite 406 | Henkel Adhesive technologies | Loctite 406 | Super glue |
| Magnesium sulfate heptahydrate | Merck | 105886 | https://www.merckmillipore.com/BE/en/product/Magnesium-sulfate-heptahydrate,MDA_CHEM-105886?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Micromanipulator | Luigs & Neumann | SM-10 with SM-7 remote control system | https://www.luigs-neumann.org |
| Microscope (for calcium imaging) | Olympus | BX51WI | https://www.olympus-lifescience.com/de/microscopes/upright/bx61wi/ |
| Microscope (for ephys recordings) | Zeiss | Axio Examiner.A1 | https://www.micro-shop.zeiss.com/de/de/system/axio+examiner-axio+examiner.a1-aufrechte+mikroskope/10185/ |
| Microscope light source | CAIRN Research | dual OptoLed power supply | https://www.cairn-research.co.uk/product/optoled/ |
| Monochromator | Till Photonics | Polychrome V | |
| N-Methyl-D-aspartic acid (NMDA) | Sigma Aldrich | M3262 | https://www.sigmaaldrich.com/catalog/product/sigma/m3262?lang=en®ion=BE |
| Oregon Green® 488 BAPTA-1 | Invitrogen Molecular Probes | #06807 | 10x50ug |
| Osmometer | Wescor | 5500 vapor pressure osmometer | to verify osmolarity of salt solutions |
| Peristaltic pump | Thermo Fisher Scientific | Masterflex C/L 77120-62 | https://www.fishersci.be/shop/products/masterflex-peristaltic-c-l-dual-channel-pump-2/p-8004229 |
| pH meter | WTW | inoLab series pH 720 | https://www.geminibv.nl/wp-content/uploads/manuals/wtw-720-ph-meter/wtw-inolab-ph-720-manual-eng.pdf |
| Pipette puller | Sutter Instrument | P-1000 | https://www.sutter.com/MICROPIPETTE/p-1000.html |
| Potassium chlorid | Chem-lab | CL00.1133 | https://www.chem-lab.be/#/en-gb/prod/1393528 |
| Potassium dihydrogen phosphate | Merck | 104873 | https://www.merckmillipore.com/BE/en/product/Potassium-dihydrogen-phosphate,MDA_CHEM-104873?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Razor blade to prepare hemispheres | SPI supplies | Safety Cartridge Dispenser – Pkg/10 | GEM Scientific Single Edge Razor Blades |
| Razor blade for vibratome | Ted Pella Inc | 121-6 | double edge breakable style razor blades (PTFE-coated stainless steel) |
| Recovery chamber | home made – Generic | N/A | to collect and store brain slices in (see details in manuscript) |
| Scissors | Any company | N/A | Blade should be well sharpened and at least 15 cm long for easy decapitation |
| Silver electrode wire | Any company | for recording and reference electrodes | |
| Sodium dihydrogen phosphate dihydrate | Merck | 106342 | https://www.merckmillipore.com/BE/en/product/Sodium-dihydrogen-phosphate-dihydrate,MDA_CHEM-106342?ReferrerURL=https%3A%2F%2Fwww.google.com%2F |
| Sodium hydrogen carbonate | Alfa Aesar | 14707 | https://www.alfa.com/en/catalog/014707/ |
| Sodium chlorid | Fisher Scientific | S/3160/60 | https://www.fishersci.co.uk/shop/products/sodium-chloride-certified-ar-analysis-meets-analytical-specification-ph-eur/10428420 |
| Software for field recordings | HEKA Elektronik | PatchMaster | https://www.heka.com/downloads/software/manual/m_patchmaster.pdf |
| Spatula | Sigma Aldrich | S9147-12EA | https://www.sigmaaldrich.com/catalog/product/sigma/s9147?lang=en®ion=BE |
| Stimulator | A.M.P.I | ISO-FLEX | http://www.ampi.co.il/isoflex.html |
| Sucrose | VWR International Ltd. | 102745C | https://es.vwr-cmd.com/ex/downloads/magazine/lupc_userguide_uk.pdf |
| Tubing for carbogen, perfusion and suction lines 1 | Warner Instruments | 64-0167 | Tygon tubing (TY-50) for standard valve systems |
| Tubing for carbogen, perfusion and suction lines 2 | Fisher Scientific | 800/100/200 & 800/100/280 | Smiths Medical Portex Fine Bore LDPE Tubing |
| Vacuum pump | home made – Generic | N/A | |
| 8 valve multi-barrel perfusion system | home made | N/A | consists of barrels, tubing and a self-made automated valve control (specifications of all purchased parts can be found in this Table) |
| Magnetic valves (to control the perfusion lines) | NResearch Inc. | p/n 161P011 | https://nresearch.com/ |
| Vibratome | Leica | 14912000001 | Semi-automatic vibrating blade microomei VT1200 |
| Water bath | Memmert | WNB 7 | https://www.memmert.be/wp-content/uploads/2019/09/Memmert-Waterbath-WNB-7.en_.pdf |
| Water purification system | Merck | Synergy millipore | to obtain highly purified water |
| 12-well plates | Greiner Bio-One | CELLSTAR, 665180 | http://www.greinerbioone.com/UserFiles/File/Catalogue%202010_11/UK/3680_005-Kapitel1_UK.pdf |
References
- Scoville, W. B., Milner, B. Loss of recent memory after bilateral hippocampal lesions. Journal of Neurology, Neurosurgery, and Psychiatry. 20 (1), 11-21 (1957).
- Cavarsan, C. F., Malheiros, J., Hamani, C., Najm, I., Covolan, L. Is mossy fiber sprouting a potential therapeutic target for epilepsy. Frontiers in Neurology. 9, 1023 (2018).
- Nadler, J. V. The recurrent mossy fiber pathway of the epileptic brain. Neurochemical Research. 28 (11), 1649-1658 (2003).
- Raimondo, J. V., et al. Methodological standards for in vitro models of epilepsy and epileptic seizures. A TASK1-WG4 report of the AES/ILAE translational task force of the ILAE. Epilepsia. 58, 40-52 (2017).
- Humpel, C. Organotypic brain slice cultures: A review. Neurosciences. , 86-98 (2015).
- Tohno, Y., et al. Relationships among the hippocampus, dentate gyrus, mammillary body, fornix, and anterior commissure from a viewpoint of elements. Biological Trace Element Research. 140 (1), 35-52 (2011).
- Maclean, P. D. The limbic system and its hippocampal formation; studies in animals and their possible application to man. Journal of Neurosurgery. 11 (1), 29-44 (1954).
- Petersen, R. P., et al. Electrophysiological identification of medial and lateral perforant path inputs to the dentate gyrus. Neurosciences. 252, 154-168 (2013).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in Brain Research. 163, 3-22 (2007).
- Szirmai, I., Buzsaki, G., Kamondi, A. 120 years of hippocampal schaffer collaterals. Hippocampus. 22 (7), 1508-1516 (2012).
- Cho, S., Wood, A., Bowlby, M. R. Brain slices as models for neurodegenerative disease and screening platforms to identify novel therapeutics. Current Neuropharmacology. 5 (1), 19-33 (2007).
- Mathis, D. M., Furman, J. L., Norris, C. M. Preparation of acute hippocampal slices from rats and transgenic mice for the study of synaptic alterations during aging and amyloid pathology. Journal of Visualized Experiments. (49), e2330 (2011).
- Papouin, T., Haydon, P. G. Obtaining Acute Brain Slices. Bio-protocol. 8 (2), 2699 (2018).
- Li, Q., Han, X., Wang, J. Organotypic hippocampal slices as models for stroke and traumatic brain injury. Molecular Neurobiology. 53 (6), 4226-4237 (2016).
- Lo, D. C., McAllister, A. K., Katz, L. C. Neuronal transfection in brain slices using particle-mediated gene transfer. Neuron. 13 (6), 1263-1268 (1994).
- Lein, P. J., Barnhart, C. D., Pessah, I. N. Acute hippocampal slice preparation and hippocampal slice cultures. Methods in Molecular Biology. 758, 115-134 (2011).
- Magalhaes, D. M., et al. Ex vivo model of epilepsy in organotypic slices-a new tool for drug screening. Journal of Neuroinflammation. 15 (1), 203 (2018).
- Bliss, T., Andersen, P., Morris, R., Amaral, D., O’Keefe, J. . The hippocampus book. , 37-114 (2007).
- Bortolotto, Z. A., Amici, M., Anderson, W. W., Isaac, J. T. R., Collingridge, G. L. Synaptic plasticity in the hippocampal slice preparation. Current Protocols in Neuroscience. 54 (1), 11-26 (2011).
- Al-Osta, I., et al. Imaging calcium in hippocampal presynaptic terminals with a ratiometric calcium sensor in a novel transgenic mouse. Frontiers in Cellular Neuroscience. 12, 209 (2018).
- McLeod, F., Marzo, A., Podpolny, M., Galli, S., Salinas, P. Evaluation of synapse density in hippocampal rodent brain slices. Journal of Visualized Experiments. (128), e56153 (2017).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments. (112), e54024 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in Molecular Biology. 1183, 221-242 (2014).
- Weng, W., Li, D., Peng, C., Behnisch, T. Recording synaptic plasticity in acute hippocampal slices maintained in a small-volume recycling-, perfusion-, and submersion-type chamber system. Journal of Visualized Experiments. (131), e55936 (2018).
- Zhou, Q., Abe, H., Nowak, T. S. Immunocytochemical and in situ hybridization approaches to the optimization of brain slice preparations. Journal of Neuroscience Methods. 59 (1), 85-92 (1995).
- Koike-Tani, M., Tominaga, T., Oldenbourg, R., Tani, T. Birefringence changes of dendrites in mouse hippocampal slices revealed with polarizing microscopy. Biophysical Journal. 110 (10), 2366-2384 (2020).
- Ting, J. T., et al. Preparation of acute brain slices using an optimized N-Methyl-D-glucamine protective recovery method. Journal of Visualized Experiments. (132), e53825 (2018).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8 (9), 745-752 (2011).
- Hua, Y., Keep, R. F., Hoff, J. T., Xi, G. Brain injury after intracerebral hemorrhage: the role of thrombin and iron. Stroke. 38, 759-762 (2007).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nature Protocols. 1 (4), 2075-2081 (2006).
- Paxinos, G., Franklin, K. . The Mouse Brain In Stereotaxic Coordinates. 3 edn. , 256 (2008).
- Lacar, B., Young, S. Z., Platel, J. C., Bordey, A. Preparation of acute subventricular zone slices for calcium imaging. Journal of Visualized Experiments. (67), e4071 (2012).
- Schauer, C., Leinders-Zufall, T. Imaging calcium responses in GFP-tagged neurons of hypothalamic mouse brain slices. Journal of Visualized Experiments. (66), e4213 (2012).
- Tetteh, H., Lee, J., Lee, J., Kim, J. G., Yang, S. Investigating Long-term Synaptic Plasticity in Interlamellar Hippocampus CA1 by Electrophysiological Field Recording. Journal of Visualized Experiments. (150), e59879 (2019).
- Smith, C. J., et al. Investigations on alterations of hippocampal circuit function following mild traumatic brain injury. Journal of Visualized Experiments. (69), e4411 (2012).
- McNaughton, B. L. Evidence for two physiologically distinct perforant pathways to the fascia dentata. Brain Research. 199 (1), 1-19 (1980).
- Colino, A., Malenka, R. C. Mechanisms underlying induction of long-term potentiation in rat medial and lateral perforant paths in vitro. Journal of Neurophysiology. 69 (4), 1150-1159 (1993).
- Coulter, D. A., Carlson, G. C. Functional regulation of the dentate gyrus by GABA-mediated inhibition. Progress in Brain Research. 163, 235-243 (2007).
- Kuenzi, F. M., Fitzjohn, S. M., Morton, R. A., Collingridge, G. L., Seabrook, G. R. Reduced long-term potentiation in hippocampal slices prepared using sucrose-based artificial cerebrospinal fluid. Journal of Neuroscience Methods. 100 (1-2), 117-122 (2000).
- Connor, S. A., et al. Loss of synapse repressor MDGA1 enhances perisomatic inhibition, confers resistance to network excitation, and impairs cognitive function. Cell Reports. 21 (13), 3637-3645 (2017).
- Lisman, J., et al. Viewpoints: how the hippocampus contributes to memory, navigation and cognition. Nature Neuroscience. 20 (11), 1434-1447 (2017).
- Moodley, K. K., Chan, D. The hippocampus in neurodegenerative disease. Frontiers of Neurology and Neuroscience. 34, 95-108 (2014).
- Kong, H., et al. Inhibition of miR-181a-5p reduces astrocyte and microglia activation and oxidative stress by activating SIRT1 in immature rats with epilepsy. Laboratory Investigation; A Journal of Technical Methods and Pathology. , (2020).
- Skrede, K. K., Westgaard, R. H. The transverse hippocampal slice: a well-defined cortical structure maintained in vitro. Brain Research. 35 (2), 589-593 (1971).
- Schwartzkroin, P. A. Characteristics of CA1 neurons recorded intracellularly in the hippocampal in vitro slice preparation. Brain Research. 85 (3), 423-436 (1975).
- Wang, T., Kass, I. S. Preparation of brain slices. Methods in Molecular Biology. 72, 1-14 (1997).
- Garthwaite, J., Woodhams, P. L., Collins, M. J., Balazs, R. On the preparation of brain slices: morphology and cyclic nucleotides. Brain Research. 173 (2), 373-377 (1979).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. Journal of Visualized Experiments: JoVE. (91), e51706 (2014).
- Aydin-Abidin, S., Abidin, &. #. 3. 0. 4. ;. 7,8-Dihydroxyflavone potentiates ongoing epileptiform activity in mice brain slices. Neuroscience Letters. 703, 25-31 (2019).
- Xiong, G., Metheny, H., Johnson, B. N., Cohen, A. S. A comparison of different slicing planes in preservation of major hippocampal pathway fibers in the mouse. Frontiers in Neuroanatomy. 11, 107 (2017).
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Tanaka, Y., Tanaka, Y., Furuta, T., Yanagawa, Y., Kaneko, T. The effects of cutting solutions on the viability of GABAergic interneurons in cerebral cortical slices of adult mice. Journal of Neuroscience Methods. 171 (1), 118-125 (2008).
- Reid, K. H., Edmonds, H. L., Schurr, A., Tseng, M. T., West, C. A. Pitfalls in the use of brain slices. Progress in Neurobiology. 31 (1), 1-18 (1988).
- Brini, M., Calì, T., Ottolini, D., Carafoli, E. Neuronal calcium signaling: function and dysfunction. Cellular and Molecular Life Sciences: CMLS. 71 (15), 2787-2814 (2014).
- Gleichmann, M., Mattson, M. P. Neuronal calcium homeostasis and dysregulation. Antioxidants & Redox Signaling. 14 (7), 1261-1273 (2011).
- Padamsey, Z., Foster, W. J., Emptage, N. J. Intracellular Ca(2+) release and synaptic plasticity: a tale of many stores. The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry. 25 (3), 208-226 (2019).
- Chen-Engerer, H. J., et al. Two types of functionally distinct Ca2+ stores in hippocampal neurons. Nature Communications. 10 (1), 3223 (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 32 (40), 13819-13840 (2012).

