植物の抽出物と分率から新しい抗菌分子と抗バイオフィルム分子を同定し、齲蝕を予防する体系的アプローチ
Summary
天然物は、新薬および治療薬の開発の有望な出発点を表しています。しかし、化学的多様性が高いため、植物から新しい治療化合物を見つけることは困難で時間のかかる作業です。植物抽出物および分画から抗菌分子および抗バイオフィルム分子を同定するための簡便なアプローチを説明する。
Abstract
天然物は、構造的に異なる物質を提供し、無数の生物学的活動を提供します。しかし、植物からの活性化合物の同定と分離は、複雑な植物マトリックスと時間のかかる分離および同定手順のために困難です。そこで、潜在的に活性な分子の単離および同定を含む植物由来の天然化合物をスクリーニングするための段階的アプローチが提示される。それは植物材料のコレクションを含みます。粗抽出物の調製と分画;クロマトグラフィーおよび分光法(UHPLC-DAD-HRMSおよびNMR)の分析および化合物同定のためのアプローチ;バイオアッセイ(抗菌および抗バイオフィルム活性;選択された治療で治療された唾液ペリクルおよび初期グルカンマトリックスへの細菌の「接着強度」);データ分析を行います。モデルは簡単で、再生可能で、複数の化合物、濃度および処置ステップのハイスループットスクリーニングを一貫して制御することができる。得られたデータは、最も活性な抽出物および/または画分を含む製剤、分子の単離、微生物細胞およびバイオフィルム内の特定の標的への分子のモデリングを含む、将来の研究のための基礎を提供する。例えば、齲蝕原性バイオフィルムを制御する1つの標的は、細胞外マトリックスのグルカンを合成する レンサ球菌変異体 グルコシルトランスファーーゼの活性を阻害するものである。これらの酵素の阻害は、バイオフィルムの蓄積を防ぎ、その毒性を低下させる。
Introduction
社会で使用される医学の最も初期のモデルは、天然物(NP)に基づいていました。それ以来、人間は、薬物1に変換することができる自然界の新しい化学物質を探しています。この探索は、民族植物スクリーニング1、2、3の技術と方法の継続的な改善を引き起こした。NPは構造的に多様な物質の豊富な供給源を提供し、代替療法やアジュバント療法の開発に役立つ幅広い生物学的活動を提供しています。しかし、固有の複雑な植物マトリックスは、活性化合物の分離と同定を困難で時間のかかる作業4にします。
NPsベースの薬物または製剤は、口腔に影響を与えるいくつかの状態を予防および/または治療するために使用することができます, 歯科用虫歯を含む4.世界的に最も流行している慢性疾患の一つである齲蝕は、糖が豊富な食生活と微生物のバイオフィルム(歯垢)の相互作用に由来し、歯面に形成され、微生物代謝に由来する有機酸によって生じる脱灰化につながり、治療しなければ、歯の損失5,6を引き起こす。他の微生物は7を関連付けてもよいが、ストレプトコッカス変異体は、酸性、酸尿、および細胞外マトリックスビルダーであるため、重要な発膜性細菌である。本種は、ショ糖を基質8として使用する複数のエキソ酵素(例えば、グリコシルトランスファーゼまたはGtfs)をコードし、細胞外多糖を豊富に含む細胞外マトリックスを構築し、これは毒性決定基9である。また、カンディダ・アルビカンス菌は、その細胞外マトリックス7の産生を促進することができる。フッ化物は、様々なモダリティで投与されるが、齲蝕10を予防するための基礎であり続け、その有効性を高めるために補助剤として新しいアプローチが必要である。また、利用可能な抗プラークモダクティビティは、広域スペクトル微小bicidal剤(例えば、クロルヘキシジン)11の使用に基づいている。代替として、NPはバイオフィルムを制御し、歯の齲蝕12、13を防ぐための潜在的な治療法です。
植物からの新しい生理活性化合物の発見のさらなる進歩には、(i)植物がしばしば特異性の内在性を示すことを考慮して、サンプリングのための信頼性の高い再現可能なプロトコルの使用のような必要なステップまたはアプローチが含まれます。(ii) 小規模での包括的抽出物およびそれぞれの分画の調製。(iii) それらの化学プロファイルの特性評価および/または非複製は、GC-MS、LC-DAD-MS、またはNMRなどの多次元データの取得を考えた。(iv) 生物活性を評価するための実行可能で高収率モデルの使用。(v) 多変量データ分析またはその他の統計ツールに基づく潜在的な新しいヒットの選択。(vi)標的化合物または有望な候補の単離および精製を行う。(vii)単離化合物2,14を用いた対応した生物学的活性の検証。
デレプリケーションは、粗抽出物中の既知の化合物を迅速に同定するプロセスであり、既に研究されているものとは新しい化合物を区別することを可能にする。また、このプロセスは、生物活性が特定の化合物について既に記述されている場合の単離を防ぎ、「頻繁な打者」を検出するのに特に有用である。これは、主要な化合物同定または活動誘導分画の加速から抽出物のコレクションの化学プロファイリングまで、さまざまなターゲットを絞られていないワークフローで使用されています。CEの非標的化学プロファイリングまたは代謝産物の標的同定のためのメタボロミック研究と完全に統合することができる。このすべては、最終的に分離手順1、15、16、17の前に抽出物の優先順位付けにつながります。
そこで本稿では、植物抽出物および画分から抗菌分子および抗菌膜分子を同定するための体系的なアプローチを述べる。それは4つの学際的なステップを含んでいる:(1)植物材料のコレクション;(2)粗抽出物(CE)および分数(CEF)の調製、その後の化学プロファイル分析;(3) バイオアッセイ(4)生物・化学データ分析(図1)。そこで、ストレプトコッカス・ミュータンスおよびカンジダ・アルビカンス13に対するカゼリアシルヴェストリス抽出物および画分の抗菌・抗バイオフィルム活動を分析するために開発されたプロトコルと、植物化学的特性解析とデータ分析の手順を提示する。簡単にするために、ここでの焦点は、細菌を使用して天然化合物をスクリーニングするためのアプローチを実証することです。
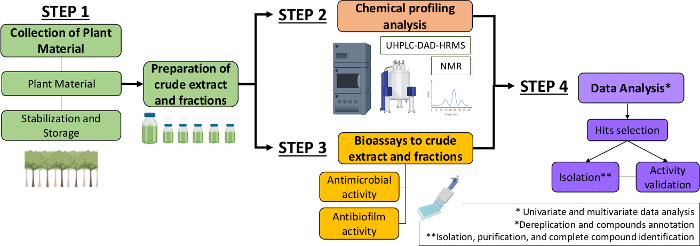
図1:植物抽出物と分画から活性分子を同定する系統的アプローチのフローチャート。この図の大きなバージョンを表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
天然の粗抽出物の研究に関連する主な課題は、その複雑な組成と古典的な生体誘導分離研究の不十分さから成り立っています。このプロセスは遅いですが,効果的であり,NP研究における主要な知見につながっています。合理化には、優先順位付け主導型の研究が必要です。したがって、分離前のCEおよび非複製の分析のための現代の化学プロファイリングアプローチの使用は、研究された材料?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
植物材料の製造研究所を提供してくれたアララクアラ/SPのUNESP化学研究所のヌクレオ・デ・バイオレジオジオス、バイオスシンテーゼ・エ・エコフィシオロジア・デ・プロドゥトス・ナチュラワ(NuBBE)に感謝の意を表します。また、アララクアラ/SPの歯学・補生学科応用微生物学研究室に感謝します。この研究は、サンパウロ研究財団(FAPESP #2013/07600-3からAJC)の研究助成金と、奨学金に加えてオーバーヘッド資金(FAPESP #2017/07408-6およびFAPESP #2019/23175-7からSMR #2012 #2011への研究助成金によって支えられました。FAPESPに関連する国家科学技術開発評議会は追加の支援を提供しました(INCT CNPq #465637/2014-0およびFAPESP #2014/50926-0をAJCに)。
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

