Systematisk tilnærming til å identifisere nye antimikrobielle og antibiofilmmolekyler fra planters ekstrakter og fraksjoner for å forhindre tannkaries
Summary
Naturlige produkter representerer lovende utgangspunkt for utvikling av nye legemidler og terapeutiske midler. Men på grunn av det høye kjemiske mangfoldet er det utfordrende og tidkrevende å finne nye terapeutiske forbindelser fra planter. Vi beskriver en forenklet tilnærming for å identifisere antimikrobielle og antibiofilmmolekyler fra planteekstrakter og fraksjoner.
Abstract
Naturlige produkter gir strukturelt forskjellige stoffer, med en myriade av biologiske aktiviteter. Identifisering og isolering av aktive forbindelser fra planter er imidlertid utfordrende på grunn av den komplekse plantematrisen og tidkrevende isolasjons- og identifikasjonsprosedyrer. Derfor presenteres en trinnvis tilnærming for screening av naturlige forbindelser fra planter, inkludert isolasjon og identifisering av potensielt aktive molekyler. Det inkluderer innsamling av plantematerialet; forberedelse og fraksjonering av råoljeekstrakter; kromatografi og spektrometri (UHPLC-DAD-HRMS og NMR) tilnærminger for analyse og forbindelser identifikasjon; bioanalyser (antimikrobielle og antibiofilmaktiviteter; bakteriell “vedheftsstyrke” til spyttpellet og innledende glukanmatrise behandlet med utvalgte behandlinger); og dataanalyse. Modellen er enkel, reproduserbar, og tillater høy gjennomstrømning screening av flere forbindelser, konsentrasjoner, og behandlingstrinn kan konsekvent kontrolleres. Dataene som er innhentet, danner grunnlaget for fremtidige studier, inkludert formuleringer med de mest aktive ekstraktene og/eller brøkene, isolering av molekyler, modellering av molekyler til spesifikke mål i mikrobielle celler og biofilmer. For eksempel er et mål å kontrollere karogen biofilm å hemme aktiviteten til Streptococcus mutans glukotransferaser som syntetiserer den ekstracellulære matrisens glukaner. Hemming av disse enzymene forhindrer biofilmoppbygging, noe som reduserer dens virulens.
Introduction
De tidligste modellene av medisin som brukes i samfunn var basert på naturlige produkter (NPer). Siden da har mennesker lett etter nye kjemikalier i naturen som kan forvandles til narkotika1. Dette søket forårsaket en kontinuerlig forbedring av teknologier og metoder for etnobotanisk screening1,2,3. NPs tilbyr en rik kilde til strukturelt varierte stoffer, med et bredt spekter av biologiske aktiviteter som er nyttige for å utvikle alternative eller adjuvante terapier. Den iboende komplekse plantematrisen gjør imidlertid isolasjon og identifisering av de aktive forbindelsene til en utfordrende og tidkrevende oppgave4.
NPs-baserte legemidler eller formuleringer kan brukes til å forebygge og/eller behandle flere tilstander som påvirker orale, inkluderttannkaries 4. Dental karies, en av de mest utbredte kroniske sykdommene globalt, stammer fra samspillet mellom sukkerrikt kosthold og mikrobielle biofilmer (tannplakk) dannet på tannoverflaten som fører til demineralisering forårsaket av organiske syrer avledet fra mikrobiell metabolisme, og hvis ikke behandlet, fører til tanntap5,6. Selv om andre mikroorganismer kan være forbundet7, er Streptococcus mutans en kritisk karogen bakterie fordi den er surogen, sur og en ekstracellulær matrisebygger. Denne arten koder flere eksoenzymer (f.eks. glykosyltransferaser eller Gtfs) som bruker sukrose som substrat8 for å bygge den ekstracellulære matrisen rik på eksopolysakkarider, som er en virulensdeterminant9. Også sopp Candida albicans kan drive opp produksjonen av den ekstracellulærematrisen 7. Riktignok fluor, administrert i ulike modaliteter, er fortsatt grunnlaget for å forebygge tannkaries10, nye tilnærminger er nødvendig som adjuvans for å øke effektiviteten. I tillegg er tilgjengelige anti-plakk modaliteter basert på bruk av bredspektrede mikrobicider (f.eks klorhexidin)11. Som et alternativ er NPs potensielle terapier for å kontrollere biofilmer og forebygge tannkaries12,13.
Det videre fremskrittet i oppdagelsen av nye bioaktive forbindelser fra planter inkluderer nødvendige trinn eller tilnærminger som: (i) bruk av pålitelige og reproduserbare protokoller for prøvetaking, med tanke på at planter ofte viser intraspesifikk variasjon; (ii) utarbeidelsen av omfattende ekstrakter og deres respektive fraksjoner i liten skala; (iii) karakterisering og/eller deplisering av deres kjemiske profiler trodde oppkjøpet av flerdimensjonale data som GC-MS, LC-DAD-MS eller NMR, for eksempel; (iv) bruk av levedyktige og høykapasitetsmodeller for å vurdere bioaktivitet; (v) valg av potensielle nye treff basert på multivariatdataanalyse eller andre statistiske verktøy; (vi) for å utføre isolasjon og rensing av målrettede forbindelser eller lovende kandidater; og (vii) valideringen av de korresponderte biologiske aktivitetene ved hjelp av de isolerteforbindelsene 2,14.
Dereplisering er prosessen med raskt å identifisere kjente forbindelser i råoljeekstrakt og tillater differensiering av nye forbindelser fra de som allerede er studert. Dessuten forhindrer denne prosessen isolasjon når bioaktivitet allerede er beskrevet for visse forbindelser, og det er spesielt nyttig å oppdage “hyppige hitters”. Den har blitt brukt i forskjellige untargeted arbeidsflyter som spenner fra store sammensatte identifikasjon eller akselerasjon av aktivitetsstyrt fraksjonering opp til kjemisk profilering av samlinger av ekstrakter. Det kan integreres fullt ut med metabolomiske studier for umålrettet kjemisk profilering av CE eller målrettet identifisering av metabolitter. Alt dette fører til slutt til å prioritere utdrag før isolasjonsprosedyrene1,15,16,17.
Derfor beskriver vi i det nåværende manuskriptet en systematisk tilnærming for å identifisere antimikrobielle og antibiofilmmolekyler fra planteekstrakter og fraksjoner. Det inkluderer fire tverrfaglige trinn: (1) samling av plantemateriale; (2) fremstilling av råoljeekstrakter (CE) og fraksjoner (CEF), etterfulgt av deres kjemiske profilanalyse; (3) bioanalyse; og (4) biologiske og kjemiske dataanalyser (figur 1). Dermed presenterer vi protokollen utviklet for å analysere antimikrobielle og antibiofilmaktiviteter av Casearia sylvestris ekstrakter og fraksjoner mot Streptococcus mutans og Candida albicans13, samt prosedyrene for fytokjemisk karakterisering og dataanalyse. For enkelhets skyld er fokuset her å demonstrere tilnærmingen for screening av naturlige forbindelser ved hjelp av bakterien.
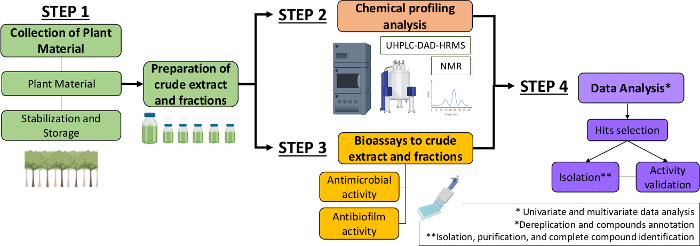
Figur 1: Flytkart over den systematiske tilnærmingen for å identifisere aktive molekyler fra planteekstrakter og fraksjoner. Vennligst klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
De viktigste utfordringene knyttet til arbeidet med naturlige råoljeekstrakter utgjør deres komplekse sammensetning og utilstrekkelighetene til klassiske biostyrte isolasjonsstudier. Selv om denne prosessen er treg, er den effektiv og har ført til store funn i NP-forskning. For å rasjonalisere er det nødvendig med prioriteringsdrevne studier for å rasjonalisere. Dermed er bruk av moderne kjemisk profilering tilnærminger for analyse av CE og duplisering før isolasjon viktig å karakterisere det studerte materialet…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi uttrykker vår takknemlighet til Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais (NuBBE) ved Chemistry Institute of UNESP, Araraquara/SP for å gi laboratoriene for å forberede plantemateriale. Vi takker også Applied Microbiology Laboratory ved Institutt for tannmaterialer og prosthodonti, UNESP, Araraquara / SP. Denne forskningen ble støttet av et forskningsstipend fra São Paulo Research Foundation (FAPESP #2013/07600–3 til AJC) og stipender pluss indirekte midler (FAPESP #2017/07408–6 og FAPESP #2019/23175-7 til SMR; #2011/21440–3 og #2012/21921–4 til PCPB). National Council for Scientific and Technological Development i samarbeid med FAPESP ga ytterligere støtte (INCT CNPq #465637/2014–0 og FAPESP #2014/50926–0 til AJC).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

