Abordagem Sistemática para Identificar Novas Moléculas antimicrobianas e antibiofilmes de extratos e frações de plantas para prevenir cárie dentária
Summary
Os produtos naturais representam pontos de partida promissores para o desenvolvimento de novas drogas e agentes terapêuticos. No entanto, devido à alta diversidade química, encontrar novos compostos terapêuticos das plantas é uma tarefa desafiadora e demorada. Descrevemos uma abordagem simplificada para identificar moléculas antimicrobianas e antibiofilmes a partir de extratos e frações vegetais.
Abstract
Os produtos naturais fornecem substâncias estruturalmente diferentes, com uma miríade de atividades biológicas. No entanto, a identificação e o isolamento de compostos ativos das plantas são desafiadores devido à complexa matriz vegetal e aos procedimentos demorados de isolamento e identificação. Por isso, é apresentada uma abordagem stepwise para a triagem de compostos naturais das plantas, incluindo o isolamento e identificação de moléculas potencialmente ativas. Inclui a coleta do material vegetal; preparação e fracionamento de extratos brutos; abordagens de cromatografia e espectrometria (UHPLC-DAD-HRMS e NMR) para análise e identificação de compostos; bioensações (atividades antimicrobianas e antibiofilmes; “força de adesão” bacteriana à pellícula salivar e matriz glucana inicial tratada com tratamentos selecionados); e análise de dados. O modelo é simples, reprodutível e permite a triagem de alto rendimento de múltiplos compostos, concentrações e passos de tratamento podem ser consistentemente controlados. Os dados obtidos fornecem a base para estudos futuros, incluindo formulações com extratos e/ou frações mais ativos, isolamento de moléculas, modelagem de moléculas para alvos específicos em células microbianas e biofilmes. Por exemplo, um alvo para controlar o biofilme cariogênico é inibir a atividade de glucosyltransferases da matriz extracelular que sintetizam os glúcanos da matriz extracelular. A inibição dessas enzimas impede o acúmulo de biofilme, diminuindo sua virulência.
Introduction
Os primeiros modelos de medicina utilizados nas sociedades foram baseados em produtos naturais (NPs). Desde então, os humanos têm procurado por novos produtos químicos na natureza que possam ser transformados em drogas1. Essa pesquisa causou uma melhoria contínua das tecnologias e métodos para a triagem etnobotânica1,2,3. Os NPs oferecem uma rica fonte de substâncias estruturalmente diversas, com uma ampla gama de atividades biológicas úteis para o desenvolvimento de terapias alternativas ou adjuvantes. No entanto, a matriz vegetal complexa inerente torna o isolamento e identificação dos compostos ativos uma tarefa desafiadora e demorada4.
Medicamentos ou formulações baseadas em NPs podem ser usados para prevenir e/ou tratar várias condições que afetam a oral, incluindo cárie dentária4. A cárie dentária, uma das doenças crônicas mais prevalentes globalmente, deriva da interação da dieta rica em açúcar e dos biofilmes microbianos (placa dentária) formados na superfície dentária que leva à desmineralização causada por ácidos orgânicos derivados do metabolismo microbiano e, se não tratados, leva à perda de dentes5,6. Embora outros microrganismos possam estar associados7, Streptococcus mutans é uma bactéria cariogênica crítica porque é acidogênica, aciduric, e um construtor de matriz extracelular. Esta espécie codifica múltiplos exoenzymes (por exemplo, glicosyltransferases ou Gtfs) que usam sacarose como substrato8 para construir a matriz extracelular rica em exopolysacarídeos, que são um determinante virulência9. Além disso, os fungos Candida albicans podem impulsionar a produção dessa matriz extracelular7. Embora o flúor, administrado em diversas modalidades, continue sendo a base para a prevenção da cárie dentária10, novas abordagens são necessárias como adjuvantes para aumentar sua eficácia. Além disso, as modalidades anti-placa disponíveis baseiam-se no uso de agentes microbicidais de amplo espectro (por exemplo, clorexidina)11. Como alternativa, as NPs são terapias potenciais para o controle de biofilmes e prevenção de cárie dentária12,13.
O avanço adicional na descoberta de novos compostos bioativos das plantas inclui etapas ou abordagens necessárias, tais como: (i) o uso de protocolos confiáveis e reprodutíveis para amostragem, considerando que as plantas frequentemente apresentam variabilidade intraespecífica; (ii) a elaboração de extratos abrangentes e suas respectivas frações em pequena escala; (iii) a caracterização e/ou dereplicação de seus perfis químicos pensou na aquisição de dados multidimensionais como GC-MS, LC-DAD-MS ou NMR, por exemplo; (iv) a utilização de modelos viáveis e de alto rendimento para avaliar a bioatividade; v A seleção de novos hits potenciais com base na análise de dados multivariados ou outras ferramentas estatísticas; vi Realizar o isolamento e purificação dos compostos direcionados ou candidatos promissores; e (vii) a validação das atividades biológicas correspondentes utilizando os compostos isolados2,14.
A dereplicação é o processo de identificação rápida de compostos conhecidos em extrato bruto e permite diferenciar novos compostos daqueles que já foram estudados. Além disso, esse processo previne o isolamento quando a bioatividade já foi descrita para determinados compostos, e é particularmente útil detectar “rebatedores frequentes”. Tem sido usado em diferentes fluxos de trabalho não-alvo, desde a identificação de compostos principais ou a aceleração do fracionamento guiado pela atividade até o perfil químico das coleções de extratos. Pode ser totalmente integrado com estudos metabolômicos para o perfil químico não direcionado de CE ou a identificação direcionada de metabólitos. Tudo isso, em última análise, leva à priorização de extratos antes dos procedimentos de isolamento1,15,16,17.
Portanto, no presente manuscrito, descrevemos uma abordagem sistemática para identificar moléculas antimicrobianas e antibiofilmes a partir de extratos e frações vegetais. Inclui quatro etapas multidisciplinares: (1) coleta de material vegetal; (2) elaboração de extratos brutos (CE) e frações (CEF), seguidos de sua análise de perfil químico; (3) bioensaios; e (4) análises de dados biológicos e químicos(Figura 1). Assim, apresentamos o protocolo desenvolvido para analisar as atividades antimicrobianas e antibiofilmes de extratos e frações de Casearia sylvestris contra Streptococcus mutans e Candida albicans13,bem como os procedimentos para a caracterização fitoquímica e análise de dados. Para simplificar, o foco aqui é demonstrar a abordagem para a triagem de compostos naturais usando a bactéria.
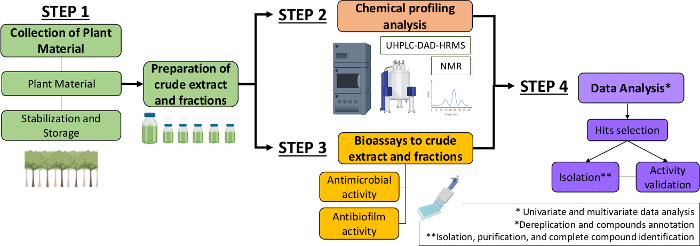
Figura 1: Fluxograma da Abordagem Sistemática para identificar moléculas ativas de extratos e frações de plantas. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Os principais desafios relacionados ao trabalho com extratos naturais brutos compreendem sua composição complexa e as inadequações de estudos clássicos de isolamento biogui guiado. Embora esse processo seja lento, é eficaz e levou a grandes descobertas na pesquisa de PN. Para racionalizar, são necessários estudos orientados à priorização para racionalizar. Assim, o uso de abordagens químicas modernas para análise de CE e desreplicação antes do isolamento são importantes para caracterizar o material estuda…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Expressamos nossa gratidão ao Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais (NuBBE) do Instituto de Química da UNESP, Araraquara/SP, por fornecer os laboratórios para a preparação do material vegetal. Agradecemos também ao Laboratório de Microbiologia Aplicada do Departamento de Materiais Odontológicos e Prostodontia, UNESP, Araraquara/SP. Esta pesquisa foi apoiada por uma bolsa de pesquisa da Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP #2013/07600-3 à AJC) e bolsas de estudo (FAPESP #2017/07408-6 e FAPESP #2019/23175-7 à RMS; #2011/21440-3 e #2012/21921-4 para PCPB). O Conselho Nacional de Desenvolvimento Científico e Tecnológico em parceria com a FAPESP prestou apoio adicional (INCT CNPq #465637/2014-0 e FAPESP #2014/50926-0 à AJC).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

