Enfoque sistemático para identificar nuevas moléculas antimicrobianas y antibiócidas de extractos y fracciones de plantas para prevenir caries dentales
Summary
Los productos naturales representan prometedores puntos de partida para el desarrollo de nuevos fármacos y agentes terapéuticos. Sin embargo, debido a la alta diversidad química, encontrar nuevos compuestos terapéuticos de las plantas es una tarea difícil y que consume mucho tiempo. Describimos un enfoque simplificado para identificar moléculas antimicrobianas y antibiócidas a partir de extractos y fracciones vegetales.
Abstract
Los productos naturales proporcionan sustancias estructuralmente diferentes, con una miríada de actividades biológicas. Sin embargo, la identificación y el aislamiento de compuestos activos de las plantas son difíciles debido a la compleja matriz vegetal y los procedimientos de aislamiento e identificación que consumen mucho tiempo. Por lo tanto, se presenta un enfoque escalonado para la detección de compuestos naturales de las plantas, incluyendo el aislamiento y la identificación de moléculas potencialmente activas. Incluye la recogida del material vegetal; preparación y fraccionamiento de extractos crudos; enfoques de cromatografía y espectrometría (UHPLC-DAD-HRMS y NMR) para la identificación de análisis y compuestos; bioensayos (actividades antimicrobianas y antibióticas; “fuerza de adhesión” bacteriana al pellicle salival y matriz glucana inicial tratada con tratamientos seleccionados); y análisis de datos. El modelo es simple, reproducible y permite la detección de alto rendimiento de múltiples compuestos, concentraciones y pasos de tratamiento se pueden controlar constantemente. Los datos obtenidos proporcionan la base para futuros estudios, incluyendo formulaciones con los extractos y/o fracciones más activos, aislamiento de moléculas, modelado de moléculas a objetivos específicos en células microbianas y biofilms. Por ejemplo, un objetivo para controlar el biofilm cariogénico es inhibir la actividad de Streptococcus mutans glucosyltransferases que sintetizan los glucanos de la matriz extracelular. La inhibición de esas enzimas impide la acumulación de biofilm, disminuyendo su virulencia.
Introduction
Los primeros modelos de medicina utilizados en las sociedades se basaron en productos naturales (NPs). Desde entonces, los seres humanos han estado buscando nuevos productos químicos en la naturaleza que pueden transformarse en drogas1. Esta búsqueda causó una mejora continua de tecnologías y métodos para la detección etnobotánica1,2,3. Los NPs ofrecen una rica fuente de sustancias estructuralmente diversas, con una amplia gama de actividades biológicas útiles para el desarrollo de terapias alternativas o adyuvantes. Sin embargo, la matriz vegetal compleja inherente hace que el aislamiento y la identificación de los compuestos activos sea una tarea desafiante y que consume mucho tiempo4.
Los medicamentos o formulaciones basados en NPs se pueden utilizar para prevenir y/o tratar varias afecciones que afectan oralmente, incluidos los caries dentales4. Los caries dentales, una de las enfermedades crónicas más prevalentes a nivel mundial, derivan de la interacción de la dieta rica en azúcar y biofilms microbianos (placa dental) formados en la superficie dental que conduce a la desmineralización causada por ácidos orgánicos derivados del metabolismo microbiano, y si no se tratan, conduce a la pérdida de dientes5,6. Aunque otros microorganismos pueden estar asociados7, Streptococcus mutans es una bacteria cariogénica crítica porque es acidogénico, acidurico, y un constructor de matriz extracelular. Esta especie codifica múltiples exoenzimas (por ejemplo, glicosiltransferasas o Gtfs) que utilizan sacarosa como sustrato8 para construir la matriz extracelular rica en exopolísacáridos, que son un determinante de virulencia9. Además, el hongo Candida albicans puede impulsar la producción de esa matriz extracelular7. Aunque el flúor, administrado en diversas modalidades, sigue siendo la base para prevenir caries dentales10,se necesitan nuevos enfoques como adyuvantes para aumentar su eficacia. Además, las modalidades anti-placa disponibles se basan en el uso de agentes microbicidas de amplio espectro (por ejemplo, clorhexidina)11. Como alternativa, los NPs son terapias potenciales para controlar biofilms y prevenir caries dentales12,13.
El avance adicional en el descubrimiento de nuevos compuestos bioactivos de las plantas incluye pasos o enfoques necesarios tales como: i) el uso de protocolos fiables y reproducibles para el muestreo, teniendo en cuenta que las plantas a menudo muestran variabilidad intraespecífica; (ii) la preparación de extractos completos y sus respectivas fracciones a pequeña escala; (iii) la caracterización y/o desreplicación de sus perfiles químicos pensó en la adquisición de datos multidimensionales como GC-MS, LC-DAD-MS o NMR, por ejemplo; (iv) el uso de modelos viables y de alto rendimiento para evaluar la bioactividad; (v) la selección de nuevos éxitos potenciales basados en análisis de datos multivariantes u otras herramientas estadísticas; (vi) realizar el aislamiento y purificación de los compuestos objetivo o candidatos prometedores; y vii) la validación de las actividades biológicas correspondidas utilizando los compuestos aislados2,14.
La desreplicación es el proceso de identificación rápida de compuestos conocidos en extracto crudo y permite diferenciar compuestos novedosos de los que ya han sido estudiados. Además, este proceso evita el aislamiento cuando ya se ha descrito la bioactividad para ciertos compuestos, y es particularmente útil detectar “bateadores frecuentes”. Se ha utilizado en diferentes flujos de trabajo no dirigidos que van desde la identificación de compuestos principales o la aceleración del fraccionamiento guiado por actividad hasta la elaboración de perfiles químicos de colecciones de extractos. Se puede integrar completamente con estudios metabolómicos para la elaboración de perfiles químicos no dirigidos de CE o la identificación específica de metabolitos. Todo esto conduce en última instancia a priorizar los extractos antes de los procedimientos de aislamiento1,15,16,17.
Por lo tanto, en el presente manuscrito, describimos un enfoque sistemático para identificar moléculas antimicrobianas y antibiócidas a partir de extractos y fracciones vegetales. Incluye cuatro pasos multidisciplinarios: (1) recolección de material vegetal; 2) preparación de extractos crudos (CE) y fracciones (CEF), seguidos de su análisis de perfil químico; 3) bioensayos; y (4) análisis biológicos y químicos de datos (Figura 1). Así, presentamos el protocolo desarrollado para analizar las actividades antimicrobianas y antibióquidas de extractos y fracciones de Casearia sylvestris contra Streptococcus mutans y Candida albicans13,así como los procedimientos para la caracterización fitoquímica y el análisis de datos. Para simplificar, el enfoque aquí es demostrar el enfoque para la detección de compuestos naturales utilizando la bacteria.
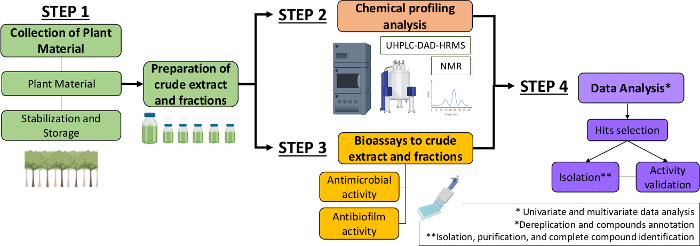
Figura 1: Diagrama de flujo del enfoque sistemático para identificar moléculas activas de extractos y fracciones de plantas. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Los principales desafíos relacionados con el trabajo con extractos de crudo natural comprenden su composición compleja y las insuficiencias de los estudios clásicos de aislamiento bioguiado. Aunque este proceso es lento, es eficaz y ha llevado a importantes hallazgos en la investigación np. Para racionalizar, se necesitan estudios basados en la priorización para racionalizar. Por lo tanto, el uso de enfoques modernos de elaboración de perfiles químicos para el análisis del CE y la desreplicación antes del aislam…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Expresamos nuestro agradecimiento al Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais (NuBBE) del Instituto de Química de la UNESP, Araraquara/SP por proporcionar los laboratorios para la preparación de material vegetal. También agradecemos al Laboratorio de Microbiología Aplicada del Departamento de Materiales y Prostodoncia Dental, UNESP, Araraquara/SP. Esta investigación fue apoyada por una beca de investigación de la São Paulo Research Foundation (FAPESP #2013/07600–3 a AJC) y becas más fondos generales (FAPESP #2017/07408-6 y FAPESP #2019/23175-7 a SMR; #2011/21440–3 y #2012/21921–4 a PCPB). El Consejo Nacional para el Desarrollo Científico y Tecnológico en asociación con la FAPESP brindó apoyo adicional (INCT CNPq #465637/2014-0 y FAPESP #2014/50926-0 a AJC).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

