Systematiskt tillvägagångssätt för att identifiera nya antimikrobiella och antibiofilmmolekyler från växters extrakt och fraktioner för att förhindra karies
Summary
Naturliga produkter utgör lovande utgångspunkter för utveckling av nya läkemedel och terapeutiska medel. Men på grund av den höga kemiska mångfalden är det en utmanande och tidskrävande uppgift att hitta nya terapeutiska föreningar från växter. Vi beskriver ett förenklat tillvägagångssätt för att identifiera antimikrobiella och antibiofilm molekyler från växt extrakt och fraktioner.
Abstract
Naturliga produkter ger strukturellt olika ämnen, med en myriad av biologiska aktiviteter. Identifiering och isolering av aktiva föreningar från växter är dock utmanande på grund av den komplexa växtmatrisen och tidskrävande isolerings- och identifieringsförfaranden. Därför presenteras ett stegvis tillvägagångssätt för screening av naturliga föreningar från växter, inklusive isolering och identifiering av potentiellt aktiva molekyler. Det inkluderar insamling av växtmaterialet; Beredning och fraktionering av råextrakt. Metoder för kromatografi och spektrometri (UHPLC-DAD-HRMS och NMR) för analys och identifiering av föreningar. Bioassays (antimikrobiella och antibiofilmsaktiviteter; bakteriell “vidhäftningsstyrka” till saliv pellikeln och den ursprungliga glukanmatrisen som behandlats med utvalda behandlingar). och dataanalys. Modellen är enkel, reproducerbar och möjliggör screening med hög genomströmning av flera föreningar, koncentrationer och behandlingssteg kan kontrolleras konsekvent. De erhållna uppgifterna utgör grunden för framtida studier, inklusive formuleringar med de mest aktiva extrakten och/eller fraktionerna, isolering av molekyler, modelleringsmolekyler till specifika mål i mikrobiella celler och biofilmer. Ett mål för att kontrollera kariogen biofilm är till exempel att hämma aktiviteten hos Streptococcus mutans glukosyltransferaser som syntetiserar den extracellulära matrisens glukaner. Hämningen av dessa enzymer förhindrar biofilmuppbyggnaden, vilket minskar dess virulens.
Introduction
De tidigaste läkemedelsmodellerna som används i samhällen baserades på naturliga produkter.The earliest models of medicine used in societies were based on natural products (NPs). Sedan dess har människor letat efter nya kemikalier i naturen som kan omvandlas till droger1. Denna sökning orsakade en kontinuerlig förbättring av teknik och metoder för etnobotanisk screening1,2,3. NPs erbjuder en rik källa till strukturellt olika ämnen, med ett brett utbud av biologiska aktiviteter som är användbara för att utveckla alternativa eller adjuvanta terapier. Den inneboende komplexa växtmatrisen gör dock isoleringen och identifieringen av de aktiva föreningarna till en utmanande och tidskrävande uppgift4.
NPs-baserade läkemedel eller formuleringar kan användas för att förebygga och/eller behandla flera tillstånd som påverkar orala, inklusive karies4. Karies, en av de vanligaste kroniska sjukdomarna globalt, härrör från interaktionen mellan sockerrik kost och mikrobiella biofilmer (dental plack) som bildas på tandytan som leder till demineralisering orsakad av organiska syror som härrör från mikrobiell metabolism, och om den inte behandlas, leder till tandförlust5,6. Även om andra mikroorganismer kan associeras7, är Streptococcus mutans en kritisk kariogen bakterie eftersom den är surogen, sur och en extracellulär matrisbyggare. Denna art kodar för flera exoenzymer (t.ex. glykosyltransferaser eller gtfs) som använder sackaros som substrat8 för att bygga den extracellulära matrisen rik på exopolysackarider, som är en virulensbestämandefaktor 9. Svampen Candida albicans kan också driva upp produktionen av den extracellulära matrisen7. Även om fluor, administreras i olika former, förblir grunden för att förhindra karies10, behövs nya metoder som adjuvanser för att öka dess effektivitet. Dessutom är de tillgängliga antiplackmodaliteterna baserade på användning av bredspektrummikrobicida medel (t.ex. klorhexidin)11. Som ett alternativ är NPs potentiella terapier för att kontrollera biofilmer och förebygga karies12,13.
De ytterligare framstegen i upptäckten av nya bioaktiva föreningar från växter omfattar nödvändiga steg eller metoder såsom i) användning av tillförlitliga och reproducerbara protokoll för provtagning, med tanke på att växter ofta uppvisar intraspecifik variabilitet, ii) användning av tillförlitliga och reproducerbara protokoll för provtagning, med beaktande av att växter ofta uppvisar intraspecifik variabilitet, ii) användning av tillförlitliga och reproducerbara protokoll för provtagning, med beaktande av att växter ofta uppvisar intraspecifik variabilitet, ii) användning av tillförlitliga och reproducerbara protokoll för provtagning, med beaktande av att växter ofta uppvisar intraspecifik variabilitet, ii) användning av tillförlitliga och reproducerbara protokoll för provtagning, med beaktande av att växter ofta uppvisar intraspecifik variabilitet, ii) Beredning av omfattande extrakt och deras respektive fraktioner i liten skala. iii) Karakteriseringen och/eller derepliceringen av deras kemiska profiler, t.ex. iv) Användning av livskraftiga modeller och högavkastande modeller för att bedöma bioaktivitet. v) Urval av potentiella nya träffar på grundval av multivariat dataanalys eller andra statistiska verktyg. vi) att utföra isolering och rening av de målinriktade föreningarna eller de lovande kandidaterna, och vii) validering av de motsvarade biologiska aktiviteterna med hjälp av de isoleradeföreningarna 2,14.
Dereplication är processen att snabbt identifiera kända föreningar i råextrakt och tillåter differentiering av nya föreningar från de som redan har studerats. Dessutom förhindrar denna process isolering när bioaktivitet redan har beskrivits för vissa föreningar, och det är särskilt användbart att upptäcka “frekventa hitters”. Det har använts i olika oberiktade arbetsflöden som sträcker sig från större sammansatt identifiering eller acceleration av aktivitetsstyrd fraktionering fram till kemisk profilering av samlingar av extrakt. Det kan integreras helt med metabolomiska studier för obeladda kemiska profilering av CE eller riktad identifiering av metaboliter. Allt detta leder slutligen till att prioritera extrakt före isoleringsförfarandena1,15,16,17.
Därför beskriver vi i det nuvarande manuskriptet ett systematiskt tillvägagångssätt för att identifiera antimikrobiella och antibiofilmmolekyler från växtextrakt och fraktioner. Den innehåller fyra tvärvetenskapliga steg: (1) insamling av växtmaterial; 2. Beredning av råextrakt (CE) och fraktioner (FSE), följt av deras kemiska profilanalys. 3. Bioassays. och (4) biologiska och kemiska dataanalyser (figur 1). Således presenterar vi protokollet utvecklat för att analysera de antimikrobiella och antibiofilm aktiviteterna i Casearia sylvestris extrakt och fraktioner mot Streptococcus mutans och Candida albicans13, liksom förfarandena för fytokemisk karakterisering och dataanalys. För enkelhetens skull är fokus här att demonstrera tillvägagångssättet för screening av naturliga föreningar med hjälp av bakterien.
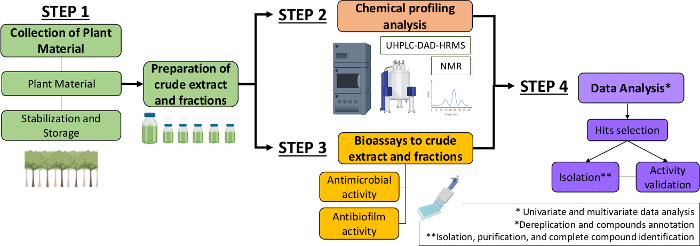
Figur 1: Flödesschema över det systematiska tillvägagångssättet för att identifiera aktiva molekyler från växters extrakt och fraktioner. Klicka här om du vill visa en större version av den här figuren.
Protocol
Representative Results
Discussion
De största utmaningarna i samband med arbetet med naturliga råextrakt är deras komplexa sammansättning och bristerna i klassiska biostyrda isoleringsstudier. Även om denna process är långsam är den effektiv och har lett till stora resultat i NP-forskning. För att rationalisera behövs prioriteringsdrivna studier för att rationalisera. Således är användningen av moderna kemiska profileringsmetoder för analys av CE och dereplication före isolering viktigt för att karakterisera det studerade materialet och s…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi uttrycker vår tacksamhet till Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais (NuBBE) vid Kemiinstitutet i UNESP, Araraquara/SP för att ha tillhandahållit laboratorierna för beredning av växtmaterial. Vi tackar också Applied Microbiology Laboratory vid institutionen för tandmaterial och prostodonti, UNESP, Araraquara/SP. Denna forskning stöddes av ett forskningsanslag från São Paulo Research Foundation (FAPESP #2013/07600–3 till AJC) och stipendier plus overheadfonder (FAPESP #2017/07408–6 och FAPESP #2019/23175–7 till SMR; #2011/21440–3 och #2012/21921–4 till PCPB). Det nationella rådet för vetenskaplig och teknisk utveckling i samarbete med FAPESP gav ytterligare stöd (INCT CNPq #465637/2014–0 och FAPESP #2014/50926–0 till AJC).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

