Systematisk tilgang til identificering af nye antimikrobielle og antibiofilmmolekyler fra planternes ekstrakter og fraktioner for at forhindre caries
Summary
Naturlige produkter udgør lovende udgangspunkter for udviklingen af nye lægemidler og terapeutiske midler. Men på grund af den høje kemiske mangfoldighed er det en udfordrende og tidskrævende opgave at finde nye terapeutiske forbindelser fra planter. Vi beskriver en forenklet tilgang til identifikation af antimikrobielle og antibiofilmmolekyler fra planteekstrakter og fraktioner.
Abstract
Naturlige produkter giver strukturelt forskellige stoffer med et utal af biologiske aktiviteter. Identifikation og isolering af aktive forbindelser fra planter er imidlertid udfordrende på grund af den komplekse plantematrix og tidskrævende isolations- og identifikationsprocedurer. Derfor præsenteres en trinvis tilgang til screening af naturlige forbindelser fra planter, herunder isolering og identifikation af potentielt aktive molekyler. Det omfatter indsamling af plantematerialet; tilberedning og fraktionering af råekstrakter; kromatografi og spektrometri (UHPLC-DAD-HRMS og NMR) metoder til analyse og identifikation af forbindelser bioassays (antimikrobielle og antibiofilmaktiviteter; bakteriel “vedhæftningsstyrke” til spyt pellicle og indledende glucanmatrix behandlet med udvalgte behandlinger) og dataanalyse. Modellen er enkel, reproducerbar og giver mulighed for screening med høj gennemløb af flere forbindelser, koncentrationer og behandlingstrin kan kontrolleres konsekvent. De opnåede data danner grundlag for fremtidige undersøgelser, herunder formuleringer med de mest aktive ekstrakter og/eller fraktioner, isolering af molekyler, modellering af molekyler til specifikke mål i mikrobielle celler og biofilm. For eksempel er et mål at kontrollere cariogen biofilm at hæmme aktiviteten af Streptococcus mutans glucosyltransferaser, der syntetiserer den ekstracellulære matrix ‘glucaner. Hæmning af disse enzymer forhindrer ophobning af biofilm, hvilket reducerer dens virulens.
Introduction
De tidligste modeller af medicin, der anvendes i samfund, var baseret på naturlige produkter (NPs). Siden da har mennesker søgt efter nye kemikalier i naturen, der kan omdannes til stoffer1. Denne søgning medførte en løbende forbedring af teknologier og metoder til ethnobotanical screening1,2,3. NPs tilbyder en rig kilde til strukturelt forskellige stoffer, med en bred vifte af biologiske aktiviteter nyttige til udvikling af alternative eller adjuvans behandlinger. Den iboende komplekse plantematrix gør imidlertid isolering og identifikation af de aktive forbindelser til en udfordrende og tidskrævende opgave4.
NPs-baserede lægemidler eller formuleringer kan bruges til at forebygge og/eller behandle flere tilstande, der påvirker orale, herunder caries4. Caries, en af de mest udbredte kroniske sygdomme globalt, stammer fra samspillet mellem sukkerrig kost og mikrobielle biofilm (plak) dannet på tandoverfladen, der fører til demineralisering forårsaget af organiske syrer afledt af mikrobiel metabolisme, og hvis de ikke behandles, fører til tandtab5,6. Selv om andre mikroorganismer kan være forbundet7, Streptococcus mutans er en kritisk cariogen bakterie, fordi det er acidogen, aciduric, og en ekstracellulær matrix builder. Denne art koder flere exoenzymer (f.eks. glykosyltransferaser eller GTF’er), der bruger saccharose som substrat8 til at opbygge den ekstracellulære matrix, der er rig på exopolysaccharider, som er en virulensdeterminant9. Svampen Candida albicans kan også øge produktionen af den ekstracellulære matrix7. Selv om fluor, administreret i forskellige modaliteter, fortsat er grundlaget for at forebygge caries10, nye tilgange er nødvendige som adjuvanser for at øge dens effektivitet. Desuden er de tilgængelige antiplak-modaliteter baseret på brugen af bredspektret mikrobicidale midler (f.eks. chlorhexidin)11. Som et alternativ, NPs er potentielle behandlingsformer til kontrol af biofilm og forebyggelse af caries12,13.
Det yderligere fremskridt med opdagelsen af nye bioaktive forbindelser fra planter omfatter nødvendige skridt eller fremgangsmåder såsom: i) anvendelse af pålidelige og reproducerbare protokoller til prøveudtagning, idet planterne ofte udviser intraspecifik variation; ii) fremstilling af samlede ekstrakter og deres respektive fraktioner i lille målestok iii) karakteriseringen og/eller dereplicationen af deres kemiske profiler mente f.eks., at der var anskaffelse af flerdimensionale data såsom GC-MS, LC-DAD-MS eller NMR iv) anvendelse af levedygtige modeller med højt udbytte til vurdering af bioaktivitet v) udvælgelse af potentielle nye hits baseret på flerdimensional dataanalyse eller andre statistiske værktøjer vi) at foretage isolering og rensning af de målrettede forbindelser eller lovende kandidater og vii) validering af de tilsvarende biologiske aktiviteter ved hjælp af de isolerede forbindelser2,14.
Dereplication er processen med hurtigt at identificere kendte forbindelser i rå ekstrakt og giver mulighed for at skelne nye forbindelser fra dem, der allerede er blevet undersøgt. Desuden forhindrer denne proces isolation, når bioaktivitet allerede er beskrevet for visse forbindelser, og det er især nyttigt at opdage “hyppige hitters”. Det har været brugt i forskellige ikke-målrettede arbejdsgange lige fra større sammensatte identifikation eller acceleration af aktivitetsstyret fraktionering op til den kemiske profilering af samlinger af ekstrakter. Det kan integreres fuldt ud med metabolomiske undersøgelser med henblik på ikke-målrettet kemisk profilering af CE eller målrettet identifikation af metabolitter. Alt dette fører i sidste ende til at prioritere uddrag før isolationsprocedurerne1,15,16,17.
Derfor beskriver vi i dette manuskript en systematisk tilgang til identifikation af antimikrobielle og antibiofilmmolekyler fra planteekstrakter og fraktioner. Det omfatter fire tværfaglige trin: 1) indsamling af plantemateriale; 2) fremstilling af råekstrakter (CE) og fraktioner (CEF) efterfulgt af deres kemiske profilanalyse 3) bioassays og 4) analyser af biologiske og kemiske data (figur 1). Således præsenterer vi den protokol, der er udviklet til at analysere casearia sylvestrisekstrakternes og fraktionernes antimikrobielle og antibiofilmaktiviteter mod Streptococcus mutans og Candida albicans13, samt procedurerne for den fytokemiske karakterisering og dataanalyse. For nemheds skyld er fokus her at demonstrere tilgangen til screening af naturlige forbindelser ved hjælp af bakterien.
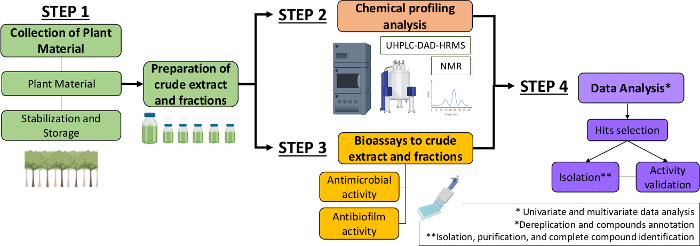
Figur 1: Rutediagram over den systematiske metode til identifikation af aktive molekyler fra planteekstrakter og fraktioner. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
De største udfordringer i forbindelse med arbejdet med naturlige råekstrakter omfatter deres komplekse sammensætning og utilstrækkeligheden af klassiske biostyrede isolationsstudier. Selv om denne proces er langsom, er den effektiv og har ført til store resultater inden for NP-forskning. For at rationalisere er prioriteringsdrevne undersøgelser nødvendige for at rationalisere. Således er brugen af moderne kemiske profileringsmetoder til analyse af CE og dereplication før isolation vigtig for at karakterisere det…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi udtrykker vores taknemmelighed over for Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais (NuBBE) fra Kemiinstituttet for UNESP, Araraquara/SP for at stille laboratorier til rådighed til udarbejdelse af plantemateriale. Vi takker også anvendt mikrobiologilaboratorium ved Institut for Dental Materials and Prosthodontics, UNESP, Araraquara/SP. Denne forskning blev støttet af et forskningstilskud fra São Paulo Research Foundation (FAPESP #2013/07600-3 til AJC) og stipendier plus faste midler (FAPESP #2017/07408-6 og FAPESP #2019/23175-7 til SMR; #2011/21440-3 og #2012/21921-4 til PCPB). Det nationale råd for videnskabelig og teknologisk udvikling ydede i samarbejde med FAPESP yderligere støtte (INCT CNPq #465637/2014-0 og FAPESP #2014/50926-0 til AJC).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

