声学悬浮系统中非球形气泡振荡诱导微流
Summary
提出了一种快速可靠的技术来控制单个捕获声气泡的形状振荡,该技术基于两个气泡之间的聚结技术。稳态、对称控制的气泡形状振荡允许分析气泡界面附近产生的流体流动。
Abstract
当位于生物屏障附近时,振荡微泡可能会增加细胞膜通透性,从而实现药物和基因内化。实验观察表明,这些屏障的暂时透化可能是由于空化微流对细胞组织施加的剪切应力。空化微流是在振荡的超声波微泡周围产生的涡流的产生。为了产生这样的液体流动,气泡振荡必须偏离纯粹的球形振荡,并包括平移不稳定性或形状模式。由于难以以稳定可控的方式捕获微气泡的形状变形,因此对附近表面的气泡诱导流动和剪切应力的实验研究范围通常受到限制。我们描述了用于研究对称控制非球形振荡的声学悬浮室的设计。这种控制是通过在足够强烈的超声场中使用两个接近的气泡之间的聚结技术来执行的。对非球形振荡的控制为自由表面振荡微气泡的受控空化微流开辟了道路。高帧率相机允许在声学时间尺度上准同时研究非球形气泡动力学和在较低时间尺度上的液体流动。结果表明,可以获得多种流体模式,并且它们与气泡界面的模态内容相关。我们证明,如果界面动力学包含多种模式,即使是高阶形状模式也可以创建大距离流体模式,突出了非球形振荡在靶向和局部药物递送方面的潜力。
Introduction
在医学上,给药的药物必须穿透生命系统中的许多障碍才能达到预期目标。然而,大多数药物会迅速从血液中清除。靶向效率低,不易穿过细胞膜,导致药物递送无效。目前,微泡与超声结合使用已被提出为一种将药物和基因无创、精确和靶向递送到病理组织和细胞的创新方法1。在这种方法中,微气泡可以作为载体发挥作用,其中游离药物要么与气泡悬浮液共同注射,要么加载在其表面上。微泡还可以作为局部载体,重新聚焦超声能量,以便与细胞相互作用。基本上,在超声波照射下,气泡稳定地压缩和膨胀,这种状态称为稳定空化,产生液体流动,从而对附近的物体产生剪切应力。在惯性空化状态下,微气泡也可能非线性振荡并膨胀直到坍塌,产生从坍塌部位径向传播的冲击波2。已经表明,空化,无论是稳定的还是惯性的,都会增强细胞膜的透化,从而增强药物内化到细胞中3。
在治疗应用中,了解气泡细胞相互作用的机制非常重要,但是从科学和技术方面来看,存在一些障碍,阻碍了我们的知识进步。首先,捕获细胞响应气泡诱导的机械刺激的动力学是非常困难的4。在声学时间尺度上,一阶微气泡振荡可以导致膜通道的激活,促进分子通过生物界面。这是通过细胞膜的直接振荡发生的,也称为“细胞按摩”5。使用膜片钳技术证明了直接机械应力后的通道激活,该技术测量了超声暴露期间和之后细胞膜的电生理特性6。在声学时间尺度上测量气泡诱导的细胞动力学(意味着细胞膜的完整变形场),还将提供诱导孔进入细胞膜所需的膜面积扩展阈值Δ A/ A的见解7。第二个屏障是控制破裂的气泡状态,以避免微气泡诱导的细胞裂解。气泡坍塌和诱导微射流已被确定为发生膜穿孔的机制8,9。一旦透化,细胞膜通过脂质双层的钙自密封和细胞内囊泡的融合进行修复9。气泡坍塌的发生也可能对细胞造成致命的损害,并在周围细胞中引起不必要的副作用。在超声波介导的血脑屏障打开等敏感应用中,人们普遍认为应避免惯性气泡坍塌10。
因此,目前在超声发射序列的设计上投入了巨大的精力,再加上被动空化监测和控制,以确保微气泡的稳定振荡11。在这种稳定的状态下,假设稳定振荡的气泡通过促进细胞膜上的空间靶向剪切应力在膜透化的触发中起着重要作用7。剪切应力是由振荡气泡附近产生的液体流动引起的。这些液体流动被称为空化微流,如上所述,它们是负责增强细胞外分子摄取的几种可能机制之一。当处理气泡或细胞悬浮液(例如体外生物转染测定12)时,通过微流透化可能比通过气泡塌陷进行透化更有效。这可以通过简单的几何考虑来证明。在细胞悬液中,如果大多数悬浮细胞受到足够大的机械效应(导致膜透化),则超声处理将是有效的。众所周知,气泡坍塌是沿着各向同性对称性破坏的方向定向的,例如气泡壁轴13 或气泡-气泡和气泡细胞线连接其质心14。因此,产生的微射流是一种空间定位现象,沿着连接细胞和气泡中心的有限数量的线。根据细胞和气泡浓度以及气泡-细胞距离,这种效应可能不是渗透整个悬浮细胞数量的最有效效果。相比之下,空化微流是一种在缓慢的时间尺度上发生的现象,与气泡半径相比,空间膨胀很大。此外,液体流动分布在气泡周围,因此可能会在很远的范围内影响更多的细胞。因此,了解振荡气泡周围产生的空化微流是控制和量化施加到细胞的气泡诱导剪切应力的先决条件。
为此,初步步骤包括控制超声波驱动气泡的球形和非球形振荡,因为产生的液体流动是由气泡界面15,16的运动引起的。特别是,必须触发微气泡的形状振荡并保持稳定。此外,必须控制气泡形状振荡的方向,以正确分析气泡界面动力学与诱导微流模式之间的相关性。在总结现有文献时,很明显,空化诱导微流的详细实验结果仅适用于附着在表面上的气泡。壁挂式微气泡通常用于在超快显微镜系统下评估微米级的精确界面动力学和细胞相互作用。当考虑位于细胞膜上的振动微泡时,这种配置具有治疗相关性17,18,19。然而,对基板附着气泡的研究可能会使气泡动力学的分析更加复杂,部分原因是接触线动力学20的复杂性,以及不对称形状模式21的触发。在医疗和生物应用中,未附着在壁上的气泡通常存在于受限几何形状中,例如小容器。这显著影响气泡动力学和形状不稳定性。特别是,附近壁的存在将形状模式触发的压力阈值转移到较低的压力值,具体取决于形状模式数和气泡大小22。壁还影响气泡诱导的微流,对于产生的流动23,其强度可能更高。
在微气泡可能经历的所有可能情况(自由或附着,靠近墙壁,坍塌或稳定振荡)中,我们建议研究远离任何边界的单个气泡的非球形动力学。实验设置基于声学悬浮系统24,其中使用驻留超声波来捕获气泡。这种情况与医疗应用一致,例如,在超声转染室中,一组悬浮气泡和细胞共存。只要气泡和细胞不太接近,假设细胞的存在不会影响气泡界面动力学。当细胞遵循空化诱导的微流的环状轨迹时,它们周期性地接近并从气泡位置排斥,我们可以假设细胞的存在既不影响流动模式,也不会影响其平均速度。此外,从理论角度来看,非球形动力学和来自远离边界的单个气泡的诱导微流是众所周知的。为了将气泡诱导的液体流动与气泡轮廓动力学联系起来,需要准确表征气泡界面动力学。为此,最好在实验研究中调整与治疗中使用的时空尺度,以便通过使用以较低频率激发的大气泡来使用普通高速相机(低于100万帧/秒)进行采集。当考虑未涂层的气泡时,给定模式n的特征频率ωn与气泡大小相关,为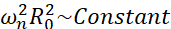 25。当考虑带壳气泡26时,这种半径-特征频率关系略有修改,但特征频率ωn的数量级保持不变。因此,在30kHz超声场中研究平衡半径~50μm的气泡类似于研究1.7 MHz场中半径~3μm的涂层气泡,正如Dollet等人提出的27。因此,预计会出现相似的形状模式编号和微流模式。
25。当考虑带壳气泡26时,这种半径-特征频率关系略有修改,但特征频率ωn的数量级保持不变。因此,在30kHz超声场中研究平衡半径~50μm的气泡类似于研究1.7 MHz场中半径~3μm的涂层气泡,正如Dollet等人提出的27。因此,预计会出现相似的形状模式编号和微流模式。
为了触发气泡界面的非球形振荡,必须超过与半径相关的特定压力阈值,如图 1所示。现有的实验技术依赖于声压的增加来触发表面模式(如图1中的路径( 1)所示),要么通过逐步增加压力28 或通过负责表面模式29周期性开始和消退的调制幅度激励。这些技术的主要缺点是(i)表面振荡对称轴的随机取向,无法控制在成像平面中,(ii)气泡形状振荡的寿命短,使得在更大的时间尺度上难以分析感应液体流动,以及(iii)频繁触发不稳定的形状模式。我们提出了一种替代技术,可以在半径/压力图中以恒定的声压跨越压力阈值,如图 1中的路径(2)所示。为此,需要增加气泡尺寸,使其处于不稳定区域。这种增加是通过气泡聚结技术进行的。利用两个最初是球形振荡的微气泡的聚结来产生一个变形的气泡。如果聚结气泡的声压和气泡尺寸处于不稳定区,则会触发表面模式。我们还证明,聚结技术在稳态状态下诱导稳定的形状振荡,以及由两个接近的气泡的直线运动定义的受控对称轴。由于在几分钟内确保稳定的形状振荡,因此可以通过在液体介质中注入荧光微粒来分析气泡引起的流体流动,并由薄激光片照射。记录固体微粒在气泡界面附近的运动允许识别诱导流体流动的模式30。触发气泡形状振荡的总体原理,导致时间稳定的流体流动,如图 2所示。
在下面的协议中,我们概述了通过聚结技术创建稳定的气泡形状振荡所需的步骤,并描述了流体流动的测量。这包括声学悬浮系统的设计、声学校准、气泡成核和聚结技术、气泡界面动力学和周围流体流动的测量以及图像处理。
Protocol
Representative Results
Discussion
所提出的程序包括使用气泡聚结来触发稳态,对称控制的气泡形状振荡,从而可以研究由这些振荡引起的长期流体流动。该技术的主要挑战是控制气泡被捕获的非球形振荡,远离任何边界。
文献中提出的大多数现有技术都集中在基板附着的气泡7,16上,因为气泡中心的无运动使得在声学时间尺度(高达数百kHz)下捕获其界面变得更…
Divulgations
The authors have nothing to disclose.
Acknowledgements
这项工作得到了里昂大学LabEx CeLyA(ANR-10-LABX-0060 / ANR-11-IDEX-0007)的支持。
Materials
| Aspherical lens | Thorlabs | AL4050 | Lens of focus 40 mm |
| Continuous wave laser source | CNI | MLL6FN | DPSS laser of wavelength 532nm, energy 400 mW |
| Cylindrical plano-concave lens | Thorlabs | LJ1277L1-A | lens of focus -25?4mm |
| Cylindrical plano-concave lens | Thorlabs | LK1900L1 | lens of focus 250 mm |
| Fluorescent particles | Duke Scientific | R700 | Red polymer fluorescent microspheres |
| Function generator | Agilent | HP33120 | Generator of function feeding the ultrasound transducer |
| High-speed camera | Vision Research | Phantom v12.0 | High-speed recording up to 1 Mfps |
| Liquid medium | Carlo Erba | Water for analysis | Demineralized, undegassed water |
| Multiphysics software | Comsol | None | Softwate for simulating the acoustic field of the levitation chamber |
| Nd:Yag pulsed laser | New Wave Research | Solo III-15 | 5 ns pulse duration, λ=532 nm, 3.5 mm beam diameter, up to 50 mJ |
| Plano-concave lens | Thorlabs | N-BK7 | lens of focus 125 mm |
| Spherical concave lens | Thorlabs | N-SF11 | Bi-concave lens of focus -25mm |
| Ultrasound transducer | SinapTec | Custom-made | Nominal frequency 31kHz, active area 35mm diameter |
| Visualization software | NIH | ImageJ | Software for image processing and analysis in Java |
| XY Linear stage | Newport | M-406 | Displacement stage with micrometric screw |
| Z-axis linear stage | Edmund Optics | 62-299 | Vertical displacement stage with micrometric screw |
References
- Roovers, S., et al. The role of ultrasound-driven microbubble dynamics in drug delivery: from microbubble fundamentals to clinical translation. Langmuir. 35 (31), 10173-10191 (2019).
- Liu, H. L., Fan, C. H., Ting, C. Y., Yeh, C. K. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview. Theranostics. 4 (4), 432-444 (2014).
- Lammertink, B. H. A., et al. Sonochemotherapy: from bench to bedside. Frontiers in Pharmacology. 6, 138 (2015).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: fundamentals and therapeutic applications. Biomicrofluidics. 10, 011501 (2016).
- Van Wamel, A., Bouakaz, A., Versluis, M., de Jong, N. Micromanipulation of endothelial cells: ultrasound-microbubble-cell interaction. Ultrasound in Medicine and Biology. 30, 1255-1258 (2004).
- Tran, T. A., Roger, S., Le Guennec, J. Y., Tranquart, F., Bouakaz, A. Effect of ultrasound-activated microbubbles on the cell electrophysiological properties. Ultrasound in Medicine and Biology. 33, 158-163 (2007).
- Marmottant, P., Hilgenfeldt, S. Controlled vesicle deformation and lysis by single oscillating bubbles. Nature. 423 (6936), 153-156 (2003).
- Prentice, P. A., Cuschieri, K., Dholakia, K., Prausnitz, M., Campbell, P. Membrane disruption by optically controlled microbubble cavitation. Nature Physics. 1, 107-110 (2005).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophysical Journal. 96, 4866-4876 (2009).
- Novell, A., et al. A new safety index based on intrapulse monitoring of ultra-harmonic cavitation during ultrasound-induced blood-brain barrier opening procedures. Scientific Reports. 10, 10088 (2020).
- Cornu, C., et al. Ultrafast monitoring and control of subharmonic emissions of an unseeded bubble cloud during pulsed sonication. Ultrasonics Sonochemistry. 42, 697-703 (2018).
- Reslan, L., Mestas, J. L., Herveau, S., Béra, J. C., Dumontet, C. Transfection of cells in suspension by ultrasound cavitation. Journal of Controlled Release. 142 (2), 251-258 (2010).
- Reuter, F., Gonzalez-Avila, S. R., Mettin, R., Ohl, C. D. Flow fields and vortex dynamics of bubbles collapsing near a solid boundary. Physical Review Fluids. 2, 064202 (2017).
- Chew, L. W., Klaseboer, E., Ohl, S. W., Khoo, B. C. Interaction of two differently sized oscillating bubbles in a free field. Physical Review E. 84, 066307 (2011).
- Doinikov, A. A., Bouakaz, A. Acoustic microstreaming around a gas bubble. The Journal of the Acoustical Society of America. 127 (2), 703-709 (2010).
- Tho, P., Manasseh, R., Ooi, A. Cavitation microstreaming patterns in single and multiple bubble systems. Journal of Fluid Mechanics. 576, 191-233 (2007).
- Van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. Journal of Controlled Release. 112, 149-155 (2006).
- Helfield, B., Chen, X., Watkins, S. C., Villanueva, F. S. Biophysical insight into mechanisms of sonoporation. PNAS. 113 (36), 9983-9988 (2016).
- Pereno, V., et al. Layered acoustofluidic resonators for the simultaneous optical and acoustic characterization of cavitation dynamics, microstreaming, and biological effects. Biomicrofluidics. 12, 034109 (2018).
- Shklyaev, S., Straube, A. V. Linear oscillations of a compressible hemispherical bubble on a solid substrate. Physics of Fluids. 20, 052102 (2008).
- Fauconnier, M., Bera, J. C., Inserra, C. Nonspherical modes non-degeneracy of a tethered bubble. Physical Review E. 102, 033108 (2020).
- Xi, X., Cegla, F., Mettin, R., Holsteyns, F., Lippert, A. Study of non-spherical bubble oscillations near a surface in a weak acoustic standing wave field. The Journal of the Acoustical Society of America. 135, 1731 (2014).
- Doinikov, A. A., Bouakaz, A. Effect of a distant rigid wall on microstreaming generated by an acoustically driven gas bubble. Journal of Fluid Mechanics. 742, 425-445 (2014).
- Cleve, S., Guédra, M., Inserra, C., Mauger, C., Blanc-Benon, P. Surface modes with controlled axisymmetry triggered by bubble coalescence in a high-amplitude acoustic field. Physical Review E. 98, 033115 (2018).
- Lamb, H. . Hydrodynamics. 6th ed. , (1932).
- Liu, Y., Wang, Q. Stability and natural frequency of nonspherical mode of an encapsulated microbubble in a viscous liquid. Physics of Fluids. 28, 062102 (2016).
- Dollet, B., et al. Nonspherical oscillations of ultrasound contrast agent microbubbles. Ultrasound in Medicine and Biology. 34 (9), 1465-1473 (2008).
- Versluis, M., et al. Microbubble shape oscillations excited through ultrasonic parametric driving. Physical Review E. 82, 026321 (2010).
- Guédra, M., Cleve, S., Mauger, C., Blanc-Benon, P., Inserra, C. Dynamics of nonspherical microbubble oscillations above instability threshold. Physical Review E. 96, 063104 (2017).
- Cleve, S., Guédra, M., Mauger, C., Inserra, C., Blanc-Benon, P. Microstreaming induced by acoustically trapped, non-spherically oscillating microbubbles. Journal of Fluid Mechanics. 875, 597-621 (2019).
- Doinikov, A. A., Cleve, S., Regnault, G., Mauger, C., Inserra, C. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. I. Case of modes 0 and m. Physical Review E. 100, 033104 (2019).
- Inserra, C., Regnault, G., Cleve, S., Mauger, C., Doinikov, A. A. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. III. Case of self-interacting modes n-n. Physical Review E. 101, 013111 (2020).
- Prabowo, F., Ohl, C. D. Surface oscillations and jetting from surface attached acoustic driven bubbles. Ultrasonics Sonochemistry. 18 (1), 431-435 (2011).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined; optical micromanipulation and high-speed imaging. Applied Physics Letters. 90, 114103 (2007).
- Collis, J., et al. Cavitation microstreaming and stress fields created by microbubbles. Ultrasonics. 50, 273-279 (2010).
- Loughran, J., Eckersley, R. J., Tang, M. X. Modeling non-spherical oscillations and stability of acoustically driven shelled microbubbles. The Journal of the Acoustical Society of America. 131 (6), 4349-4357 (2012).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall – a pilot study at low mechanical index. Ultrasound in Medicine and Biology. 34 (4), 685-688 (2008).
- Regnault, G., Mauger, C., Blanc-Benon, P., Inserra, C. Secondary radiation force between two closely spaced acoustic bubbles. Physical Review E. 102, 031101 (2020).

