Ein proinflammatorisches, degeneratives Organkulturmodell zur Simulation einer Bandscheibenerkrankung im Frühstadium.
Summary
Dieses Protokoll stellt ein neuartiges experimentelles Modell der proinflammatorischen, degenerativen Rinderorgankultur vor, um die Bandscheibendegeneration im Frühstadium zu simulieren.
Abstract
Die symptomatische Bandscheibendegeneration (IDD) ist eine große sozioökonomische Belastung und durch Entzündungen und Gewebeabbau gekennzeichnet. Aufgrund des Mangels an ursächlichen Therapien besteht ein dringender Bedarf an innovativen experimentellen Organkulturmodellen, um die Mechanismen des Fortschreitens der Krankheit zu untersuchen, therapeutische Ziele zu finden und den Bedarf an Tiermodellen zu reduzieren. Wir präsentieren hier ein neuartiges, dreidimensionales Organkulturmodellprotokoll, das die proinflammatorische und katabole Mikroumgebung nachahmt, die während der IDD vorhanden ist.
Zunächst wurden bovine Kaud-IVDs im Gewebekulturmedium seziert, gereinigt und kultiviert. Dynamische physiologische oder pathologische Belastung wurde in einem maßgeschneiderten Bioreaktor für 2 Stunden pro Tag angewendet. IVDs wurden vier Tage lang einer Kontrollgruppe (hohes Glukosemedium, physiologische Belastung, phosphatgepufferte Kochsalzinjektion) und einer pathologischen Gruppe (niedriges Glukosemedium, pathologische Belastung, Tumornekrosefaktor-Alpha-Injektion) zugeordnet. Es wurde eine Genexpressionsanalyse aus gesammelten Nucleus pulposus-Zellen der IVDs und ein enzymgebundener Immunsorbent-Assay der konditionierten Organkulturmedien durchgeführt.
Unsere Daten zeigten eine höhere Expression von Entzündungsmarkern und reduzierte Bandscheibenhöhen nach belastung in der pathologischen Gruppe im Vergleich zur Kontrollgruppe. Dieses Protokoll ist zuverlässig, um IVD-Entzündungen und -Degenerationen zu simulieren und kann weiter erweitert werden, um seinen Anwendungsbereich zu erweitern.
Introduction
Rückenschmerzen (LBP) können Menschen jeden Alters betreffen und sind weltweit eine der Hauptursachen fürBehinderungen 1,2,3. Die gesamtkosten im Zusammenhang mit LBP übersteigen 100 Milliarden US$Dollar pro Jahr4,5. Symptomatische Bandscheibendegeneration (IVD) (IDD), eine Erkrankung, die durch Entzündungen und Gewebeabbau gekennzeichnet ist, ist eine Hauptursache für LBP6,7. Insbesondere ist IDD durch einen sich allmählich entwickelnden Zusammenbruch der extrazellulären Matrix (ECM) der IVD gekennzeichnet, der durch mehrere Faktoren induziert und ausgelöst wird, die zu einer beschleunigten Pathologie, neurologischen Störungen und schließlich zu einer Behinderung führen. Darüber hinaus ist IDD mit der Freisetzung von proinflammatorischen Zytokinen, veränderter Wirbelsäulenbiomechanik, Angiogenese und Nerveningrowth verbunden, was das Schmerzempfinden erhöht und insgesamt chronische LBP (aktive Diskopathie) verursacht6,8. Bisher umfassen die Behandlungsmöglichkeiten die Diskektomie und die anschließende Fusion der benachbarten Wirbel, die Implantation einer IVD-Prothese oder nicht-chirurgische Ansätze wie nichtsteroidale entzündungshemmende Medikamente, Opioide und Muskelrelaxantien für Patienten mit IDD9. Beide derzeitigen Standardtherapieoptionen, chirurgische und nicht-chirurgische, sind nur teilweise wirksam und gehen nicht auf das zugrunde liegende biologische Problem ein9,10. Eine degenerative Bandscheibenerkrankung im Frühstadium ist durch eine anfängliche entzündliche Gewebereaktion gekennzeichnet, insbesondere durch eine Zunahme der Tumornekrosefaktor-alpha -Expression (TNF-alpha)11. Diese frühen Bandscheibenveränderungen treten hauptsächlich auf zellulärer Ebene auf, ohne die Bandscheibenarchitektur zu stören und konnten zuvor durch Nährstoffmangel unter entzündungsfördernden Zuständen nachgeahmt werden12. Daher ist eine präzise Simulation der In-vivo-Situation entscheidend, um diese Degenerationsmechanismen zu untersuchen und geeignete therapeutische Ziele zu finden. Zusätzlich zu diesen Simulationen molekularer Eigenschaften spielt die mechanische Belastungsumgebung der Scheiben eine Schlüsselrolle bei pathologischen und physiologischen Veränderungen der IVD. Folglich würde uns die Kombination dieser Ansätze einen Schritt nach vorne bringen, um die komplexe Mikroumgebung von IVDs in vivo nachzuahmen. Es gibt derzeit keine Studien, die den Aspekt der dynamischen Belastung zusammen mit dem entzündungsfördernden und ernährungsphysiologischen Setting nach bestem Wissen und Gewissen berücksichtigen.
Große Tiermodelle erlauben zwar die Untersuchung potentiell relevanter in vivo Wechselwirkungen, sind aber kostspielig und arbeitsintensiv. Da der Einsatz von Tiermodellen in der Forschung seit langem umstritten ist, ist die Reduzierung der Anzahl der Tiere, die zur Beantwortung wichtiger Forschungsfragen benötigt werden, von großem Interesse. Schließlich gibt es derzeit kein ideales Tiermodell, um IDD in der IVD-Forschung nachzuahmen13,14. Daher ist es notwendig, einen kostengünstigen und zuverlässigen Ersatz zu etablieren, z. B. ein Organkulturmodell, um IDD und damit verbundene entzündliche und degenerative Prozesse zu simulieren. Vor kurzem ermöglichte uns die Anwendung des vorliegenden Protokolls zur Etablierung eines proinflammatorischen und degenerativen Organkulturmodells zur Simulation von Bandscheibenerkrankungen im Frühstadium, die Wirkung entzündungshemmender Medikamente in der IDD-Organkultur zu untersuchen15.
Hier beschreiben wir, wie man Bovin-Bandscheiben erhält und den Zustand der IDD im Frühstadium über eine katabole und proinflammatorische Mikroumgebung induziert, die durch direkte intradiskale Injektion von Tumornekrosefaktor-alpha (TNF-α) und degenerative Belastung in einem Bioreaktor unter niedrigen Nährmediumbedingungen verursacht wird. Abbildung 1 veranschaulicht das experimentelle Modell und zeigt den Bioreaktor, mit dem degenerative und physiologische Belastungsbedingungen simuliert werden.
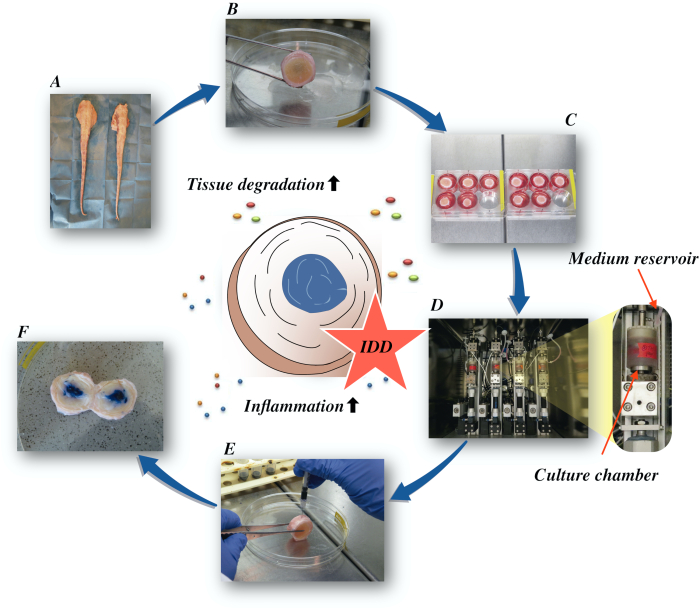
Abbildung 1: Abbildung des Versuchsaufbaus. A: Rinderschwanz; B: sezierte Bandscheiben von Rindern; C: Übertragung der Scheibe auf eine Well-Platte mit Kulturmedium; D: Laden der Simulation in einen Bioreaktor; E: intradiskale Injektionstechnik; F: IVD nach Injektion von PBS/Trypanblaufarbstoff, um die Verteilung aufzudecken. IDD: Bandscheibendegeneration. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Wir haben hier ein detailliertes Protokoll zur Simulation degenerativer und entzündlicher IVDD zur Verfügung gestellt. Dieses Protokoll kann für detaillierte Untersuchungen von Entzündungswegen angewendet werden, die zu den zerstörerischen Auswirkungen auf die Bandscheibe führen. Darüber hinaus kann das Protokoll helfen, vielversprechende therapeutische Ziele zu bestimmen, die am Fortschreiten der Krankheit beteiligt sind.
Wir haben kürzlich gezeigt, dass humane rekombinante TNF-α Ent…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde von der AO Foundation und AOSpine International unterstützt. Babak Saravi erhielt Fellowship-Unterstützung von der Deutschen Wirbelsäulenstiftung und der Deutschen Arthrose-Stiftung. Gernot Lang wurde unterstützt durch das Berta-Ottenstein-Programm für Advanced Clinician Scientists, Medizinische Fakultät, Universität Freiburg, Deutschland.
Materials
| 1-Bromo-3-chloropropane(BCP) | Sigma-Aldrich, St. Louis, USA | B9673 | |
| Ascorbate-2-phosphate | Sigma-Aldrich, St. Louis, USA | A8960 | |
| Band saw | Exakt Apparatebau, Norderstedt, Germany | model 30/833 | |
| Betadine | Munndipharma, Frankfurt, Germany | ||
| Bovine IL-8 Do.it-Yourself ELISA | Kingfisher Biotech, St. Paul, USA | DIY1028B-003 | |
| Corning ITS Premix | Corning Inc., New York, USA | 354350 | |
| DMEM high glucose | Gibco by life technologies, Carlsbad, USA | 10741574 | |
| DMEM low glucose | Gibco by life technologies, Carlsbad, USA | 11564446 | |
| Ethanol for molecular biology | Sigma-Aldrich, St. Louis, USA | 09-0851 | |
| Fetal Bovine Serum (FBS) | Gibco by life technologies, Carlsbad, USA | A4766801 | |
| Non-essential amino acid solution | Gibco by life technologies, Carlsbad, USA | 11140050 | |
| Penicillin/Streptomycin(P/S) | gibco by life technologies, Carlsbad, USA | 11548876 | |
| Phosphate Buffer Solution, tablet | Sigma-Aldrich, St. Louis, USA | P4417 | |
| Pronase | Sigma-Aldrich, St. Louis, USA | 10165921001 | |
| Primocin | InvivoGen, Sandiego, USA | ant-pm-05 | |
| Pulsavac Jet Lavage System | Zimmer, IN,USA | ||
| TissueLyser II | Quiagen, Venlo, Netherlands | 85300 | |
| Streptavidinn-HRP | Kingfisher Biotech, St. Paul, USA | AR0068-001 | |
| Superscript VILO | Invitrogen by life Technologies, Carlsbad, USA | 10704274 | |
| cDNA Synthesis Kit | Applied Biosystems by life technologies | 10400745 | |
| TaqMan Universal Master Mix | Applied Biosystems by life technologies | ||
| TNF-alpha, recombinant human protein | R&D systems, Minnesota, USA | 210-TA-005 | |
| TRI Reagent | Molecular Research Center, Cincinnati, USA | TR 118 | |
| Tris-EDTA buffer solution | sigma-Aldrich, St. Louis, USA | 93283 | |
| Gene bIL-6 | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTC CAA AAA TGG AGG AAA AGG A Primer rev (5′–3′) TCC AGA AGA CCA GCA GTG GTT Probe (5′FAM/3′TAMRA) CTT CCA ATC TGG GTT CAA TCA GGC GATT |
| Gene bIL8 | Applied Biosystems by life technologies | Bt03211906_m1 | |
| Gene bTNF-alpha | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) CCT CTT CTC AAG CCT CAA GTA ACA A Primer rev (5′–3′) GAG CTG CCC CGG AGA GTT Probe (5′FAM/3′TAMRA) ATG TCG GCT ACA ACG TGG GCT ACC G |
| GENE bIL1beta | Applied Biosystems by life technologies | Custom made probes | Primer fw (5′–3′) TTA CTA CAG TGA CGA GAA TGA GCT GTT Primer rev (5′–3′) GGT CCA GGT GTT GGA TGC A Probe (5′FAM/3′TAMRA) CTC TTC ATC TGT TTA GGG TCA TCA GCC TCA A |
| RPLP0 | Applied Biosystems by life technologies | Bt03218086_m1 |
References
- Vos, T., et al. Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 390 (10100), 1211-1259 (2017).
- Hoy, D., et al. Measuring the global burden of low back pain. Best Practice & Research Clinical Rheumatology. 24 (2), 155-165 (2010).
- Thiese, M. S., et al. Prevalence of low back pain by anatomic location and intensity in an occupational population. BMC Musculoskeletal Disorders. 15 (1), 283 (2014).
- Katz, J. N. Lumbar Disc Disorders and Low-Back Pain: Socioeconomic Factors and Consequences. The Journal of Bone and Joint Surgery (American). 88, 21 (2006).
- Vlaeyen, J. W. S., et al. Low back pain. Nature Reviews Disease Primers. 4 (1), 52 (2018).
- Khan, A. N., et al. Inflammatory biomarkers of low back pain and disc degeneration: a review: Biomarkers of disc degeneration and back pain. Annals of the New York Academy of Sciences. 1410 (1), 68-84 (2017).
- Kim, H. S., Wu, P. H., Jang, I. T. Lumbar Degenerative Disease Part 1: Anatomy and Pathophysiology of Intervertebral Discogenic Pain and Radiofrequency Ablation of Basivertebral and Sinuvertebral Nerve Treatment for Chronic Discogenic Back Pain: A Prospective Case Series and Review of Literature. International Journal of Molecular Sciences. 21 (4), 1483 (2020).
- Adams, M. A., Roughley, P. J. What is Intervertebral Disc Degeneration, and What Causes It. Spine. 31 (18), 2151-2161 (2006).
- Wu, P. H., Kim, H. S., Jang, I. T. Intervertebral Disc Diseases Part 2: A Review of the Current Diagnostic and Treatment Strategies for Intervertebral Disc Disease. International Journal of Molecular Sciences. 21 (6), 2135 (2020).
- Lurie, J. D., et al. Surgical Versus Nonoperative Treatment for Lumbar Disc Herniation: Eight-Year Results for the Spine Patient Outcomes Research Trial. Spine. 39 (1), 3-16 (2014).
- Risbud, M. V., Shapiro, I. M. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nature Reviews Rheumatology. 10 (1), 44-56 (2014).
- Ponnappan, R. K., et al. An organ culture system to model early degenerative changes of the intervertebral disc. Arthritis Research & Therapy. 13 (5), 171 (2011).
- O’Connell, G. D., Vresilovic, E. J., Elliott, D. M. Comparison of Animals Used in Disc Research to Human Lumbar Disc Geometry. Spine. 32 (3), 328-333 (2007).
- Stannard, J. T., et al. Development of a whole organ culture model for intervertebral disc disease. Journal of Orthopaedic Translation. 5, 1-8 (2016).
- Li, Z., et al. Preclinical ex-vivo Testing of Anti-inflammatory Drugs in a Bovine Intervertebral Degenerative Disc Model. Frontiers in Bioengineering and Biotechnology. 8, 583 (2020).
- Li, Z., et al. Development of an ex vivo cavity model to study repair strategies in loaded intervertebral discs. European Spine Journal. 25 (9), 2898-2908 (2016).
- Kazezian, Z., Li, Z., Alini, M., Grad, S., Pandit, A. Injectable hyaluronic acid down-regulates interferon signaling molecules, IGFBP3 and IFIT3 in the bovine intervertebral disc. Acta Biomaterialia. 52, 118-129 (2017).
- Caprez, S., Menzel, U., Li, Z., Grad, S., Alini, M., Peroglio, M. Isolation of high-quality RNA from intervertebral disc tissue via pronase predigestion and tissue pulverization. JOR Spine. 1 (2), 1017 (2018).
- Lopa, S., Ceriani, C., Cecchinato, R., Zagra, L., Moretti, M., Colombini, A. Stability of housekeeping genes in human intervertebral disc, endplate and articular cartilage cells in multiple conditions for reliable transcriptional analysis. European Cells & Materials. 31, 395-406 (2016).
- Lang, G., et al. An intervertebral disc whole organ culture system to investigate proinflammatory and degenerative disc disease condition. Journal of Tissue Engineering and Regenerative Medicine. 12 (4), 2051-2061 (2018).
- Du, J., et al. Proinflammatory intervertebral disc cell and organ culture models induced by tumor necrosis factor alpha. JOR Spine. 3, 1104 (2020).
- Purmessur, D., Walter, B. A., Roughley, P. J., Laudier, D. M., Hecht, A. C., Iatridis, J. A role for TNFα in intervertebral disc degeneration: A non-recoverable catabolic shift. Biochemical and Biophysical Research Communications. 433 (1), 151-156 (2013).
- Walter, B. A., Likhitpanichkul, M., Illien-Junger, S., Roughley, P. J., Hecht, A. C., Iatridis, J. C. TNFα Transport Induced by Dynamic Loading Alters Biomechanics of Intact Intervertebral Discs. PLOS One. 10 (3), 0118358 (2015).
- Gullbrand, S. E., et al. A large animal model that recapitulates the spectrum of human intervertebral disc degeneration. Osteoarthritis and Cartilage. 25 (1), 146-156 (2017).
- Willems, N., et al. Safety of intradiscal injection and biocompatibility of polyester amide microspheres in a canine model predisposed to intervertebral disc degeneration: intradiscal application of pea microspheres. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 105 (4), 707-714 (2017).
- Michalek, A. J., Buckley, M. R., Bonassar, L. J., Cohen, I., Iatridis, J. C. The effects of needle puncture injury on microscale shear strain in the intervertebral disc annulus fibrosus. The Spine Journal. 10 (12), 1098-1105 (2010).
- Illien-Jünger, S., et al. The combined effects of limited nutrition and high-frequency loading on intervertebral discs with endplates. Spine. 35 (19), 1744-1752 (2010).
- Gantenbein, B., et al. Organ culture bioreactors–platforms to study human intervertebral disc degeneration and regenerative therapy. Current Stem Cell Research & Therapy. 10 (4), 339-352 (2015).
- Boubriak, O. A., Watson, N., Sivan, S. S., Stubbens, N., Urban, J. P. G. Factors regulating viable cell density in the intervertebral disc: blood supply in relation to disc height. Journal of Anatomy. 222 (3), 341-348 (2013).
- Maroudas, A., Stockwell, R. A., Nachemson, A., Urban, J. Factors involved in the nutrition of the human lumbar intervertebral disc: cellularity and diffusion of glucose in vitro. Journal of Anatomy. 120, 113-130 (1975).
- Beckstein, J. C., Sen, S., Schaer, T. P., Vresilovic, E. J., Elliott, D. M. Comparison of Animal Discs Used in Disc Research to Human Lumbar Disc: Axial Compression Mechanics and Glycosaminoglycan Content. Spine. 33 (6), 166-173 (2008).
- Walter, B. A., Illien-Jünger, S., Nasser, P. R., Hecht, A. C., Iatridis, J. C. Development and validation of a bioreactor system for dynamic loading and mechanical characterization of whole human intervertebral discs in organ culture. Journal of Biomechanics. 47 (9), 2095-2101 (2014).
- Rajan, N. E., et al. Toll-Like Receptor 4 (TLR4) Expression and Stimulation in a Model of Intervertebral Disc Inflammation and Degeneration. Spine. 38 (16), 1343-1351 (2013).
- vanden Akker, G. G., Rorije, A. J., Davidson, E. N. B., vander Kraan, P. M. Phenotypic marker genes distinguish inner and outer annulus fibrosus from nucleus pulposus tissue in the bovine intervertebral disc. Osteoarthritis and Cartilage. 25, 402 (2017).
- Du, J., et al. Functional cell phenotype induction with TGF-β1 and collagen-polyurethane scaffold for annulus fibrosus rupture repair. European Cells & Materials. 39, 1-17 (2020).
- Risbud, M. V., et al. Defining the phenotype of young healthy nucleus pulposus cells: recommendations of the Spine Research Interest Group at the 2014 annual ORS meeting. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 33 (3), 283-293 (2015).

