Utilizzo di dispositivi di assistenza ventricolare percutanea nell'infarto miocardico acuto complicato da shock cardiogeno
Summary
I dispositivi di assistenza ventricolare percutanea sono sempre più utilizzati nei pazienti con infarto miocardico acuto e shock cardiogeno. Qui, discutiamo il meccanismo d’azione e gli effetti emodinamici di tali dispositivi. Esaminiamo anche algoritmi e best practice per l’impianto, la gestione e lo svezzamento di questi dispositivi complessi.
Abstract
Lo shock cardiogeno è definito come ipotensione persistente, accompagnata da evidenza di ipoperfusione dell’organo terminale. I dispositivi di assistenza ventricolare percutanea (PVAD) sono utilizzati per il trattamento dello shock cardiogeno nel tentativo di migliorare l’emodinamica. Impella è attualmente il PVAD più comune e pompa attivamente il sangue dal ventricolo sinistro nell’aorta. I PVAD scaricano il ventricolo sinistro, aumentano la gittata cardiaca e migliorano la perfusione coronarica. I PVAD sono tipicamente collocati nel laboratorio di cateterizzazione cardiaca sotto guida fluoroscopica attraverso l’arteria femorale quando possibile. In caso di grave arteriopatia periferica, i PVAD possono essere impiantati attraverso un accesso alternativo. In questo articolo, riassumiamo il meccanismo d’azione del PVAD e i dati a supporto del loro uso nel trattamento dello shock cardiogeno.
Introduction
Lo shock cardiogeno (CS) è definito come ipotensione persistente (pressione arteriosa sistolica 30 minuti, o necessità di vasopressori o inotropi), ipoperfusione dell’organo terminale (produzione di urina 2 mmol/L), congestione polmonare (pressione del cuneo capillare polmonare (PCWP) ≥ 15 mmHg) e diminuzione delle prestazioni cardiache (indice cardiaco <2,2) 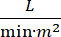 1, 2 a causa di un disturbo cardiaco primario. L’infarto miocardico acuto (AMI) è la causa più comune di CS3. La CS si verifica nel 5-10% delle AMI e storicamente è stata associata a una significativa mortalità3,4. I dispositivi di supporto circolatorio meccanico (MCS) come la pompa a palloncino intra-aortica (IABP), i dispositivi di assistenza ventricolare percutanea (PVAD), l’ossigenazione extracorporea a membrana (ECMO) e i dispositivi percutanei da atriali aortici sinistri sono frequentemente utilizzati nei pazienti con CS5. L’uso di routine di IABP non ha dimostrato alcun miglioramento negli esiti clinici o nella sopravvivenza in AMI-CS1. Dati gli scarsi risultati associati all’AMI-CS, le difficoltà nel condurre studi in AMI-CS e i risultati negativi dell’uso di IABP in AMI-CS, i medici guardano sempre più ad altre forme di MCS.
1, 2 a causa di un disturbo cardiaco primario. L’infarto miocardico acuto (AMI) è la causa più comune di CS3. La CS si verifica nel 5-10% delle AMI e storicamente è stata associata a una significativa mortalità3,4. I dispositivi di supporto circolatorio meccanico (MCS) come la pompa a palloncino intra-aortica (IABP), i dispositivi di assistenza ventricolare percutanea (PVAD), l’ossigenazione extracorporea a membrana (ECMO) e i dispositivi percutanei da atriali aortici sinistri sono frequentemente utilizzati nei pazienti con CS5. L’uso di routine di IABP non ha dimostrato alcun miglioramento negli esiti clinici o nella sopravvivenza in AMI-CS1. Dati gli scarsi risultati associati all’AMI-CS, le difficoltà nel condurre studi in AMI-CS e i risultati negativi dell’uso di IABP in AMI-CS, i medici guardano sempre più ad altre forme di MCS.
I PVAD sono sempre più utilizzati nei pazienti con AMI-CS6. In questo articolo, concentreremo la nostra discussione principalmente sull’Impella CP, che è il PVAD più comune attualmente utilizzato6. Questo dispositivo utilizza una pompa a vite archimede a flusso assiale che spinge attivamente e continuamente il sangue dal ventricolo sinistro (LV) nell’aorta ascendente (Figura 1). Il dispositivo viene posizionato più frequentemente nel laboratorio di cateterizzazione cardiaca sotto guida fluoroscopica attraverso l’arteria femorale. In alternativa, può essere impiantato attraverso un accesso ascellare o transcavale quando necessario7,8.
Protocol
Representative Results
Discussion
Ridurre al minimo i rischi e le complicanze del PVAD (Tabella 2)
I benefici emodinamici della PVAD possono essere significativamente neutralizzati se si verificano complicazioni da accesso di grandi dimensioni, come sanguinamento maggiore e ischemia acuta degli arti28,29. È quindi essenziale ridurre al minimo il rischio e le complicazioni del dispositivo.
Al fine di ridurre le complicanze del sito di accesso e ridu…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Nessuno
Materials
| 4 Fr-018-10 cm Silhouette Stiffened Micropuncture Set | Cook | G48002 | Microvascular access |
| 5 Fr Infiniti Pigtail Catheter | Cordis | 524-550S | pigtail catheter |
| Impella CP Intra-cardiac Assist Catheter | ABIOMED | 0048-0003 | Impella catheter kit |
References
- Holger, T., et al. Intraaortic Balloon Pump in Cardiogenic Shock Complicating Acute Myocardial Infarction. Circulation. 139 (3), 395-403 (2019).
- Hochman, J. S., et al. Early Revascularization in Acute Myocardial Infarction Complicated by Cardiogenic Shock. New England Journal of Medicine. 341 (9), 625-634 (1999).
- van Diepen, S., et al. Contemporary Management of Cardiogenic Shock: A Scientific Statement From the American Heart Association. Circulation. 136 (16), 232-268 (2017).
- Kolte, D. h. a. v. a. l., et al. Trends in Incidence, Management, and Outcomes of Cardiogenic Shock Complicating ST-Elevation Myocardial Infarction in the United States. Journal of the American Heart Association. 3 (1), 000590 (2014).
- Aditya, M., Sunil, R. V. Percutaneous Mechanical Circulatory Support Devices in Cardiogenic Shock. Circulation: Cardiovascular Interventions. 10 (5), 004337 (2017).
- Amit, A. P., et al. The Evolving Landscape of Impella Use in the United States Among Patients Undergoing Percutaneous Coronary Intervention With Mechanical Circulatory Support. Circulation. 141 (4), 273-284 (2020).
- Kajy, M., et al. Deploying Mechanical Circulatory Support Via the Axillary Artery in Cardiogenic Shock and High-Risk Percutaneous Coronary Intervention. The American Journal of Cardiology. 128, 127-133 (2020).
- Afana, M., et al. Transcaval access for the emergency delivery of 5.0 liters per minute mechanical circulatory support in cardiogenic shock. Catheterization and Cardiovascular Interventions. , 29235 (2020).
- Sandoval, Y., et al. Contemporary Arterial Access in the Cardiac Catheterization Laboratory. JACC: Cardiovascular Interventions. 10 (22), 2233-2241 (2017).
- Seto, A. H., et al. Real-Time Ultrasound Guidance Facilitates Femoral Arterial Access and Reduces Vascular Complications. JACC: Cardiovascular Interventions. 3 (7), 751-758 (2010).
- Mignatti, A., Friedmann, P., Slovut, D. P. Targeting the safe zone: A quality improvement project to reduce vascular access complications: Vascular Access Complications Postcardiac Catheterization. Catheterization and Cardiovascular Interventions. 91 (1), 27-32 (2018).
- Rihal, C. S., et al. 2015 SCAI/ACC/HFSA/STS Clinical Expert Consensus Statement on the Use of Percutaneous Mechanical Circulatory Support Devices in Cardiovascular Care: Endorsed by the American Heart Assocation, the Cardiological Society of India, and Sociedad Latino Americana de Cardiologia Intervencion; Affirmation of Value by the Canadian Association of Interventional Cardiology-Association Canadienne de Cardiologie d’intervention. Journal of the American College of Cardiology. 65 (19), 7-26 (2015).
- Burzotta, F., et al. Impella ventricular support in clinical practice: Collaborative viewpoint from a European expert user group. International Journal of Cardiology. 201, 684-691 (2015).
- Basir, M. B., et al. Improved Outcomes Associated with the use of Shock Protocols: Updates from the National Cardiogenic Shock Initiative. Catheterization and Cardiovascular Interventions. 93 (7), 1173-1183 (2019).
- Kaki, A., et al. Access and closure management of large bore femoral arterial access. Journal of Interventional Cardiology. 31 (6), 969-977 (2018).
- Basir, M. B., et al. Effect of Early Initiation of Mechanical Circulatory Support on Survival in Cardiogenic Shock. The American Journal of Cardiology. 119 (6), 845-851 (2017).
- Tehrani, B. N., et al. Standardized Team-Based Care for Cardiogenic Shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Ouweneel, D. M., et al. Percutaneous Mechanical Circulatory Support Versus Intra-Aortic Balloon Pump in Cardiogenic Shock After Acute Myocardial Infarction. Journal of the American College of Cardiology. 69 (3), 278-287 (2017).
- Alushi, B., et al. Impella versus IABP in acute myocardial infarction complicated by cardiogenic shock. Open Heart. 6 (1), 000987 (2019).
- Ginwalla, M., Tofovic, D. S. Current Status of Inotropes in Heart Failure. Heart Failure Clinics. 14 (4), 601-616 (2018).
- O’Neill, W. W., et al. Analysis of outcomes for 15,259 US patients with acute myocardial infarction cardiogenic shock (AMICS) supported with the Impella device. American Heart Journal. 202, 33-38 (2018).
- O’neill, W. W., et al. The Current Use of Impella 2.5 in Acute Myocardial Infarction Complicated by Cardiogenic Shock: Results from the USpella Registry. Journal of Interventional Cardiology. 27 (1), 1-11 (2014).
- Hernandez, G. A., et al. Trends in Utilization and Outcomes of Pulmonary Artery Catheterization in Heart Failure With and Without Cardiogenic Shock. Journal of Cardiac Failure. 25 (5), 364-371 (2019).
- Thayer, K., et al. Pulmonary Artery Catheter Usage and Mortality in Cardiogenic Shock. The Journal of Heart and Lung Transplantation. 39 (4), 54-55 (2020).
- Fincke, R., et al. Cardiac power is the strongest hemodynamic correlate of mortality in cardiogenic shock: A report from the SHOCK trial registry. Journal of the American College of Cardiology. 44 (2), 340-348 (2004).
- Lim, H. S., Gustafsson, F. Pulmonary artery pulsatility index: physiological basis and clinical application. European Journal of Heart Failure. 22 (1), 32-38 (2020).
- Korabathina, R., et al. The pulmonary artery pulsatility index identifies severe right ventricular dysfunction in acute inferior myocardial infarction. Catheterization and Cardiovascular Interventions. 80 (4), 593-600 (2012).
- Lauten, A., et al. Percutaneous left-ventricular support with the Impella-2.5-assist device in acute cardiogenic shock: results of the Impella-EUROSHOCK-registry. Circulation. Heart Failure. 6 (1), 23-30 (2013).
- Dixon, S. R., et al. A Prospective Feasibility Trial Investigating the Use of the Impella 2.5 System in Patients Undergoing High-Risk Percutaneous Coronary Intervention (The PROTECT I Trial): Initial U.S. Experience. JACC: Cardiovascular Interventions. 2 (2), 91-96 (2009).
- Abu-Fadel, M. S., et al. Fluoroscopy vs. Traditional guided femoral arterial access and the use of closure devices: A randomized controlled trial. Catheterization and Cardiovascular Interventions. 74 (4), 533-539 (2009).
- Lata, K., Kaki, A., Grines, C., Blank, N., Elder, M., Schreiber, T. Pre-close technique of percutaneous closure for delayed hemostasis of large-bore femoral sheaths. Journal of Interventional Cardiology. 31 (4), 504-510 (2018).
- Basir, M. B., et al. Feasibility of early mechanical circulatory support in acute myocardial infarction complicated by cardiogenic shock: The Detroit cardiogenic shock initiative. Catheterization and Cardiovascular Interventions. 91 (3), 454-461 (2018).
- Udesen, N. J., et al. Rationale and design of DanGer shock: Danish-German cardiogenic shock trial. American Heart Journal. 214, 60-68 (2019).
- Clinical Research. Protected PCI Community Available from: https://www.protectedpci.com/clinical-research/ (2020)
- Seyfarth, M., et al. A Randomized Clinical Trial to Evaluate the Safety and Efficacy of a Percutaneous Left Ventricular Assist Device Versus Intra-Aortic Balloon Pumping for Treatment of Cardiogenic Shock Caused by Myocardial Infarction. Journal of the American College of Cardiology. 52 (19), 1584-1588 (2008).
- Schrage, B., et al. Impella Support for Acute Myocardial Infarction Complicated by Cardiogenic Shock. Circulation. 139 (10), 1249-1258 (2019).
- Casassus, F., et al. The use of Impella 2.5 in severe refractory cardiogenic shock complicating an acute myocardial infarction. Journal of Interventional Cardiology. 28 (1), 41-50 (2015).
- Joseph, S. M., Brisco, M. A., Colvin, M., Grady, K. L., Walsh, M. N., Cook, J. L. Women With Cardiogenic Shock Derive Greater Benefit From Early Mechanical Circulatory Support: An Update From the cVAD Registry. Journal of Interventional Cardiology. 29 (3), 248-256 (2016).
- Lauten, A., et al. Percutaneous Left-Ventricular Support With the Impella-2.5-Assist Device in Acute Cardiogenic Shock. Circulation: Heart Failure. 6 (1), 23-30 (2013).
- Ouweneel, D. M., et al. Impella CP Versus Intra-Aortic Balloon Pump in Acute Myocardial Infarction Complicated by Cardiogenic Shock: The IMPRESS trial. Journal of the American College of Cardiology. , 23127 (2016).
- Badiye, A. P., Hernandez, G. A., Novoa, I., Chaparro, S. V. Incidence of Hemolysis in Patients with Cardiogenic Shock Treated with Impella Percutaneous Left Ventricular Assist Device. ASAIO Journal. 62 (1), 11-14 (2016).

