הכנת רשת מהירה למיקרוסקופיה קריו-אלקטרונית שנפתרה בזמן
Summary
כאן, אנו מספקים פרוטוקול מפורט לשימוש בהתקן מהיר לייצור רשת הן לייצור רשת מהירה והן לערבוב מהיר והקפאה כדי לבצע ניסויים שנפתרו בזמן.
Abstract
תחום המיקרוסקופיה הקריו-אלקטרונית (cryo-EM) מתפתח במהירות עם אלגוריתמי חומרה ועיבוד חדשים, ומייצר מבנים ברזולוציה גבוהה יותר ומידע על מערכות מאתגרות יותר. הכנה לדוגמה עבור cryo-EM עוברת מהפכה דומה עם גישות חדשות שפותחו כדי מחליף את מערכות הכתמים המסורתיות. אלה כוללים שימוש במתקנים פיזו-חשמליים, הדפסת סיכות וריסוס ישיר. כתוצאה מהתפתחויות אלה, מהירות הכנת הרשת עוברת משניות לאלפיות שניה, ומספקת הזדמנויות חדשות, במיוחד בתחום ה-cryo-EM שנפתר בזמן שבו חלבונים ומצעים יכולים להיות מעורבים במהירות לפני הקפאת הצלילה, לכידת מצבי ביניים קצרי מועד. כאן אנו מתארים בפירוט פרוטוקול סטנדרטי ליצירת רשתות במכשיר ה- EM שלנו שנפתר בזמן הבית הן להכנת רשת מהירה סטנדרטית והן לניסויים שנפתרו בזמן. הפרוטוקול דורש מינימום של כ 50 μL מדגם בריכוזים של ≥ 2 מ”ג / מ”ל להכנת 4 רשתות. העיכוב בין יישום מדגם להקפאה יכול להיות נמוך ככל 10 ms. מגבלה אחת היא עובי קרח מוגבר במהירויות גבוהות יותר בהשוואה לשיטת הכתם. אנו מקווים שפרוטוקול זה יסייע לאחרים לעצב מכשירים משלהם לייצור רשתות ואלה המעוניינים לתכנן ניסויים שנפתרו בזמן.
Introduction
רקע
ההתפתחויות האחרונות במיקרוסקופיה קריו-אלקטרונית (cryo-EM) אפשרו מחקרים מבניים של מערכות מורכבות יותר ויותר ברזולוציה גבוהה. למעט כמה יוצאים מן הכלל, מחקרים כאלה הוגבלו למקרומולקולים ביולוגיים בשיווי משקל1 או תגובות איטיות יחסית2. תהליכים רבים ב- vivo מתרחשים בציר זמן מהיר יותר (אלפיות שניה) ויש עניין גובר בהקפאה-EM (TrEM) שנפתרה בזמן בלוחות זמנים אלה3. עם זאת, הכנה מדגם cryo-EM קונבנציונאלי על ידי שיטת blotting הוא איטי מדי עבור TrEM אלפית השנייה.
לשיטת הכתמים יש מגבלות אחרות מלבד רזולוציית זמן ירודה. חלבונים ומתחמי חלבון יכולים לסבול דנטורציה או אוריינטציה מועדפת על רשתות4. הפחתת זמן החשיפה לממשק מי האוויר במהלך הכנת המדגם הוכח כדי למתן את הכיוון המועדף ואת denaturation חלבון5,6. לכן, הכנת רשת מהירה לא רק מאפשרת TrEM אלפיות השנייה, אלא גם יכול לשפר את איכות הרשת.
נכון לעכשיו, ישנן שלוש גישות שונות להכנת רשת אוטומטית. הגישה הראשונה משתמשת בסיכה או נימה המכילה כמות קטנה של מדגם. לאחר יצירת מגע בין הנוזל לבין משטח הרשת, המדגם ‘כתוב’ על הרשת7,8. תהליך היישום לדוגמה איטי יחסית ונמשך מספר שניות. גישה חלופית משתמשת בדור טיפות מבוקר על ידי מתקן פיזו ורשתות מנדלות עצמיות9. זה מאפשר חלוקה מהירה יותר להקפיא את הזמנים, אבל עדיין מוגבל על ידי טיפה ומהירות מנדלות (כרגע מגיע 54 ms). הגישה המהירה ביותר עד כה היא גישת הריסוס הישירה, שבה המדגם אטומ בזרבובית ספריי והטיפות הקטנות (~ 10 – 20 מיקרומטר) ומהירות (> 5 מ’/ש’) מתפשטות במגע עם רשת cryo-EM. תרסיס מדגם יכול להיווצר בדרכים שונות כגון אטומיזרים airblast, גלים אקוסטיים פני השטח או מכשירי אדים קוליים10,11,12,13. מניסיוננו, עובי הקרח עם גישת הריסוס הישיר גדול יותר אך ריסוס ישיר מאפשר להקפיא את זמני < 10 מיליות.
פרוטוקול זה מתאר צעד אחר צעד כיצד ניתן להשתמש בהתקן EM (TED) שנפתר בזמן המצויד בזרבובית ריסוס מיקרופלואידית להכנת רשתות בציר זמן מהיר14,15. המכשיר שימש להכנת רשתות עם זמן השהיה מינימלי של 6 אלפיות השנייה בין יישום מדגם להקפאה ולערבוב מהיר ולהקפיא שתי דגימות. העיצוב של TED מבוסס עלגרסה קודמת 16 והוא דומה למכשירי cryo-EM מבוססי ריסוס אחרים17.
ראשית, ארבעת החלקים העיקריים של הגדרת TED מתוארים. ליבת ה-TED היא יחידת הטיפול בנוזלים, האחראית על שאיפה וחלוקה לדוגמה. בוכנה פנאומטית מעבירה את הרשת דרך התרסיס לתוך האתאן הנוזלי. הדור של התרסיס מושגת עם חרירים ריסוס microfluidic והקפאה נעשית במיכל אתאן נוזלי, אשר מתוארים בקצרה. לבסוף, התכונות הנוספות לשליטה בסביבת הרשת, במיוחד לחות, מסומנות. לאחר מכן יש פרוטוקולים מפורטים להפעלת המכשיר ולביצוע ניסויי TrEM. תוצאות מייצגות ניתנות להכנת רשת מהירה וניסוי TrEM פשוט.
התקנה ניסיונית
יחידת הטיפול בנוזלים
מערכת הטיפול הנוזלי של TED נוצרת על ידי שלוש משאבות כונן מזרק (‘משאבות 1 – 3’), כל אחת מצוידת שסתום סיבובי(איור 1). ספק כוח מספק משאבות 1- 3 עם 24 V DC. תקשורת עם תוכנת הבקרה (כתובה ב- Visual Basic ו- C++) מתבצעת באמצעות ממשק RS232 לשאיבה 1. הפקודות מופצות דרך יציאות הרחבת קלט/פלט טוריות ממשאבה 1 למשאבות 2-3. משאבות 1-3 מצוידות במזרקי זכוכית (מזרקים 1-3′, אנו משתמשים כאן במזרקי נפח מת μL/אפס). לכל שסתום יש שתי תנוחות, ‘עומס’ ו’לוותר ‘. תנוחת ה”עומס” משמשת לשאיפה לדגימה לתוך המזרק. חתיכה קצרה (~ 3 – 4 ס”מ) של 1/16 ” O.D., 0.01′′ I.D. צינורות FEP מחובר באמצעות אביזרי FLFE / ETFE flANGELESS למיקום ‘עומס’ של שסתומים 1-3. פיסת צינורות קצרה זו מגיעה למאגר הדגימה (בדרך כלל צינור פלסטיק 1.5 מ”ל או 0.5 מ”ל). תנוחת ה’מחלק’ מובילה לזרבובית הריסוס. החיבור בין שקע ‘לוותר’ לבין זרבובית ספריי נעשה על ידי צינורות PE (~ 20-30 ס”מ אורך, 0.043 “O.D., 0.015 ” I.D.), עם חתיכת קצרה של צינורות שרוול (~ 0.5 ס”מ) ואביזרים ETFE / ETFE flangeless.
הבוכנה הפנאומטית
TED משתמש בוכנה פנאומטית כדי להאיץ את הרשת ולהעביר אותו דרך תרסיס המדגם לתוך מיכל האתאן הנוזלי. פינצטה בלחץ שלילי מחזיקה את הרשת, מוברגת למחזיק ביתי שמותקן על גליל פנאומטי כפול(איור 2A).
הלחץ מסופק מבלון גז חנקן גדול (גודל W), המצויד בווסת רב-שלבי (0 – 10 בר, ‘לחץ עיקרי’). צינורות PVC מחוזקים גמישים (12 מ”מ O.D.) מחברים את הרגולטור לסעפת 12 יציאות שבה מועבר חנקן בלחץ לזרבובית ולבוכנה הפנאומטית. זרימת גז דרך הזרבובית קבועה, מווסתת ישירות בצילינדר החנקן (הלחץ העיקרי). החיבור לזרבובית נעשה עם צינורות PU (4 מ”מ O.D., 2.5 מ”מ זהות), חתיכה קצרה של צינורות PE (~ 8 ס”מ אורך, 0.043 “O.D., 0.015 “I.D.) ומחברים מתאימים. לחץ על הבוכנה הפנאומטית נשלט באמצעות שסתום סולנואיד. צינורות PU (4 מ”מ O.D., 2.5 מ”מ זהות) מחבר את שסתום סולנואיד עם מווסת ואת הבוכנה פנאומטית, כדי לאפשר לחץ צלילה מופחת (≤ הלחץ העיקרי). שסתום סולנואיד נשלט על ידי המחשב. מבט כולל סכמטי על ההתקנה ניתן באיור 2B.
שים לב כי עם התקנה זו לחץ הצלילה הוא תמיד שווה או קטן יותר מאשר לחץ גז ספריי (לחץ עיקרי). עם זאת, ההתקנה יכולה להשתנות בקלות על ידי שילוב של וסת שני במעלה הזרם של זרבובית ספריי כדי לאפשר מהירויות צלילה גבוהות יותר בלחץ גז ספריי נמוך. לחצים גבוהים (>> 2 בר) עלולים להזיק לזרבובית ספריי PDMS.
זהירות: זוהי מערכת בלחץ ואת “הלחץ העיקרי” תמיד צריך להיות < 7 בר.
לחצים בין 0.5 ל 2 בר משמשים בדרך כלל עבור הבוכנה פנאומטית ומציגים קשר ליניארי בקירוב בין לחץ ומהירות (במיקום האנכי של התרסיס). מהירויות הצלילה נמדדות באוספילוסקופ, המחוברות בהתאם לפוטנציומטר שקופית (10 kΩ) ובמקביל נגד 2 kΩ (איור 2C). ספק כוח מספק את הפוטנציומטר עם 9 V DC. בעוד מהירות הצלילה המשוערת מוגדרת לפני הניסוי על ידי הגדרת לחץ הצלילה, הפוטנציומטר נותן קריאה מדויקת של המהירות לאחר הניסוי.
חריני ריסוס ומיכל אתאן נוזלי
הייצור וההפעלה של חריקות וירטואליות דינמיות גז עבור משלוח מדגם מבוסס ספריי תוארו במקומות אחרים בפירוט15. כפי שתואר לעיל, שקעי ‘מחלק’ של שסתומים 1-3 מחוברים למפרצונים הנוזליים של הזרבובית (איור 3A). גז הריסוס בלחץ מחובר לפצצת הגז של הזרבובית. המפרצונים בזרבוביות ספריי PDMS הן כאלה כי צינורות 0.043 “O.D. PE ניתן להשתמש ישירות ללא צורך אביזרי. עיצוב הזרבובית שלנו מכיל גיאומטריית ‘סילון סילון’ לערבוב של שתי דוגמאות, בדומה למכשיר המתואר בנציג18. תרשים של העיצוב מוצג באיור 3B, תמונה מיקרוסקופית של זרבובית מוצגת באיור 3C. הפריסה של המכשיר microfluidic דורש שימוש בשלושה מזרקים לערבב שתי דגימות. זרבובית הריסוס ממוקמת בדרך כלל במרחק של 1-1.5 ס”מ מהרשת (במהלך יישום מדגם).
אנו משתמשים באתאן נוזלי כקריוגן, במיכל אתאן נוזלי/חנקן המשמש לשיטת הכתמים הסטנדרטית. מיקום אנכי של האתאן הנוזלי מושגת עם פלטפורמת הרמת מעבדה.
שליטה בסביבת הריסוס והרשת
הבוכנה וזרבובית הריסוס כלולים בתוך תיבת PMMA (זכוכית אקרילית) שנבנתה בהתאמה אישית עם דלת כפולה(איור 4A). לחות יחסית גבוהה בתוך הקופסה מושגת על ידי מערכת לחות אוויר בחלק האחורי של TED (איור 4B). האוויר מסופק על ידי משאבה ומוזן למיכל הראשון של “10 (המשמש בדרך כלל לטיהור מי כיור). המיכל מלא בגובה מים נמוך (~ 5-10 ס”מ) וגם מכיל יחידת מכשירי אדים. עוצמת החשמל של מכשיר הלחות נשלטת על ידי בקר לחות/טמפרטורה דיגיטלי וחיישן לחות/טמפרטורה הממוקם בתוך קופסת הזכוכית האקרילית. הבקר מוגדר לכבות את המשאבה כאשר הלחות היחסית מגיעה ≥ 90%. אוויר לח מהמיכל הראשון נשאב דרך מפזר, שקוע במים במיכל 10 ” שני ולאחר מכן נכנס לקופסת הזכוכית האקרילית.
אזהרה: מכיוון שהדגימה מתרסיס בזרבובית ספריי, דגימה ביולוגית או כימית מסוכנת אינם מתאימים כדגימות.
רצף הריצה
לחצן הפעל Script בתוכנת הבקרה מאתחל את רצף הריצה. ניתן להגדיר מראש רצף פקודות זה בקובץ Script ולשנותו באמצעות התוכנה. המשתנים החשובים ביותר מוסברים כאן:
מהירות ריסוס: מהירות הריסוס קובעת את קצב הזרימה הנוזלי המשמש את משאבת המזרק. ניתן לחשב את קצב הזרימה כדלקמן: למנועי משאבת המזרק המשמשים כאן יש גודל שלב קבוע. הטווח המלא של המשאבה מחולק ל-48,000 צעדים. הגורם החשוב השני הוא נפח המזרק. אנחנו בדרך כלל משתמשים במזרקי μL 250. מהירות הריסוס בתוכנת הבקרה מוגדרת כמספר שלבים/שניה. מהירות ריסוס של 1000 שלבים/שניה תואמת ל:
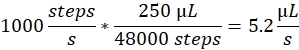
נפח ריסוס: נפח הריסוס קובע את הנפח הכולל שיש לרסס. לכן, הוא גם קובע את משך התרסיס. עוצמת הקול של הריסוס בתוכנת הבקרה מוגדרת כמספר שלבים. נפח ספריי של 2000 צעדים, במהירות ריסוס של 1000 צעדים לשנייה, מוביל משך ריסוס של 2 s ונפח כולל של 10.4 μL.
זמן קדם ריסוס: משתנה זה מגדיר את הזמן בין ייזום התרסיס לצלילה. חשוב לבחור את זמן ההשהיה כך שלתרסיס יש מספיק זמן לייצב לפני הצלילה ברשת. בדרך כלל, התרסיס ניתן 1.5 – 4 s כדי לייצב לפני הרשת הוא צלל. התרסיס נשמר עד שהרשת עברה. בדרך כלל, זרימת הנוזל (ולכן התרסיס) נעצר 0.5 ל 1 s לאחר הרשת כבר צלל. באמצעות מהירות ריסוס של 1000 צעדים/s ונפח ריסוס של 2000 צעדים, זמן טרום ספריי טיפוסי הוא 1.5 s, למשל.
רצף פקודות למופת מוצג באיור 5A, מיקום הרשת לאורך זמן מומחש באיור 5B.
Protocol
Representative Results
Discussion
הפרוטוקולים בעבודה זו יכולים לשמש להכנת רשת מהירה על ידי ריסוס ישיר וניסויים TrEM. הכנת רשת מהירה יכולה לשמש כדי להפחית אינטראקציות חלקיקים עם ממשק מי האוויר5. המגבלות העיקריות הן ריכוז המדגם הזמין ועובי הקרח ברשת. בתוך גבולות אלה ובתנאי שאיכות המדגם טובה, הפרוטוקול מייצר רשתות…
Divulgations
The authors have nothing to disclose.
Acknowledgements
ברצוננו להודות למולי ס.C גרייבט על דיונים מועילים וצוות מתקן ABSL על העזרה באיסוף נתונים של cryo-EM. דייוויד פ. קלבל הוא דוקטורנט בתוכנית הדוקטורט ל-Wellcome Trust במרכז אסטבורי במימון אוניברסיטת לידס. המיקרוסקופים של FEI Titan Krios מומנו על ידי אוניברסיטת לידס (פרס ABSL UoL) וקרן Wellcome (108466/Z/15/Z). עבודה זו מומנה על ידי מענק BBSRC לסטיבן פ. מונץ ‘ (BB/P026397/1) ונתמכה על ידי מענקי מחקר להווארד ד. ווייט מאיגוד הלב האמריקאי (AMR21-236078) ולהווארד ד. ווייט ו-ויטולד גלקין מהמכונים הלאומיים לבריאות בארה”ב (171261).
Materials
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10×70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochimie 15, 5818-5826 (1976). |
References
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D’Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner’s guide to flow kinetics. The Biochemist. 42, (2020).

