Partikel-Template-Emulgierung ermöglicht mikrofluidsäurefreie Tröpfchen-Assays
Summary
Wasser-in-Öl-Tröpfchen-Assays sind nützlich für die analytische Chemie, die Enzymevolution und die Einzelzellanalyse, erfordern jedoch typischerweise Mikrofluidik, um die Tröpfchen zu bilden. Hier beschreiben wir die Partikel-Template-Emulgierung, einen mikrofluidikfreien Ansatz zur Durchführung von Tröpfchenassays.
Abstract
Reaktionen, die in monodispersierten Tröpfchen durchgeführt werden, bieten eine verbesserte Genauigkeit und Empfindlichkeit im Vergleich zu gleichwertigen Reaktionen, die in großen Mengen durchgeführt werden. Die Anforderung der Mikrofluidik, kontrollierte Tröpfchen zu bilden, stellt jedoch eine Barriere für Nicht-Experten dar, die ihre Verwendung einschränkt. Hier beschreiben wir die Partikel-Template-Emulgierung, einen Ansatz zur Erzeugung monodisperser Tröpfchen ohne Mikrofluidik. Mit Hilfe von Templating-Hydrogelkugeln verkapseln wir Proben in monodispersierten Tröpfchen durch einfaches Vortexieren. Wir demonstrieren den Ansatz, indem wir damit eine mikrofluidikfreie digitale PCR durchführen.
Introduction
Die Tröpfchenmikrofluidik nutzt die Kompartimentierung in Pikolitertröpfchen, um die Empfindlichkeit und Genauigkeit von Assays im Vergleich zu Massenreaktionen zu erhöhen, und hat zahlreiche Anwendungen im chemischen Screening, Protein-Engineering und next generation sequencing1,2,3. Beispielsweise bietet die digitale Tröpfchenpolymerase-Kettenreaktion (ddPCR) im Vergleich zur quantitativen Massenpolymerase-Kettenreaktion (qPCR) eine erhöhte Genauigkeit mit Anwendungen für genetische Variation bei Krebserkrankungen, den Nachweis krankheitsverursachender Mutationen und die pränatale Diagnostik4,5,6. Eine Herausforderung der Tröpfchenmikrofluidik ist jedoch die Anforderung an mikrofluidische Geräte, Proben zu partitionieren. Während die Mikrofluidik eine ausgezeichnete Kontrolle über die Tröpfcheneigenschaften bietet, erfordert sie spezielles Fachwissen, um zu bauen und zu betreiben7,8. Folglich sind Tröpfchen-basierte Methoden weitgehend auf Expertenlabore oder in seltenen Fällen auf Anwendungen beschränkt, in denen ein kommerzielles Instrument verfügbar ist9,10. Um den Einsatz von Tröpfchenassays zu erweitern, ist die Anforderung an spezialisierte mikrofluidische Instrumente eine Hürde, die überwunden werden muss.
In diesem Artikel beschreiben wir die Particle Templated Emulsification (PTE), eine mikrofluidikfreie Methode zur Durchführung von Reaktionen in monodispersierten Tröpfchen. Bei PTE verschlingen Templatationspartikel die Probe durch einfaches Wirbeln in Tröpfchen im Trägeröl (Abbildung 1). Während sich das System vermischt, fragmentiert sich der wässrige Teil in Tröpfchen von reduzierender Größe, bis die Tröpfchen einzelne Partikel enthalten, an diesem Punkt ist eine weitere Fragmentierung nicht möglich, da die Partikel gebrochen werden müssen. Die verschlungene Probe umgibt die Partikel als Hülle in den Tröpfchen und umschließt dadurch alle dispergierten Zellen, Reagenzien oder funktionellen Einheiten (Abbildung 1D). Daher erfordert PTE keine Ausrüstung oder Fachkenntnisse, um Tröpfchenreaktionen durchzuführen, die über einen gewöhnlichen Vortexer hinausgehen. Darüber hinaus dauert die Tröpfchenerzeugung Sekunden im Vergleich zu Minuten oder Stunden mit Mikrofluidik, und die erzeugte Menge ist proportional zum Behältervolumen, nicht zur Betriebszeit des Geräts, was sie äußerst skalierbar macht. Diese Vorteile machen PTE ideal für die Durchführung von Tröpfchenassays unter einer Vielzahl von Umständen, in denen die Mikrofluidik nicht praktikabel ist. Hier demonstrieren wir PTE und verwenden es, um ddPCR durchzuführen.
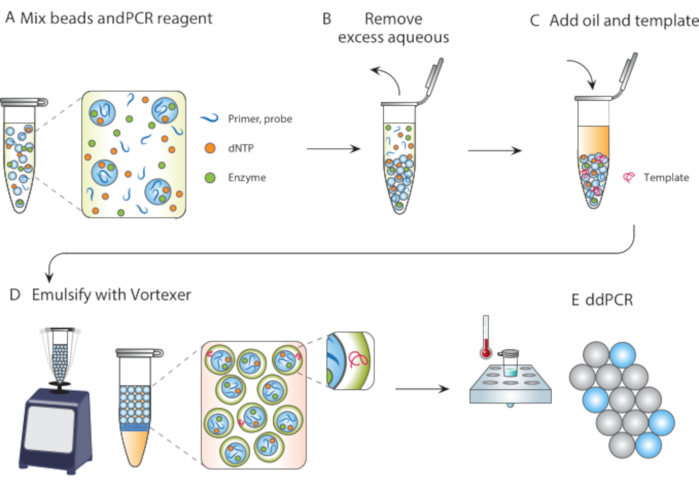
Abbildung 1. Überblick über den Emulgierungsprozess mit Partikelschablonen. (A) Templating-Partikel werden mit Reagenzien gemischt. (B) Überschüssige Reagenzien werden nach der Zentrifugation entfernt. (C) Die Zugabe von Template-Molekülen erfolgt vor der Zugabe von Öl. (D) Vortexing erzeugt Tröpfchen, die ein einzelnes Template-Molekül enthalten. (E) Das anschließende Thermocycling und die Bildgebung ermöglichen eine digitale Tröpfchenanalyse der Zielschablone. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
PTE verwendet Partikel, um Proben in monodispersierten Tröpfchen durch Wirbeln zu verkapseln. Zusätzlich zu seiner Einfachheit und Zugänglichkeit bietet PTE mehrere zusätzliche Vorteile, einschließlich der Möglichkeit, große Mengen an Tröpfchen sofort zu erzeugen. Darüber hinaus kann der Prozess in einem isolierten Röhrchen durchgeführt werden, wodurch die Notwendigkeit entfällt, Proben an mikrofluidische Geräte zu übertragen, den gesamten Arbeitsablauf zu rationalisieren und die Möglichkeiten für Probenkontamination oder -verlust zu begrenzen. Die Templating-Partikel bieten auch ein Mittel, um den Inhalt der resultierenden Tröpfchenreaktionen zu entwickeln. Zum Beispiel können Partikelgröße, Chemie und Benetzbarkeit für gezielte Biomoleküle oder Zelleinfang entwickelt werden, während funktionelle Einheiten wie Enzyme, Wirkstoffe oder Nukleinsäuren auf Partikeln angezeigt werden können, um Reaktionen zu erleichtern, z. B. für die Einzelzellsequenzierung oder funktionelle Charakterisierung. Obwohl der Ansatz flexibel ist, gibt es dennoch wichtige Einschränkungen für seine Verwendung. Beispielsweise ist es derzeit nicht möglich, Tröpfchenzusätze durchzuführen, wie sie häufig mit der Mikrofluidik durchgeführt werden, so dass alle Reaktionskomponenten vor der Verkapselung eingeführt werden müssen. Dies erfordert, dass Reagenzien kompatibel und stabil sind, bis die Tröpfchen erzeugt werden können, und im Falle problematischer Kombinationen oft durch schnelles Mischen und Emulgieren der Probe auf Eis behoben werden können. Alternativ können reaktive Komponenten verwendet werden, die extern mit Licht oder Wärme ausgelöst werden können13. PTE bietet somit eine flexible und skalierbare Methode zur Durchführung von Tröpfchenassays, die auch für Nicht-Experten zugänglich ist. Dies, gepaart mit seiner angeborenen Einfachheit und Flexibilität, macht PTE ideal für die Ausführung und Entwicklung zahlreicher Tröpfchenanwendungen.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit zur Entwicklung dieses Protokolls wurde von den National Institutes of Health (R01-EB019453-02), dem Büro des Direktors für nationale Intelligenz, Intelligence Advanced Research Projects Activity durch Raytheon BBN Technologies Corp (N66001-18-C-4507), dem Chan-Zuckerberg Biohub Investigator Program, der Defense Advanced Research Projects Agency über die Texas A & M University (W911NF1920013) und den Zentren für Krankheitskontrolle und Prävention durch die Johns Hopkins University Unterstützt. Physiklabor (75D30-11-9C-06818 (CDC3)). Die hierin enthaltenen Ansichten und Schlussfolgerungen sind die der Autoren und sollten nicht so interpretiert werden, dass sie notwendigerweise die offizielle Politik, weder ausgedrückt noch stillschweigend, der oben genannten Organisationen oder der US-Regierung darstellen. Die US-Regierung ist berechtigt, Nachdrucke für staatliche Zwecke zu reproduzieren und zu verteilen, ungeachtet etwaiger Urheberrechtshinweise darin.
Materials
| 0.22 um syringe filter | Milipore Sigma | SLGP033RS | |
| 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| 1 mL syringes | BD | 309628 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| 1M Tris-HCI, pH 8.0 | Thermo-Fisher | 15568025 | |
| 27 gauge needles | BD | 305109 | |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | |
| Acrylamide solution,40%, for electrophoresis, sterile-filtered | Sigma-Aldrich | A4058-100ML | |
| Ammonium persulfate | Sigma-Aldrich | A3678-25G | |
| Aquapel (fluorinated surface treatment) | Pittsburgh Glass Works | 47100 | |
| Hexane | Sigma-Aldrich | 139386 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| N,N′-Methylenebis(acrylamide) | Sigma-Aldrich | 146072-100G | |
| NaCl | Sigma-Aldrich | S9888 | |
| Novec-7500 Engineering Fluid (HFE oil) | 3M | 98-0212-2928-5 | |
| polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| fluorosurfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Photomasks | CadArt Servcies | (custom) | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| SU-8 3025 photoresist | Kayaku | 17030192 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Yeast FWD | IDT | 5′-GCAGACCAGACCAGAACAAA-3′ | |
| Yeast REV | IDT | 5′-ACACGTATGTATCTAGCCGAATA AC-3 |
|
| Yeast Probe | IDT | 5′-/56-FAM/ATATGTTGT/ZEN/TCACTCGCGCCTGGG/3IABk FQ/-3′ |
|
| EVOS FL AUTO | Life Technologies | ||
| EVOS LED Cube, GFP | Life Technologies | AMEP4651 | |
| SYLGARD 184 KIT 1.1 LB (PDMS base and curing reagents) | Dow Corning | DC4019862 | |
| TEMED | Thermo Fisher | 17919 | |
| Saccharomyces cerevisiae genomic DNA | Milipore | 69240-3 | |
| Expanded plasma cleaner (plasma bonder) | Harrick Plasma | PDC-002 (230V) | |
References
- Mashaghi, S., Abbaspourrad, A., Weitz, D. A., van Oijen, A. M. Droplet microfluidics: A tool for biology, chemistry, and nanotechnology. Trends in Analytical Chemistry. 82, 118-125 (2016).
- Gielen, F., et al. Ultrahigh-throughput-directed enzyme evolution by absorbance-activated droplet sorting (AADS). Proceedings of the National Academy of Sciences of USA. 113 (47), 7383-7389 (2016).
- Mai, S., Murphy, T. W., Lu, C. Microfluidics for genome-wide studies involving next generation sequencing. Biomicrofluidics. 11 (2), 021501 (2017).
- Olmedillas-López, S., García-Arranz, M., García-Olmo, D. Current and emerging Applications of Droplet Digital PCR in Oncology. Molecular Diagnosis and Therapy. 21 (5), 493-510 (2017).
- Tong, Y., Shen, S., Jiang, H., Chen, Z. Application of Digital PCR in Detecting Human Diseases Associated Gene Mutation. Cellular Physiology and Biochemistry. 43 (3), 1718-1730 (2017).
- Yan, Y., et al. Evaluation of droplet digital PCR for non-invasive prenatal diagnosis of phenylketonuria. Analytical and Bioanalytical Chemistry. 411 (27), 7115-7126 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging Droplet Microfluidics. Chemical Reviews. 117 (12), 7964-8040 (2017).
- The, S., Lin, R., Hung, L., Lee, A. P. Droplet Microfluidics. Lab Chip. 8 (2), 198-220 (2008).
- Baker, M. Digital PCR hits its stride. Nature Methods. 9, 541-544 (2012).
- Kolodziejczyk, A. A., Kim, J. K., Svensson, V., Marioni, J. C., Teichmann, S. A. The Technology and Biology of Single-Cell RNA Sequencing. Molecular Cell. 58 (4), 610-620 (2015).
- Hatori, M. N., Kim, S. C., Abate, A. R. Particle-Templated Emulsification for Microfluidics-Free Digital Biology. Analytical Chemistry. 90 (16), 9813-9820 (2018).
- Panda, P., et al. Stop-flow lithography to generate cell-laden microgel particles. Lab Chip. 8 (7), 1056-1061 (2008).
- Yozwiak, C. E., Hirschhorn, T., Stockwell, B. R. Towards a microparticle-based system for pooled assays of small molecules in cellular contexts. ACS Chemical Biology. 13 (3), 761-771 (2018).

