Espectroscopía de eco de espín de neutrones como una sonda única para la dinámica de la membrana lipídica y las interacciones membrana-proteína
Summary
Este artículo describe los protocolos para la preparación de muestras, la reducción de datos y el análisis de datos en estudios de eco de espín de neutrones (NSE) de membranas lipídicas. El etiquetado juicioso de los lípidos con deuterio permite el acceso a diferentes dinámicas de membrana en escalas de longitud y tiempo mesoscópicas, sobre las cuales ocurren procesos biológicos vitales.
Abstract
Las bicapas lipídicas forman la matriz principal de las membranas celulares y son la plataforma principal para el intercambio de nutrientes, las interacciones proteína-membrana y la brotación viral, entre otros procesos celulares vitales. Para una actividad biológica eficiente, las membranas celulares deben ser lo suficientemente rígidas como para mantener la integridad de la célula y sus compartimentos, pero lo suficientemente fluidas como para permitir que los componentes de la membrana, como las proteínas y los dominios funcionales, se difundan e interactúen. Este delicado equilibrio de las propiedades de la membrana elástica y fluida, y su impacto en la función biológica, requieren una mejor comprensión de la dinámica colectiva de la membrana en escalas de tiempo y duración mesoscópicas de procesos biológicos clave, por ejemplo, deformaciones de membrana y eventos de unión a proteínas. Entre las técnicas que pueden sondear eficazmente este rango dinámico se encuentra la espectroscopia de eco de espín de neutrones (NSE). Combinado con el etiquetado de deuterio, NSE se puede utilizar para acceder directamente a las fluctuaciones de flexión y espesor, así como a la dinámica mesoscópica de características de membrana seleccionadas. Este documento proporciona una breve descripción de la técnica NSE y describe los procedimientos para realizar experimentos de NSE en membranas liposomales, incluidos los detalles de la preparación de muestras y los esquemas de deuteración, junto con instrucciones para la recopilación y reducción de datos. El documento también presenta métodos de análisis de datos utilizados para extraer parámetros clave de la membrana, como el módulo de rigidez de flexión, el módulo de compresibilidad del área y la viscosidad en el plano. Para ilustrar la importancia biológica de los estudios de NSE, se discuten ejemplos seleccionados de fenómenos de membrana sondeado por NSE, a saber, el efecto de los aditivos en la rigidez de flexión de la membrana, el impacto de la formación de dominios en las fluctuaciones de la membrana y la firma dinámica de las interacciones membrana-proteína.
Introduction
La comprensión de las membranas celulares y su función ha evolucionado notablemente en las últimas décadas. La visión anterior de las membranas celulares como bicapas lipídicas pasivas que definen los límites celulares y albergan proteínas de membrana1 se ha transformado gradualmente en un modelo dinámico en el que las bicapas lipídicas desempeñan un papel importante en la regulación de los procesos biológicos vitales, incluida la señalización celular, el intercambio molecular y la función de las proteínas, por nombrar algunos2,3,4,5,6. Esta comprensión de que las membranas celulares son altamente dinámicas, en constante remodelación y redistribución molecular, ha impulsado exploraciones científicas más allá de las estructuras de equilibrio de las membranas7,8,9. En consecuencia, se han desarrollado múltiples enfoques para estudiar los diversos modos dinámicos en las membranas lipídicas biológicas y bioinspiradas. Hasta la fecha, la mayoría de estos estudios se han centrado principalmente en los movimientos moleculares difusivos10,11,12,13 y las fluctuaciones macroscópicas de la forma14,15,16,dejando un vacío significativo en la comprensión de la dinámica intermedia de la membrana, es decir, las fluctuaciones colectivas de los conjuntos de lípidos que consisten en unos pocos 10-100 de moléculas de lípidos. Estas dinámicas ocurren en escalas de longitud de pocas decenas a pocas 100 Å y en escalas de tiempo de sub-ns a unos pocos cientos de ns (ver Figura 1),referidas aquí como escalas mesoscópicas. De hecho, es en estas escalas que la actividad biológica clave tiene lugar a nivel de membrana17. Esto incluye la brotación viral18,la canalización19y las interacciones membrana-proteína20. También es importante señalar que el panorama energético de las proteínas de membrana21,22 muestra que los cambios conformacionales en las proteínas, necesarios para su papel regulador, ocurren en las escalas de tiempons 23 de fluctuaciones colectivas de la membrana, enfatizando aún más la importancia de la dinámica mesoscópica en la función biológica de las membranas celulares y sus análogos bioinspirados20. Este artículo se centra en los dos modos dinámicos mesoscópicos primarios en las membranas lipídicas, a saber, las fluctuaciones de flexión y las fluctuaciones de espesor.
El principal desafío al sondear directamente estos modos de fluctuación es la dificultad de acceder simultáneamente a sus escalas espaciales y temporales utilizando métodos de espectroscopia estándar. El otro desafío es que las técnicas de contacto directo podrían afectar las mismas fluctuaciones que se supone que miden16. Esto se ve agravado por la complejidad composicional y estructural de las membranas biológicas24,25,lo que resulta en características de membrana no homogéneas, incluida la formación de dominios lipídicos26,27,28,29,30 y la asimetría de membrana31,32,33, que exigen sondas selectivas para comprender la dinámica de diferentes características de la membrana. Afortunadamente, estos desafíos pueden superarse con métodos de espectroscopia de neutrones no invasivos, como el eco de espín de neutrones (NSE), que inherentemente accede a las escalas de longitud y tiempo requeridas, y permiten además estudios de características selectivas de la membrana sin cambiar su entorno fisicoquímico34. De hecho, en los últimos años la espectroscopia NSE se ha convertido en una sonda única y poderosa de dinámica colectiva demembranas 35. Los resultados de los estudios de NSE sobre membranas lipídicas han producido nuevos conocimientos sobre las propiedades mecánicas36,37 y viscoelásticas38,39 de las membranas lipídicas y han arrojado nueva luz sobre su papel potencial en la función biológica40,41.
La técnica de espectroscopia NSE se basa en un diseño de instrumento interferométrico, propuesto por primera vez por Mezei42,utilizando una serie de aletas de espín y bobinas magnéticas para controlar la precesión del espín de neutrones a medida que los neutrones atraviesan el instrumento. El diseño se basa en el reflejo magnético de los elementos del campo magnético con respecto a la posición de la muestra (Figura 1A). Esto implica que en ausencia de intercambio de energía entre el neutrón y la muestra, el neutrón realiza el mismo número de precesiones de espín, en direcciones opuestas, en la primera y segunda mitad del instrumento (nótese el π-flipper entre las dos bobinas de precesión). Como resultado, el estado de espín final del neutrón permanece sin cambios en relación con el estado inicial, un fenómeno conocido como espín-eco (ver neutrón transparente en la Figura 1A). Sin embargo, cuando el neutrón interactúa energéticamente con la muestra, el intercambio de energía modifica el número de precesiones de espín en la segunda mitad del instrumento, lo que lleva a un estado de espín final diferente (ver Figura 1A). Esto se detecta experimentalmente como una pérdida en la polarización, como se mostrará más adelante en este artículo. Para obtener más detalles sobre la técnica NSE, se remite al lector a los documentos técnicos dedicados42,43,44,45.
Aquí, se presenta una descripción simplificada para proporcionar una estimación aproximada de la longitud y las escalas de tiempo accesibles con NSE. Las escalas de longitud están determinadas por el rango de transferencias de vector de onda alcanzables, Q = 4π sin θ/λ, donde 2θ es el ángulo de dispersión y λ es la longitud de onda del neutrón. Se puede ver que Q está establecido por el rango de longitud de onda y la extensión de rotación del segundo brazo del espectrómetro (ver Figura 1A). Un rango Qtípico en los espectrómetros NSE es ~ 0.02-2 Å-146,47y hasta 0.01-4 Å-1 con actualizaciones recientes48,49, correspondientes a escalas espaciales de ~ 1-600 Å. Por otro lado, la escala de tiempo accesible se calcula a partir del ángulo de precesión total (o fase) adquirido por el neutrón dentro de las bobinas de precesión magnética, y se encuentra que esde 50: 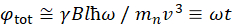 . En esta expresión, t es el tiempo de Fourier definido como
. En esta expresión, t es el tiempo de Fourier definido como 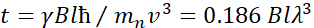 , donde es la relación
, donde es la relación 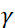 giromagnética de neutrones,
giromagnética de neutrones, 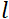 es la longitud de la bobina y es la fuerza del campo magnético de
es la longitud de la bobina y es la fuerza del campo magnético de 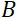 la bobina. Vale la pena señalar que el tiempo de Fourier es una cantidad que depende estrictamente de la geometría del instrumento, la intensidad del campo magnético y la longitud de onda de los neutrones. Por ejemplo, utilizando neutrones de longitud de onda
la bobina. Vale la pena señalar que el tiempo de Fourier es una cantidad que depende estrictamente de la geometría del instrumento, la intensidad del campo magnético y la longitud de onda de los neutrones. Por ejemplo, utilizando neutrones de longitud de onda 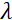 = 8 Å y ajustes del instrumento de
= 8 Å y ajustes del instrumento de 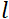 = 1,2 m y
= 1,2 m y 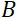 = 0,4 T, el tiempo de Fourier se calcula en t ~ 50 ns. Experimentalmente, el tiempo de Fourier se ajusta cambiando la corriente en las bobinas de precesión (es decir, la intensidad del campo magnético) o utilizando diferentes longitudes de onda de neutrones, lo que resulta en escalas de tiempo típicas de NSE de ~ 1 ps a 100 ns. Sin embargo, las actualizaciones recientes en los espectrómetros NSE han permitido el acceso a tiempos Fourier más largos, hasta ~ 400 ns en el espectrómetro J-NSE-Phoenix en el Heinz Maier-Leibnitz Zentrum51 y el espectrómetro SNS-NSE en el Laboratorio Nacional Oak Ridge48,y hasta ~ 1,000 ns en el espectrómetro IN15 NSE en el Institut Laue-Langevin (ILL)49.
= 0,4 T, el tiempo de Fourier se calcula en t ~ 50 ns. Experimentalmente, el tiempo de Fourier se ajusta cambiando la corriente en las bobinas de precesión (es decir, la intensidad del campo magnético) o utilizando diferentes longitudes de onda de neutrones, lo que resulta en escalas de tiempo típicas de NSE de ~ 1 ps a 100 ns. Sin embargo, las actualizaciones recientes en los espectrómetros NSE han permitido el acceso a tiempos Fourier más largos, hasta ~ 400 ns en el espectrómetro J-NSE-Phoenix en el Heinz Maier-Leibnitz Zentrum51 y el espectrómetro SNS-NSE en el Laboratorio Nacional Oak Ridge48,y hasta ~ 1,000 ns en el espectrómetro IN15 NSE en el Institut Laue-Langevin (ILL)49.
Además del acceso directo a la escala de tiempo y longitud de la dinámica de membranas, NSE tiene las capacidades inherentes de la sensibilidad a los isótopos de neutrones52. Específicamente, la capacidad de los neutrones para interactuar de manera diferente con los isótopos del hidrógeno, el elemento más abundante en los sistemas biológicos, da como resultado una densidad de longitud de dispersión de neutrones diferente,34 o NSLD (el equivalente al índice óptico de refracción50),cuando el protio es sustituido por deuterio. Esto permite un enfoque conocido como variación de contraste, que se usa comúnmente para resaltar características específicas de la membrana u ocultar otras; este último escenario se conoce como coincidencia de contraste. Una aplicación frecuente de variación/coincidencia de contraste es la sustitución de agua (NSLD = -0.56 × 10-6 Å-2) por agua pesada o D2O (NSLD = 6.4 × 10-6 Å -2) para amplificar la señal de neutrones de las membranas lipídicas protiatadas (NSLD ~ 0 × 10-6 Å-2). Este enfoque es altamente efectivo en estudios de estructura de membrana porque la penetración de D2O en la región del grupo de cabeza de la membrana permite la determinación precisa de los espesores de la membrana (ver Figura 2A,panel izquierdo) y de la ubicación de diferentes subgrupos lipídicos cuando se aplican modelos más sofisticados53,54. Este artículo destaca algunos ejemplos sobre el uso de la variación de contraste para estudios de dinámica colectiva en membranas biomiméticas y características de membrana seleccionadas.
Aquí, la efectividad de NSE para proporcionar información única sobre las propiedades dinámicas y funcionales de la membrana se ilustra a través de ejemplos tangibles de estudios de NSE en sistemas de membrana lipídica modelo y biológicamente relevantes con énfasis en la dinámica de mesoescala en membranas independientes, en forma de suspensiones liposomales. Para las mediciones de NSE de la dinámica de la membrana en el plano, se remite al lector a publicaciones dedicadas a la espectroscopia de espín-eco de neutrones de incidencia de pastoreo (GINSES)55,56 y otros estudios de pilas de membrana multilamelar alineadas57,58,59,60.
Para simplificar, este artículo destaca tres esquemas diferentes de deuteración de membrana ilustrados en un sistema de bicapa lipídica de formación de dominios o separación de fases bien estudiado de mezclas de 1,2-ditiristoil-sn-glicero-3-fosfocolina (DMPC) y 1,2-distearoil-sn-glicero-3-fosfocolina (DSPC)61,62. Los dos lípidos se caracterizan por un desajuste en la longitud de su cadena de hidrocarburos (14 carbonos/cola en DMPC vs 18 carbonos/cola en DSPC) y su temperatura de transición gel-fluido (Tm, DMPC = 23 °C vs Tm, DSPC = 55 °C). Esto da como resultado la separación de fases laterales en membranas DMPC:DSPC a temperaturas entre las temperaturas de transición superior e inferior de la mezcla63. Los esquemas de deuteración considerados aquí se eligen para demostrar los diferentes modos dinámicos accesibles en las mediciones de NSE en membranas liposomales, a saber, fluctuaciones de flexión, fluctuaciones de espesor y fluctuaciones selectivas de flexión / espesor de dominios laterales. Todas las composiciones lipídicas se informan para las bicapas DMPC:DSPC preparadas a una fracción molar de 70:30, utilizando variantes protiated y perdeuteradas disponibles comercialmente de DMPC y DSPC. Todos los pasos de preparación de la muestra se basan en 4 mL de suspensión liposomal, en D2O, con una concentración de lípidos de 50 mg/mL, para una masa lipídica total de Mtot = 200 mg por muestra.
Protocol
Representative Results
Discussion
NSE es una técnica poderosa y única en la medición de la dinámica mesoscópica de las membranas lipídicas bajo diversas condiciones. La utilización efectiva de NSE depende de la calidad de la muestra, el contraste de neutrones y el rango de dinámica accesible que se puede sondear para una muestra determinada. Por lo tanto, se requieren varios pasos críticos para realizar experimentos exitosos de NSE y recopilar datos de alta calidad. Un paso clave para garantizar el uso efectivo del tiempo de haz de neutrones dur…
Divulgations
The authors have nothing to disclose.
Acknowledgements
R. Ashkar gracias M. Nagao, L.-R. Stingaciu y P. Zolnierczuk por muchas discusiones útiles y por su frecuente asistencia con experimentos de NSE en sus respectivas líneas de haz. Los autores reconocen el uso de espectrómetros de eco de espín de neutrones en NIST y ORNL. El espectrómetro NSE en el NIST cuenta con el apoyo del Centro de Dispersión de Neutrones de Alta Resolución, una asociación entre el Instituto Nacional de Estándares y Tecnología y la Fundación Nacional de Ciencias bajo el acuerdo no. DMR-1508249. El espectrómetro NSE en la fuente de neutrones de espalación de ORNL cuenta con el apoyo de la División de Instalaciones de Usuarios Científicos, Oficina de Ciencias Básicas de la Energía, Departamento de Energía de los Estados Unidos. El Laboratorio Nacional de Oak Ridge es administrado por UT-Battelle, LLC bajo el Contrato No. DE-AC05-00OR22725.
Materials
| Chloroform (biotech grade) | Sigma Aldrich | 496189 | Biotech. grade, ≥99.8%, contains 0.5-1.0% ethanol as stabilizer |
| Circulating water bath | Julabo | SE-12 | Heating Circulator with smart pump, programmable temperature settings, and external sensor connection for measurement and control |
| Deuterium Oxide | Cambridge Isotopes Laboratories | DLM-4 | Deuterated water; Heavy water (D2O) (D, 99.9%) |
| Digital Semi-Microbalance | Mettler Toledo | MS105 | Semi-micro balance with 120 g capacity, 0.01 mg readability, high resolution weighing cell, ergonomic doors, and pipette-check application |
| Ethanol (molecular biology grade) | Sigma Aldrich | E7023 | 200 proof ethanol for molecular biology applications |
| Glass Pipets | VWR | 36360-536 | Disposable Soda Lime glass Pasteur pipets |
| Glass Vials | Thermo Scientific | B7990-1 | Borosilicate glass vials with PTFE/Silione septum caps |
| Lab grade freezer | Fisher Scientific | IU2886D | Ultra-low temprature freezer (-86 to -50 C) for long-term storage of lipids and proteins |
| Lipids (protaited or perdeuterated) | Avanti Polar Lipids | varies by lipid | Lipids can be purchased from Avanti in powder form or in a chloroform solution with the required amounts and deuteration schemes. |
| Millipore water purifier | Millipore Sigma | ZRQSVP3US | Direct-Q® 3 UV Water Purification System which deliver both pure and ultrapure water with a built-in UV lamp to reduce the levels of organics for biological applications |
| Mini Extruder Set | Avanti Polar Lipids | 610020 | Mini-extruder set includes mini-extruder, heating block, 2 GasTight Syringes, and 2 O-rings, Polycarbonate Membranes, and Filter Supports |
| Quick Connect Fittings | Grainger | 2YDA1 and 2YDA7 | Push-button tube fittings for QuickConnect water circulation applications, e.g. high temperature vesicle extrusion |
| Syringe Pump | SyringePump.com | New Era-1000 | Fully programmable syringe pump for infusion and withdrawal; programs up to 41 pumping phases with adjustable pumping rates, dispensed volumes, and extrusion cycles |
| Ultrasonic bath | Fisher Scientific | CPX2800 | Temperature controlled ultra sonic bath with programmable functionality for degassing and ultrasonic applications |
| Vacuum Oven | Thermo Scientific | 3608 | 0.7 cu ft vaccum oven with built-in-high-limit thermostat guards against overheating |
| Vortex Mixer | Fisher Scientific | 02-215-414 | Variable speed, analog control that allows low rpm start-up for gentle shaking or high-speed mixing for vigorous vortexing of samples |
References
- Singer, S. J., Nicolson, G. L. The fluid mosaic model of the structure of cell membranes. Science. 175 (4023), 720-731 (1972).
- Andersen, O. S., Koeppe, R. E. Bilayer thickness and membrane protein function: an energetic perspective. Annual Review of Biophysics and Biomolecular Structure. 36, 107-130 (2007).
- Lundbæk, J. A., Collingwood, S. A., Ingólfsson, H. I., Kapoor, R., Andersen, O. S. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. Journal of The Royal Society Interface. 7 (44), 373-395 (2010).
- Bradley, R. P., Radhakrishnan, R. Curvature-undulation coupling as a basis for curvature sensing and generation in bilayer membranes. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 117-124 (2016).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418 (6901), 942-948 (2002).
- Jensen, M. &. #. 2. 1. 6. ;., Mouritsen, O. G. Lipids do influence protein function-the hydrophobic matching hypothesis revisited. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1666 (1-2), 205-226 (2004).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118 (6), 1099-1102 (2005).
- Katchalsky, A., Spangler, R. Dynamics of membrane processes. Quarterly Reviews of Biophysics. 1 (2), 127-175 (1968).
- Rheinstädter, M. C. Collective molecular dynamics in proteins and membranes (Review). Biointerphases. 3 (2), 83-90 (2008).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1082 (2002).
- Hac, A. E., Seeger, H. M., Fidorra, M., Heimburg, T. Diffusion in two-component lipid membranes–a fluorescence correlation spectroscopy and monte carlo simulation study. Biophysical Journal. 88 (1), 317-333 (2005).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proceedings of the National Academy of Sciences of the United States of America. 107 (16), 7208-7213 (2010).
- Hormel, T. T., Kurihara, S. Q., Brennan, M. K., Wozniak, M. C., Parthasarathy, R. Measuring lipid membrane viscosity using rotational and translational probe diffusion. Physical Review Letters. 112 (18), 188101 (2014).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Bassereau, P., Sorre, B., Lévy, A. Bending lipid membranes: Experiments after W. Helfrich’s model. Advances in Colloid and Interface Science. 208, 47-57 (2014).
- Monzel, C., Sengupta, K. Measuring shape fluctuations in biological membranes. Journal of Physics D: Applied Physics. 49 (24), 243002 (2016).
- Deserno, M. Mesoscopic membrane physics: concepts, simulations, and selected applications. Macromolecular Rapid Communications. 30 (9-10), 752-771 (2009).
- Reynwar, B. J., et al. Aggregation and vesiculation of membrane proteins by curvature-mediated interactions. Nature. 447 (7143), 461-464 (2007).
- Haswell, E. S., Phillips, R., Rees, D. C. Mechanosensitive channels: what can they do and how do they do it. Structure. 19 (10), 1356-1369 (2011).
- Phillips, R., Ursell, T., Wiggins, P., Sens, P. Emerging roles for lipids in shaping membrane-protein function. Nature. 459 (7245), 379-385 (2009).
- Dill, K. A., Chan, H. S. From Levinthal to pathways to funnels. Nature Structural Biology. 4 (1), 10-19 (1997).
- Henzler-Wildman, K., Kern, D. Dynamic personalities of proteins. Nature. 450 (7172), 964-972 (2007).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Lyman, E., Hsieh, C. -. L., Eggeling, C. From dynamics to membrane organization: experimental breakthroughs occasion a “modeling manifesto”. Biophysical Journal. 115 (4), 595-604 (2018).
- Arriaga, L. R., et al. Dissipative curvature fluctuations in bilayer vesicles: Coexistence of pure-bending and hybrid curvature-compression modes. The European Physical Journal. E, Soft Matter. 31 (1), 105-113 (2010).
- Honerkamp-Smith, A. R., Veatch, S. L., Keller, S. L. An introduction to critical points for biophysicists; observations of compositional heterogeneity in lipid membranes. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1788 (1), 53-63 (2009).
- Veatch, S. L., Keller, S. L. Organization in lipid membranes containing cholesterol. Physical Review Letters. 89 (26), 268101 (2002).
- Heberle, F. A., et al. Bilayer thickness mismatch controls domain size in model membranes. Journal of the American Chemical Society. 135 (18), 6853-6859 (2013).
- Nickels, J. D., et al. The in vivo structure of biological membranes and evidence for lipid domains. PLOS Biology. 15 (5), 2002214 (2017).
- Simons, K., Ikonen, E. Functional rafts in cell membranes. Nature. 387 (6633), 569-572 (1997).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews. Molecular Cell Biology. 9 (2), 112-124 (2008).
- Liu, S. -. L., et al. Orthogonal lipid sensors identify transbilayer asymmetry of plasma membrane cholesterol. Nature Chemical Biology. 13, 268 (2016).
- Rothman, J., Lenard, J. Membrane asymmetry. Science. 195 (4280), 743-753 (1977).
- Ashkar, R., et al. Neutron scattering in the biological sciences: progress and prospects. Acta Crystallographica Section D. 74 (12), 1129-1168 (2018).
- Woodka, A. C., Butler, P. D., Porcar, L., Farago, B., Nagao, M. Lipid bilayers and membrane dynamics: insight into thickness fluctuations. Physical Review Letters. 109 (5), 058102 (2012).
- Chakraborty, S., et al. How cholesterol stiffens unsaturated lipid membranes. Proceedings of the National Academy of Sciences of the United States of America. 117 (36), 21896-21905 (2020).
- Arriaga, L. R., et al. Stiffening effect of cholesterol on disordered lipid phases: a combined neutron spin echo + dynamic light scattering analysis of the bending elasticity of large unilamellar vesicles. Biophysical Journal. 96 (9), 3629-3637 (2009).
- Nagao, M., Kelley, E. G., Ashkar, R., Bradbury, R., Butler, P. D. Probing elastic and viscous properties of phospholipid bilayers using neutron spin echo spectroscopy. The Journal of Physical Chemistry Letters. 8 (19), 4679-4684 (2017).
- Kelley, E. G., Butler, P. D., Ashkar, R., Bradbury, R., Nagao, M. Scaling relationships for the elastic moduli and viscosity of mixed lipid membranes. Proceedings of the National Academy of Sciences of the United States of America. 117 (38), 23365-23373 (2020).
- Rickeard, B. W., et al. Transverse lipid organization dictates bending fluctuations in model plasma membranes. Nanoscale. 12 (3), 1438-1447 (2020).
- Nickels, J. D., et al. Mechanical properties of nanoscopic lipid domains. Journal of the American Chemical Society. 137 (50), 15772-15780 (2015).
- Mezei, F. Neutron spin echo: A new concept in polarized thermal neutron techniques. Zeitschrift für Physik A Hadrons and Nuclei. 255 (2), 146-160 (1972).
- Hayter, J. B., Penfold, J. Neutron spin-echo integral transform spectroscopy. Zeitschrift für Physik B Condensed Matter. 35 (2), 199-205 (1979).
- Monkenbusch, M., Richter, D., Imae, T., Kanaya, T., Furusaka, M., Torikai, N. . Neutrons in Soft Matter. , 147-182 (2011).
- Pynn, R., Mezei, F., Pappas, C., Gutberlet, T. . Neutron Spin Echo. , 159-177 (2003).
- Holderer, O., et al. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 19 (3), 034022 (2008).
- Schleger, P., et al. The long-wavelength neutron spin-echo spectrometer IN15 at the Institut Laue-Langevin. Physica B: Condensed Matter. 241-243, 164-165 (1997).
- Holderer, O., Zolnierczuk, P., Pasini, S., Stingaciu, L., Monkenbusch, M. A better view through new glasses: Developments at the Jülich neutron spin echo spectrometers. Physica B: Condensed Matter. 562, 9-12 (2019).
- Farago, B., et al. The IN15 upgrade. Neutron News. 26 (3), 15-17 (2015).
- Ashkar, R. Selective dynamics in polymeric materials: Insights from quasi-elastic neutron scattering spectroscopy. Journal of Applied Physics. 127 (15), 151101 (2020).
- Pasini, S., Holderer, O., Kozielewski, T., Richter, D., Phoenix Monkenbusch, M. J-NSE- Phoenix, a neutron spin-echo spectrometer with optimized superconducting precession coils at the MLZ in Garching. Review of Scientific Instruments. 90 (4), 043107 (2019).
- Svergun, D. I., Koch, M. H. J., Timmins, P. A., May, R. P. . Small Angle X-Ray and Neutron Scattering from Solutions of Biological Macromolecules. , (2013).
- Eicher, B., et al. Joint small-angle X-ray and neutron scattering data analysis of asymmetric lipid vesicles. Journal of Applied Crystallography. 50 (2), 419-429 (2017).
- Heberle, F. A., et al. Model-based approaches for the determination of lipid bilayer structure from small-angle neutron and X-ray scattering data. European Biophysics Journal. 41 (10), 875-890 (2012).
- Jaksch, S., Koutsioubas, A., Mattauch, S., Holderer, O., Frielinghaus, H. Long-range excitations in phospholipid membranes. Chemistry and Physics of Lipids. 225, 104788 (2019).
- Jaksch, S., et al. Influence of ibuprofen on phospholipid membranes. Physical Review E. 91 (2), 022716 (2015).
- Armstrong, C. L., et al. Effect of cholesterol on the lateral nanoscale dynamics of fluid membranes. European Biophysics Journal. 41 (10), 901-913 (2012).
- Rheinstädter, M. C., Häußler, W., Salditt, T. Dispersion relation of lipid membrane shape fluctuations by neutron spin-echo spectrometry. Physical Review Letters. 97 (4), 048103 (2006).
- Armstrong, C. L., Häußler, W., Seydel, T., Katsaras, J., Rheinstädter, M. C. Nanosecond lipid dynamics in membranes containing cholesterol. Soft Matter. 10 (15), 2600-2611 (2014).
- Nickels, J. D., et al. Lipid rafts: buffers of cell membrane physical properties. The Journal of Physical Chemistry B. 123 (9), 2050-2056 (2019).
- Michonova-Alexova, E. I., Sugár, I. P. Component and state separation in DMPC/DSPC lipid bilayers: a Monte Carlo simulation study. Biophysical Journal. 83 (4), 1820-1833 (2002).
- Sugár, I. P., Thompson, T. E., Biltonen, R. L. Monte Carlo simulation of two-component bilayers: DMPC/DSPC mixtures. Biophysical Journal. 76 (4), 2099-2110 (1999).
- Mabrey, S., Sturtevant, J. M. Investigation of phase transitions of lipids and lipid mixtures by sensitivity differential scanning calorimetry. Proceedings of the National Academy of Sciences. 73 (11), 3862-3866 (1976).
- . Neutron activation and scattering calculator Available from: https://www.ncnr.nist.gov/resources/activation/ (2021)
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Ashkar, R., et al. Tuning membrane thickness fluctuations in model lipid bilayers. Biophysical Journal. 109 (1), 106-112 (2015).
- Carrillo, J. -. M. Y., Katsaras, J., Sumpter, B. G., Ashkar, R. A computational approach for modeling neutron scattering data from lipid bilayers. Journal of Chemical Theory and Computation. 13 (2), 916-925 (2017).
- Azuah, R. T. DAVE: a comprehensive software suite for the reduction, visualization, and analysis of low energy neutron spectroscopic data. Journal of Research of the National Institute of Standards and Technology. 114 (6), 341-358 (2009).
- Van Hove, L. Correlations in space and time and born approximation scattering in systems of interacting particles. Physical Review. 95 (1), 249-262 (1954).
- Zilman, A. G., Granek, R. Undulations and dynamic structure factor of membranes. Physical Review Letters. 77 (23), 4788-4791 (1996).
- Kelley, E. G., Butler, P. D., Nagao, M. . Collective dynamics in model biological membranes measured by neutron spin echo spectroscopy. , 131-176 (2019).
- Zheng, Y., Michihiro, N., Dobrin, P. B. Bending elasticity of saturated and monounsaturated phospholipid membranes studied by the neutron spin echo technique. Journal of Physics: Condensed Matter. 21 (15), 155104 (2009).
- Sharma, V. K., Qian, S. Effect of an antimicrobial peptide on lateral segregation of lipids: a structure and dynamics study by neutron scattering. Langmuir. 35 (11), 4152-4160 (2019).
- Boggara, M. B., Faraone, A., Krishnamoorti, R. Effect of pH and Ibuprofen on the Phospholipid Bilayer Bending Modulus. The Journal of Physical Chemistry B. 114 (24), 8061-8066 (2010).
- Lee, J. -. H., et al. Thermal fluctuation and elasticity of lipid vesicles interacting with pore-forming peptides. Physical Review Letters. 105 (3), 038101 (2010).
- Chakraborty, S., Abbasi, A., Bothun, G. D., Nagao, M., Kitchens, C. L. Phospholipid bilayer softening due to hydrophobic gold nanoparticle inclusions. Langmuir. 34 (44), 13416-13425 (2018).
- Hoffmann, I., et al. Softening of phospholipid membranes by the adhesion of silica nanoparticles – as seen by neutron spin-echo (NSE). Nanoscale. 6 (12), 6945-6952 (2014).
- Watson, M. C., Brown, F. L. H. Interpreting membrane scattering experiments at the mesoscale: the contribution of dissipation within the bilayer. Biophysical Journal. 98 (6), 9-11 (2010).
- Seifert, U., Langer, S. A. Viscous modes of fluid bilayer membranes. Europhysics Letters (EPL). 23 (1), 71-76 (1993).
- Bingham, R. J., Smye, S. W., Olmsted, P. D. Dynamics of an asymmetric bilayer lipid membrane in a viscous solvent. EPL (Europhysics Letters). 111 (1), 18004 (2015).
- Rawicz, W., Olbrich, K. C., McIntosh, T., Needham, D., Evans, E. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophysical Journal. 79 (1), 328-339 (2000).
- Doktorova, M., LeVine, M. V., Khelashvili, G., Weinstein, H. A new computational method for membrane compressibility: bilayer mechanical thickness revisited. Biophysical Journal. 116 (3), 487-502 (2019).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. The Journal of Physical Chemistry. 91 (16), 4219-4228 (1987).
- Lesieur, S., Grabielle-Madelmont, C., Paternostre, M. T., Ollivon, M. Size analysis and stability study of lipid vesicles by high-performance gel exclusion chromatography, turbidity, and dynamic light scattering. Analytical Biochemistry. 192 (2), 334-343 (1991).
- Heberle, F. A., et al. Direct label-free imaging of nanodomains in biomimetic and biological membranes by cryogenic electron microscopy. Proceedings of the National Academy of Sciences of the United States of America. 117 (33), 19943-19952 (2020).
- Cornell, C. E., Mileant, A., Thakkar, N., Lee, K. K., Keller, S. L. Direct imaging of liquid domains in membranes by cryo-electron tomography. Proceedings of the National Academy of Sciences of the United States of America. 117 (33), 19713-19719 (2020).
- Yao, X., Fan, X., Yan, N. Cryo-EM analysis of a membrane protein embedded in the liposome. Proceedings of the National Academy of Sciences of the United States of America. 117 (31), 18497-18503 (2020).
- Kučerka, N., Nieh, M. -. P., Katsaras, J. Fluid phase lipid areas and bilayer thicknesses of commonly used phosphatidylcholines as a function of temperature. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1808 (11), 2761-2771 (2011).
- Nielsen, J. E., Bjørnestad, V. A., Lund, R. Resolving the structural interactions between antimicrobial peptides and lipid membranes using small-angle scattering methods: the case of indolicidin. Soft Matter. 14 (43), 8750-8763 (2018).
- Kučerka, N., et al. Lipid bilayer structure determined by the simultaneous analysis of neutron and X-ray scattering data. Biophysical Journal. 95 (5), 2356-2367 (2008).
- Kelley, E. G., Butler, P. D., Nagao, M. Scaling of lipid membrane rigidity with domain area fraction. Soft Matter. 15 (13), 2762-2767 (2019).
- Brüning, B. -. A., et al. Bilayer undulation dynamics in unilamellar phospholipid vesicles: Effect of temperature, cholesterol and trehalose. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1838 (10), 2412-2419 (2014).
- Kučerka, N., et al. Areas of monounsaturated diacylphosphatidylcholines. Biophysical Journal. 97 (7), 1926-1932 (2009).
- Sharma, V. K., Mamontov, E., Anunciado, D. B., O’Neill, H., Urban, V. S. Effect of antimicrobial peptide on the dynamics of phosphocholine membrane: role of cholesterol and physical state of bilayer. Soft Matter. 11 (34), 6755-6767 (2015).
- Kelley, E. G., Butler, P. D., Nagao, M. Collective dynamics in lipid membranes containing transmembrane peptides. Soft Matter. , (2021).
- Yu, J., et al. Structure and dynamics of lipid membranes interacting with antivirulence end-phosphorylated polyethylene glycol block copolymers. Soft Matter. 16 (4), 983-989 (2020).
- Stingaciu, L. -. R., et al. Revealing the dynamics of thylakoid membranes in living cyanobacterial cells. Scientific Reports. 6 (1), 19627 (2016).
- Stingaciu, L. -. R., O’Neill, H. M., Liberton, M., Pakrasi, H. B., Urban, V. S. Influence of chemically disrupted photosynthesis on cyanobacterial thylakoid dynamics in synechocystis sp. PCC 6803. Scientific Reports. 9 (1), 5711 (2019).
- Miller, I. R. Energetics of fluctuation in lipid bilayer thickness. Biophysical Journal. 45 (3), 643-644 (1984).
- Nagao, M. Observation of local thickness fluctuations in surfactant membranes using neutron spin echo. Physical Review E. 80 (3), 031606 (2009).

