النيوترون تدور صدى الطيف كمسبار فريد لديناميات الغشاء الدهني والتفاعلات الغشاء البروتين
Summary
تصف هذه الورقة بروتوكولات إعداد العينات، والحد من البيانات، وتحليل البيانات في دراسات صدى الدوران النيوتروني (NSE) للأغشية الدهنية. تمكن وسمة الديوتريوم الحكيمة للدهون من الوصول إلى ديناميكيات غشاء مختلفة على الطول والمقاييس الزمنية بالمنظار ، والتي تحدث عليها العمليات البيولوجية الحيوية.
Abstract
تشكل الطبقات ثنائية الدهون المصفوفة الرئيسية لأغشية الخلايا وهي المنصة الأساسية لتبادل العناصر الغذائية ، والتفاعلات بين البروتين والغشاء ، والفيروسية الناشئة ، من بين عمليات خلوية حيوية أخرى. للنشاط البيولوجي الفعال، يجب أن تكون أغشية الخلايا جامدة بما يكفي للحفاظ على سلامة الخلية ومقصوراتها ولكنها سائلة بما يكفي للسماح لمكونات الأغشية، مثل البروتينات والمجالات الوظيفية، بالانتشراط والتفاعل. هذا التوازن الدقيق لخصائص الأغشية المرنة والسائلة ، وتأثيرها على الوظيفة البيولوجية ، يتطلب فهما أفضل لديناميكيات الأغشية الجماعية على طول الغشاء التنظيري والمقاييس الزمنية للعمليات البيولوجية الرئيسية ، على سبيل المثال ، تشوهات الأغشية وأحداث ربط البروتين. من بين التقنيات التي يمكن أن تحقق بشكل فعال هذا النطاق الديناميكي هو النيوترون صدى دوران (NSE) الطيفية. جنبا إلى جنب مع وضع العلامات الديوتريوم، يمكن استخدام NSE للوصول مباشرة الانحناء وتقلبات سمك، فضلا عن ديناميات التنظير من ميزات غشاء مختارة. تقدم هذه الورقة وصفا موجزا لتقنية NSE وتحدد إجراءات إجراء تجارب NSE على الأغشية الدهنية ، بما في ذلك تفاصيل إعداد العينات ومخططات الديوتر ، إلى جانب تعليمات لجمع البيانات والحد منها. كما تقدم الورقة أساليب تحليل البيانات المستخدمة لاستخراج معلمات الغشاء الرئيسية، مثل معامل صلابة الانحناء، ومعامل ضغط المنطقة، واللزوجة داخل الطائرة. لتوضيح الأهمية البيولوجية لدراسات NSE ، تتم مناقشة أمثلة مختارة من الظواهر الغشائية التي بحثتها NSE ، وهي تأثير الإضافات على صلابة الانحناء الغشائي ، وتأثير تكوين المجال على تقلبات الأغشية ، والتوقيع الديناميكي للتفاعلات بين الغشاء والبروتين.
Introduction
تطور فهم أغشية الخلايا ووظيفتها بشكل ملحوظ على مدى العقود القليلة الماضية. وقد تحولت النظرة السابقة لأغشية الخلايا كثنائيات الدهون السلبية التي تحدد حدود الخلايا وبروتينات غشاء المنزل1 تدريجيا إلى نموذج ديناميكي تلعب فيه الطبقات ثنائية الدهون دورا مهما في تنظيم العمليات البيولوجية الحيوية ، بما في ذلك الإشارات الخلوية والتبادل الجزيئي ووظيفة البروتين – على سبيل المثاللا الحصر2و3و4و5و6. هذا الإدراك بأن أغشية الخلايا ديناميكية للغاية ، وتخضع باستمرار لإعادة العرض وإعادة التوزيع الجزيئي ، وقد حث الاستكشافات العلمية وراء هياكل التوازن للأغشية7و8و9. وبناء على ذلك، تم تطوير نهج متعددة لدراسة مختلف الأنماط الديناميكية في الأغشية الدهنية البيولوجية والحيوى. حتى الآن، ركزت غالبية هذه الدراسات في المقام الأول على نشر الحركات الجزيئية10،11،12،13 وتقلبات الشكل العياني14،15،16، مما يترك فجوة كبيرة في فهم ديناميات الأغشية المتوسطة ، أي التقلبات الجماعية لجمعيات الدهون التي تتكون من عدد قليل من 10-100s من جزيئات الدهون. تحدث هذه الديناميكيات على مقاييس طول من عشرات قليلة إلى عدد قليل من 100 Å وعلى مدى المقاييس الزمنية من ns الفرعية إلى بضع مئات من ns (انظر الشكل 1)، ويشار إليها هنا باسم جداول التنظير. هو حقا على هذا ميزان أن نشاط رئيسية أحيائية يتم في الغشاء مستوى17. وهذا يشمل الفيروسية الناشئة18، قناة gating19، والتفاعلات الغشاء البروتين20. من المهم أيضا الإشارة إلى أن مشهد الطاقة للبروتينات الغشائية21،22 يظهر أن التغيرات التوافقية في البروتينات – الضرورية لدورها التنظيمي – تحدث على مدى المقاييس الزمنية23 من تقلبات الأغشية الجماعية ، مما يؤكد كذلك على أهمية الديناميكيات التنظيرية في الوظيفة البيولوجية لأغشية الخلايا ونظائرها ذات الأغشية الحيوية20. تركز هذه الورقة على الوضعين الديناميكيين الأساسيين بالمنظار في الأغشية الدهنية ، وهما تقلبات الانحناء وتقلبات السماكة.
ويتمثل التحدي الرئيسي في التحقيق المباشر في أوضاع التقلبات هذه في صعوبة الوصول في الوقت نفسه إلى مقاييسها المكانية والزمنية باستخدام أساليب التحليل الطيفي القياسية. والتحدي الآخر هو أن تقنيات الاتصال المباشر يمكن أن تؤثر على نفس التقلبات التي يقصد بها قياس16. ومما يزيد من تفاقم هذا التعقيد التركيبي والهيكلي للأغشية البيولوجية24،25، مما يؤدي إلى ميزات غشاء غير متجانسة ، بما في ذلك تشكيل المجال الدهني26،27،28،29،30 وعدم تناسق الأغشية31،32،33– مما يتطلب تحقيقات انتقائية لفهم ديناميات ميزات الأغشية المختلفة. لحسن الحظ ، يمكن التغلب على هذه التحديات باستخدام طرق التحليل الطيفي النيوتروني غير الغازية ، مثل صدى الدوران النيوتروني (NSE) ، والتي تدخل بطبيعتها إلى الطول والمقاييس الزمنية المطلوبة ، وتمكن من إجراء دراسات حول ميزات الغشاء الانتقائي دون تغيير بيئتها الفيزيائيةالكيميائية 34. في الواقع ، على مدى السنوات القليلة الماضية تطور التحليل الطيفي NSE إلى مسبار فريد وقوي من ديناميكيات الغشاء الجماعي35. وقد أنتجت نتائج دراسات NSE على الأغشية الدهنية رؤى جديدة فيالميكانيكية 36،37 وviscoelastic38،39 خصائص الأغشية الدهنية وألقت ضوءا جديدا على دورها المحتمل في الوظيفة البيولوجية40،41.
تعتمد تقنية التحليل الطيفي NSE على تصميم أداة التداخل ، الذي اقترحه Mezei42لأول مرة ، باستخدام سلسلة من الزعانف الدوارة واللفائف المغناطيسية للتحكم في مقدمة الدوران النيوتروني أثناء اجتياز النيوترونات للجهاز. يعتمد التصميم على النسخ المتطابق المغناطيسي لعناصر المجال المغناطيسي فيما يتعلق بموضع العينة(الشكل 1A). وهذا يعني أنه في غياب تبادل الطاقة بين النيوترون والعينة ، يؤدي النيوترون نفس العدد من السبق الدوراني ، في اتجاهين متعاكسين ، في النصف الأول والثاني من الجهاز (لاحظ π الزعانف بين لفائف السبق). ونتيجة لذلك، تبقى حالة الدوران النهائية للنيوترون دون تغيير بالنسبة للدولة الأولية – وهي ظاهرة يشار إليها باسم الدوران صدى (انظر النيوترون الشفاف في الشكل 1A). ومع ذلك ، عندما يتفاعل النيوترون بنشاط مع العينة ، يعدل تبادل الطاقة عدد السبقات الدورانية في النصف الثاني من الجهاز ، مما يؤدي إلى حالة دوران نهائية مختلفة (انظر الشكل 1A). يتم الكشف عن هذا تجريبيا كخسارة في الاستقطاب ، كما سيظهر لاحقا في هذه الورقة. لمزيد من التفاصيل حول تقنية NSE ، يشار إلى القارئ إلى الأوراق الفنيةالمخصصة 42،43،44،45.
هنا، يتم تقديم وصف مبسط لتقديم تقدير تقريبي للطول والجداول الزمنية التي يمكن الوصول إليها مع NSE. يتم تحديد موازين الطول من خلال نطاق عمليات نقل الموجات القابلة للتحقيق، Q = 4π sin ο/λ، حيث 2ο هي زاوية التشتت و λ هو الطول الموجي النيوتروني. يمكن للمرء أن يرى أن يتم تعيين Q من قبل نطاق الطول الموجي ومدى دوران الذراع الثاني للمطياف (انظر الشكل 1A). نموذجي Q-rangeعلى مطياف NSE هو ~0.02-2 Å-146,47, وحتى 0.01-4 Å-1 مع الترقيات الأخيرة48,49, المقابلة لمقاييس المكانية من ~ 1-600 Å. من ناحية أخرى، يتم حساب مقياس الوقت الذي يمكن الوصول إليه من زاوية السبق الكلية (أو المرحلة) التي يكتسبها النيوترون داخل لفائف السبق المغناطيسي، ووجد أن50: 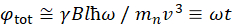 . في هذا التعبير، t هو الوقت فورييه
. في هذا التعبير، t هو الوقت فورييه 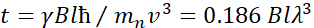 تعريفها بأنها ، حيث
تعريفها بأنها ، حيث 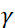 هي نسبة الدوران النيوتروني،
هي نسبة الدوران النيوتروني، 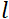 هو طول لفائف،
هو طول لفائف، 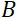 وقوة المجال المغناطيسي لللفائف. تجدر الإشارة إلى أن وقت فورييه هو كمية تعتمد بشكل صارم على هندسة الجهاز ، وقوة المجال المغناطيسي ، والطول الموجي النيوتروني. على سبيل المثال، باستخدام نيوترونات الطول الموجي
وقوة المجال المغناطيسي لللفائف. تجدر الإشارة إلى أن وقت فورييه هو كمية تعتمد بشكل صارم على هندسة الجهاز ، وقوة المجال المغناطيسي ، والطول الموجي النيوتروني. على سبيل المثال، باستخدام نيوترونات الطول الموجي 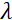 = 8 Å وإعدادات الصك
= 8 Å وإعدادات الصك 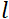 = 1.2 متر و
= 1.2 متر و 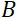 = 0.4 T، يتم حساب وقت فورييه ليكون t ~ 50 ns. تجريبيا، يتم ضبطها الوقت فورييه عن طريق تغيير التيار في لفائف قبل الخراج (أي قوة المجال المغناطيسي) أو باستخدام أطوال موجية نيوترونية مختلفة، مما أدى إلى جداول زمنية NSE نموذجية من ~ 1 PS إلى 100 ns. ومع ذلك، مكنت الترقيات الأخيرة في مطياف NSE الوصول إلى أوقات فورييه أطول، ما يصل إلى ~ 400 ns على مطياف J-NSE-Phoenix في هاينز ماير-ليبنيتز Zentrum51 ومطياف SNS-NSE في مختبر أوك ريدج الوطني48، وما يصل إلى ~ 1000 ns في مطياف NSE IN15 في معهد لو لانجفين (ILL)49.
= 0.4 T، يتم حساب وقت فورييه ليكون t ~ 50 ns. تجريبيا، يتم ضبطها الوقت فورييه عن طريق تغيير التيار في لفائف قبل الخراج (أي قوة المجال المغناطيسي) أو باستخدام أطوال موجية نيوترونية مختلفة، مما أدى إلى جداول زمنية NSE نموذجية من ~ 1 PS إلى 100 ns. ومع ذلك، مكنت الترقيات الأخيرة في مطياف NSE الوصول إلى أوقات فورييه أطول، ما يصل إلى ~ 400 ns على مطياف J-NSE-Phoenix في هاينز ماير-ليبنيتز Zentrum51 ومطياف SNS-NSE في مختبر أوك ريدج الوطني48، وما يصل إلى ~ 1000 ns في مطياف NSE IN15 في معهد لو لانجفين (ILL)49.
وإلى جانب الوصول المباشر إلى طول ديناميات الأغشية ونطاقها الزمني، فإن NSE لديها القدرات الكامنة في حساسية النظائر النيوترونية52. وعلى وجه التحديد، فإن قدرة النيوترونات على التفاعل بشكل مختلف مع نظائر الهيدروجين، وهو العنصر الأكثر وفرة في النظم البيولوجية، تؤدي إلى كثافة مختلفة لطول النيوترونات المتناثرة،34 أو NSLD (أي ما يعادل المؤشر البصري للانكسار50)،عندما يتم استبدال البروتيوم بالديوتريوم. وهذا يمكن من اتباع نهج يعرف باسم التباين التبايني، والذي يستخدم عادة لتسليط الضوء على ميزات غشاء محددة أو إخفاء الآخرين – ويشار إلى السيناريو الأخير على أنه مطابقة التباين. التطبيق المتكرر للتباين / المطابقة هو استبدال الماء (NSLD = -0.56 × 10-6 Å-2)بالماء الثقيل أو D2O (NSLD = 6 .4 × 10-6 Å-2)لتضخيم إشارة النيوترون من الأغشية الدهنية البروتية (NSLD ~ 0 × 10-6 Å-2). هذا النهج فعال للغاية في دراسات بنية الغشاء لأن اختراق D2O في منطقة مجموعة الرأس من الغشاء يسمح بتحديد دقيق لسماكة الغشاء (انظر الشكل 2A، اللوحة اليسرى) وموقع المجموعات الفرعية المختلفة للدهون عندما يتم تطبيق نماذج أكثر تطورا53،54. تسلط هذه الورقة الضوء على بعض الأمثلة على استخدام التباين في دراسات الديناميكيات الجماعية في الأغشية المحاكاة الحيوية وميزات الأغشية المختارة.
هنا ، تتجلى فعالية NSE في توفير رؤى فريدة في خصائص الأغشية الديناميكية والوظيفية من خلال أمثلة ملموسة لدراسات NSE على أنظمة أغشية الدهون النموذجية والوثيقة الصلة بيولوجيا مع التركيز على ديناميكيات مقياس المتوسط في الأغشية القائمة بذاتها ، في شكل تعليق ليبوسومي. بالنسبة لقياسات NSE لديناميكيات الأغشية داخل الطائرة ، يشار إلى القارئ إلى منشورات مخصصة حول التحليل الطيفي للنيوترونات الدورانية الصدى (GINSES)55و56 ودراسات أخرى لمداخن الأغشية متعددة اللاميلار المنحازة57و58و59و60.
للبساطة ، تسلط هذه الورقة الضوء على ثلاثة مخططات مختلفة من الديوتريشن الغشاء يتضح على تشكيل المجال مدروسة جيدا ، أو فصل المرحلة، نظام ثنائي الطبقات الدهون من 1،2-dimyristoyl-sn-glycero-3-فوسفوتشولين (DMPC) و 1،2-distearoyl-sn-glycero-3-فوسفوتشولين (DSPC) خلائط61،62. وتتميز الدهون اثنين من عدم تطابق في طول سلسلة الهيدروكربونات (14 الكربونات / الذيل في DMPC مقابل 18 الكربون / الذيل في DSPC) ودرجة الحرارة انتقال هلام السائل (TM، DMPC = 23 درجة مئوية مقابل Tم، DSPC = 55 درجة مئوية). وهذا يؤدي إلى فصل المرحلة الجانبية في DMPC: DSPC الأغشية في درجات الحرارة بين درجات الحرارة الانتقالية العليا والسفلى من الخليط63. يتم اختيار مخططات الديوتر التي تم النظر فيها هنا لإظهار الأنماط الديناميكية المختلفة التي يمكن الوصول إليها في قياسات NSE على الأغشية الدهنية ، وهي تقلبات الانحناء ، وتقلبات السماكة ، وتقلبات الانحناء / السماكة الانتقائية للمجالات الجانبية. يتم الإبلاغ عن جميع التراكيب الدهنية لDMPC: DSPC الطبقات الثنائية المعدة في جزء الخلد من 70:30، وذلك باستخدام المتغيرات المتاحة تجاريا بروتيات و perdeuterated من DMPC وDSPC. وتستند جميع خطوات إعداد العينة على 4 مل من تعليق الدهون، في D2O، مع تركيز الدهون من 50 ملغم / مل، لكتلة الدهون الإجمالية منتوت M= 200 ملغ لكل عينة.
Protocol
Representative Results
Discussion
NSE هي تقنية قوية وفريدة من نوعها في قياس الديناميات التنظيرية للأغشية الدهنية في ظل ظروف مختلفة. يعتمد الاستخدام الفعال ل NSE على جودة العينة والتباين النيوتروني ونطاق الديناميكيات التي يمكن الوصول إليها والتي يمكن بحثها لعينة معينة. وبالتالي، هناك العديد من الخطوات الحاسمة المطلوبة لإجر?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
ر. أشقر يشكر م. ناغاو، ل. ر. Stingaciu ، وP. Zolnierczuk لكثير من المناقشات المفيدة ومساعدتهم المتكررة مع التجارب NSE على خطوط الحزم الخاصة بهم. يعترف المؤلفون باستخدام مطياف صدى الدوران النيوتروني في NIST و ORNL. ويدعم مطياف NSE في NIST من قبل مركز تشتت النيوترونات عالية الدقة، وهي شراكة بين المعهد الوطني للمعايير والتكنولوجيا والمؤسسة الوطنية للعلوم بموجب الاتفاق رقم . DMR-1508249. ويدعم مطياف NSE في مصدر النيوترون Spallation ORNL من قبل شعبة مرافق المستخدمين العلميين، مكتب علوم الطاقة الأساسية، وزارة الطاقة الأمريكية. يتم إدارة مختبر أوك ريدج الوطني من قبل UT-Battelle، ذ.م.م بموجب عقد وزارة الكهرباء الأمريكية رقم دي-AC05-00OR22725.
Materials
| Chloroform (biotech grade) | Sigma Aldrich | 496189 | Biotech. grade, ≥99.8%, contains 0.5-1.0% ethanol as stabilizer |
| Circulating water bath | Julabo | SE-12 | Heating Circulator with smart pump, programmable temperature settings, and external sensor connection for measurement and control |
| Deuterium Oxide | Cambridge Isotopes Laboratories | DLM-4 | Deuterated water; Heavy water (D2O) (D, 99.9%) |
| Digital Semi-Microbalance | Mettler Toledo | MS105 | Semi-micro balance with 120 g capacity, 0.01 mg readability, high resolution weighing cell, ergonomic doors, and pipette-check application |
| Ethanol (molecular biology grade) | Sigma Aldrich | E7023 | 200 proof ethanol for molecular biology applications |
| Glass Pipets | VWR | 36360-536 | Disposable Soda Lime glass Pasteur pipets |
| Glass Vials | Thermo Scientific | B7990-1 | Borosilicate glass vials with PTFE/Silione septum caps |
| Lab grade freezer | Fisher Scientific | IU2886D | Ultra-low temprature freezer (-86 to -50 C) for long-term storage of lipids and proteins |
| Lipids (protaited or perdeuterated) | Avanti Polar Lipids | varies by lipid | Lipids can be purchased from Avanti in powder form or in a chloroform solution with the required amounts and deuteration schemes. |
| Millipore water purifier | Millipore Sigma | ZRQSVP3US | Direct-Q® 3 UV Water Purification System which deliver both pure and ultrapure water with a built-in UV lamp to reduce the levels of organics for biological applications |
| Mini Extruder Set | Avanti Polar Lipids | 610020 | Mini-extruder set includes mini-extruder, heating block, 2 GasTight Syringes, and 2 O-rings, Polycarbonate Membranes, and Filter Supports |
| Quick Connect Fittings | Grainger | 2YDA1 and 2YDA7 | Push-button tube fittings for QuickConnect water circulation applications, e.g. high temperature vesicle extrusion |
| Syringe Pump | SyringePump.com | New Era-1000 | Fully programmable syringe pump for infusion and withdrawal; programs up to 41 pumping phases with adjustable pumping rates, dispensed volumes, and extrusion cycles |
| Ultrasonic bath | Fisher Scientific | CPX2800 | Temperature controlled ultra sonic bath with programmable functionality for degassing and ultrasonic applications |
| Vacuum Oven | Thermo Scientific | 3608 | 0.7 cu ft vaccum oven with built-in-high-limit thermostat guards against overheating |
| Vortex Mixer | Fisher Scientific | 02-215-414 | Variable speed, analog control that allows low rpm start-up for gentle shaking or high-speed mixing for vigorous vortexing of samples |
References
- Singer, S. J., Nicolson, G. L. The fluid mosaic model of the structure of cell membranes. Science. 175 (4023), 720-731 (1972).
- Andersen, O. S., Koeppe, R. E. Bilayer thickness and membrane protein function: an energetic perspective. Annual Review of Biophysics and Biomolecular Structure. 36, 107-130 (2007).
- Lundbæk, J. A., Collingwood, S. A., Ingólfsson, H. I., Kapoor, R., Andersen, O. S. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. Journal of The Royal Society Interface. 7 (44), 373-395 (2010).
- Bradley, R. P., Radhakrishnan, R. Curvature-undulation coupling as a basis for curvature sensing and generation in bilayer membranes. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 117-124 (2016).
- Perozo, E., Cortes, D. M., Sompornpisut, P., Kloda, A., Martinac, B. Open channel structure of MscL and the gating mechanism of mechanosensitive channels. Nature. 418 (6901), 942-948 (2002).
- Jensen, M. &. #. 2. 1. 6. ;., Mouritsen, O. G. Lipids do influence protein function-the hydrophobic matching hypothesis revisited. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1666 (1-2), 205-226 (2004).
- Rajendran, L., Simons, K. Lipid rafts and membrane dynamics. Journal of Cell Science. 118 (6), 1099-1102 (2005).
- Katchalsky, A., Spangler, R. Dynamics of membrane processes. Quarterly Reviews of Biophysics. 1 (2), 127-175 (1968).
- Rheinstädter, M. C. Collective molecular dynamics in proteins and membranes (Review). Biointerphases. 3 (2), 83-90 (2008).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1082 (2002).
- Hac, A. E., Seeger, H. M., Fidorra, M., Heimburg, T. Diffusion in two-component lipid membranes–a fluorescence correlation spectroscopy and monte carlo simulation study. Biophysical Journal. 88 (1), 317-333 (2005).
- Heinrich, M., Tian, A., Esposito, C., Baumgart, T. Dynamic sorting of lipids and proteins in membrane tubes with a moving phase boundary. Proceedings of the National Academy of Sciences of the United States of America. 107 (16), 7208-7213 (2010).
- Hormel, T. T., Kurihara, S. Q., Brennan, M. K., Wozniak, M. C., Parthasarathy, R. Measuring lipid membrane viscosity using rotational and translational probe diffusion. Physical Review Letters. 112 (18), 188101 (2014).
- Dimova, R. Recent developments in the field of bending rigidity measurements on membranes. Advances in Colloid and Interface Science. 208, 225-234 (2014).
- Bassereau, P., Sorre, B., Lévy, A. Bending lipid membranes: Experiments after W. Helfrich’s model. Advances in Colloid and Interface Science. 208, 47-57 (2014).
- Monzel, C., Sengupta, K. Measuring shape fluctuations in biological membranes. Journal of Physics D: Applied Physics. 49 (24), 243002 (2016).
- Deserno, M. Mesoscopic membrane physics: concepts, simulations, and selected applications. Macromolecular Rapid Communications. 30 (9-10), 752-771 (2009).
- Reynwar, B. J., et al. Aggregation and vesiculation of membrane proteins by curvature-mediated interactions. Nature. 447 (7143), 461-464 (2007).
- Haswell, E. S., Phillips, R., Rees, D. C. Mechanosensitive channels: what can they do and how do they do it. Structure. 19 (10), 1356-1369 (2011).
- Phillips, R., Ursell, T., Wiggins, P., Sens, P. Emerging roles for lipids in shaping membrane-protein function. Nature. 459 (7245), 379-385 (2009).
- Dill, K. A., Chan, H. S. From Levinthal to pathways to funnels. Nature Structural Biology. 4 (1), 10-19 (1997).
- Henzler-Wildman, K., Kern, D. Dynamic personalities of proteins. Nature. 450 (7172), 964-972 (2007).
- Grimaldo, M., Roosen-Runge, F., Zhang, F., Schreiber, F., Seydel, T. Dynamics of proteins in solution. Quarterly Reviews of Biophysics. 52, 7 (2019).
- Lyman, E., Hsieh, C. -. L., Eggeling, C. From dynamics to membrane organization: experimental breakthroughs occasion a “modeling manifesto”. Biophysical Journal. 115 (4), 595-604 (2018).
- Arriaga, L. R., et al. Dissipative curvature fluctuations in bilayer vesicles: Coexistence of pure-bending and hybrid curvature-compression modes. The European Physical Journal. E, Soft Matter. 31 (1), 105-113 (2010).
- Honerkamp-Smith, A. R., Veatch, S. L., Keller, S. L. An introduction to critical points for biophysicists; observations of compositional heterogeneity in lipid membranes. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1788 (1), 53-63 (2009).
- Veatch, S. L., Keller, S. L. Organization in lipid membranes containing cholesterol. Physical Review Letters. 89 (26), 268101 (2002).
- Heberle, F. A., et al. Bilayer thickness mismatch controls domain size in model membranes. Journal of the American Chemical Society. 135 (18), 6853-6859 (2013).
- Nickels, J. D., et al. The in vivo structure of biological membranes and evidence for lipid domains. PLOS Biology. 15 (5), 2002214 (2017).
- Simons, K., Ikonen, E. Functional rafts in cell membranes. Nature. 387 (6633), 569-572 (1997).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews. Molecular Cell Biology. 9 (2), 112-124 (2008).
- Liu, S. -. L., et al. Orthogonal lipid sensors identify transbilayer asymmetry of plasma membrane cholesterol. Nature Chemical Biology. 13, 268 (2016).
- Rothman, J., Lenard, J. Membrane asymmetry. Science. 195 (4280), 743-753 (1977).
- Ashkar, R., et al. Neutron scattering in the biological sciences: progress and prospects. Acta Crystallographica Section D. 74 (12), 1129-1168 (2018).
- Woodka, A. C., Butler, P. D., Porcar, L., Farago, B., Nagao, M. Lipid bilayers and membrane dynamics: insight into thickness fluctuations. Physical Review Letters. 109 (5), 058102 (2012).
- Chakraborty, S., et al. How cholesterol stiffens unsaturated lipid membranes. Proceedings of the National Academy of Sciences of the United States of America. 117 (36), 21896-21905 (2020).
- Arriaga, L. R., et al. Stiffening effect of cholesterol on disordered lipid phases: a combined neutron spin echo + dynamic light scattering analysis of the bending elasticity of large unilamellar vesicles. Biophysical Journal. 96 (9), 3629-3637 (2009).
- Nagao, M., Kelley, E. G., Ashkar, R., Bradbury, R., Butler, P. D. Probing elastic and viscous properties of phospholipid bilayers using neutron spin echo spectroscopy. The Journal of Physical Chemistry Letters. 8 (19), 4679-4684 (2017).
- Kelley, E. G., Butler, P. D., Ashkar, R., Bradbury, R., Nagao, M. Scaling relationships for the elastic moduli and viscosity of mixed lipid membranes. Proceedings of the National Academy of Sciences of the United States of America. 117 (38), 23365-23373 (2020).
- Rickeard, B. W., et al. Transverse lipid organization dictates bending fluctuations in model plasma membranes. Nanoscale. 12 (3), 1438-1447 (2020).
- Nickels, J. D., et al. Mechanical properties of nanoscopic lipid domains. Journal of the American Chemical Society. 137 (50), 15772-15780 (2015).
- Mezei, F. Neutron spin echo: A new concept in polarized thermal neutron techniques. Zeitschrift für Physik A Hadrons and Nuclei. 255 (2), 146-160 (1972).
- Hayter, J. B., Penfold, J. Neutron spin-echo integral transform spectroscopy. Zeitschrift für Physik B Condensed Matter. 35 (2), 199-205 (1979).
- Monkenbusch, M., Richter, D., Imae, T., Kanaya, T., Furusaka, M., Torikai, N. . Neutrons in Soft Matter. , 147-182 (2011).
- Pynn, R., Mezei, F., Pappas, C., Gutberlet, T. . Neutron Spin Echo. , 159-177 (2003).
- Holderer, O., et al. The JCNS neutron spin-echo spectrometer J-NSE at the FRM II. Measurement Science and Technology. 19 (3), 034022 (2008).
- Schleger, P., et al. The long-wavelength neutron spin-echo spectrometer IN15 at the Institut Laue-Langevin. Physica B: Condensed Matter. 241-243, 164-165 (1997).
- Holderer, O., Zolnierczuk, P., Pasini, S., Stingaciu, L., Monkenbusch, M. A better view through new glasses: Developments at the Jülich neutron spin echo spectrometers. Physica B: Condensed Matter. 562, 9-12 (2019).
- Farago, B., et al. The IN15 upgrade. Neutron News. 26 (3), 15-17 (2015).
- Ashkar, R. Selective dynamics in polymeric materials: Insights from quasi-elastic neutron scattering spectroscopy. Journal of Applied Physics. 127 (15), 151101 (2020).
- Pasini, S., Holderer, O., Kozielewski, T., Richter, D., Phoenix Monkenbusch, M. J-NSE- Phoenix, a neutron spin-echo spectrometer with optimized superconducting precession coils at the MLZ in Garching. Review of Scientific Instruments. 90 (4), 043107 (2019).
- Svergun, D. I., Koch, M. H. J., Timmins, P. A., May, R. P. . Small Angle X-Ray and Neutron Scattering from Solutions of Biological Macromolecules. , (2013).
- Eicher, B., et al. Joint small-angle X-ray and neutron scattering data analysis of asymmetric lipid vesicles. Journal of Applied Crystallography. 50 (2), 419-429 (2017).
- Heberle, F. A., et al. Model-based approaches for the determination of lipid bilayer structure from small-angle neutron and X-ray scattering data. European Biophysics Journal. 41 (10), 875-890 (2012).
- Jaksch, S., Koutsioubas, A., Mattauch, S., Holderer, O., Frielinghaus, H. Long-range excitations in phospholipid membranes. Chemistry and Physics of Lipids. 225, 104788 (2019).
- Jaksch, S., et al. Influence of ibuprofen on phospholipid membranes. Physical Review E. 91 (2), 022716 (2015).
- Armstrong, C. L., et al. Effect of cholesterol on the lateral nanoscale dynamics of fluid membranes. European Biophysics Journal. 41 (10), 901-913 (2012).
- Rheinstädter, M. C., Häußler, W., Salditt, T. Dispersion relation of lipid membrane shape fluctuations by neutron spin-echo spectrometry. Physical Review Letters. 97 (4), 048103 (2006).
- Armstrong, C. L., Häußler, W., Seydel, T., Katsaras, J., Rheinstädter, M. C. Nanosecond lipid dynamics in membranes containing cholesterol. Soft Matter. 10 (15), 2600-2611 (2014).
- Nickels, J. D., et al. Lipid rafts: buffers of cell membrane physical properties. The Journal of Physical Chemistry B. 123 (9), 2050-2056 (2019).
- Michonova-Alexova, E. I., Sugár, I. P. Component and state separation in DMPC/DSPC lipid bilayers: a Monte Carlo simulation study. Biophysical Journal. 83 (4), 1820-1833 (2002).
- Sugár, I. P., Thompson, T. E., Biltonen, R. L. Monte Carlo simulation of two-component bilayers: DMPC/DSPC mixtures. Biophysical Journal. 76 (4), 2099-2110 (1999).
- Mabrey, S., Sturtevant, J. M. Investigation of phase transitions of lipids and lipid mixtures by sensitivity differential scanning calorimetry. Proceedings of the National Academy of Sciences. 73 (11), 3862-3866 (1976).
- . Neutron activation and scattering calculator Available from: https://www.ncnr.nist.gov/resources/activation/ (2021)
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Ashkar, R., et al. Tuning membrane thickness fluctuations in model lipid bilayers. Biophysical Journal. 109 (1), 106-112 (2015).
- Carrillo, J. -. M. Y., Katsaras, J., Sumpter, B. G., Ashkar, R. A computational approach for modeling neutron scattering data from lipid bilayers. Journal of Chemical Theory and Computation. 13 (2), 916-925 (2017).
- Azuah, R. T. DAVE: a comprehensive software suite for the reduction, visualization, and analysis of low energy neutron spectroscopic data. Journal of Research of the National Institute of Standards and Technology. 114 (6), 341-358 (2009).
- Van Hove, L. Correlations in space and time and born approximation scattering in systems of interacting particles. Physical Review. 95 (1), 249-262 (1954).
- Zilman, A. G., Granek, R. Undulations and dynamic structure factor of membranes. Physical Review Letters. 77 (23), 4788-4791 (1996).
- Kelley, E. G., Butler, P. D., Nagao, M. . Collective dynamics in model biological membranes measured by neutron spin echo spectroscopy. , 131-176 (2019).
- Zheng, Y., Michihiro, N., Dobrin, P. B. Bending elasticity of saturated and monounsaturated phospholipid membranes studied by the neutron spin echo technique. Journal of Physics: Condensed Matter. 21 (15), 155104 (2009).
- Sharma, V. K., Qian, S. Effect of an antimicrobial peptide on lateral segregation of lipids: a structure and dynamics study by neutron scattering. Langmuir. 35 (11), 4152-4160 (2019).
- Boggara, M. B., Faraone, A., Krishnamoorti, R. Effect of pH and Ibuprofen on the Phospholipid Bilayer Bending Modulus. The Journal of Physical Chemistry B. 114 (24), 8061-8066 (2010).
- Lee, J. -. H., et al. Thermal fluctuation and elasticity of lipid vesicles interacting with pore-forming peptides. Physical Review Letters. 105 (3), 038101 (2010).
- Chakraborty, S., Abbasi, A., Bothun, G. D., Nagao, M., Kitchens, C. L. Phospholipid bilayer softening due to hydrophobic gold nanoparticle inclusions. Langmuir. 34 (44), 13416-13425 (2018).
- Hoffmann, I., et al. Softening of phospholipid membranes by the adhesion of silica nanoparticles – as seen by neutron spin-echo (NSE). Nanoscale. 6 (12), 6945-6952 (2014).
- Watson, M. C., Brown, F. L. H. Interpreting membrane scattering experiments at the mesoscale: the contribution of dissipation within the bilayer. Biophysical Journal. 98 (6), 9-11 (2010).
- Seifert, U., Langer, S. A. Viscous modes of fluid bilayer membranes. Europhysics Letters (EPL). 23 (1), 71-76 (1993).
- Bingham, R. J., Smye, S. W., Olmsted, P. D. Dynamics of an asymmetric bilayer lipid membrane in a viscous solvent. EPL (Europhysics Letters). 111 (1), 18004 (2015).
- Rawicz, W., Olbrich, K. C., McIntosh, T., Needham, D., Evans, E. Effect of chain length and unsaturation on elasticity of lipid bilayers. Biophysical Journal. 79 (1), 328-339 (2000).
- Doktorova, M., LeVine, M. V., Khelashvili, G., Weinstein, H. A new computational method for membrane compressibility: bilayer mechanical thickness revisited. Biophysical Journal. 116 (3), 487-502 (2019).
- Evans, E., Needham, D. Physical properties of surfactant bilayer membranes: thermal transitions, elasticity, rigidity, cohesion and colloidal interactions. The Journal of Physical Chemistry. 91 (16), 4219-4228 (1987).
- Lesieur, S., Grabielle-Madelmont, C., Paternostre, M. T., Ollivon, M. Size analysis and stability study of lipid vesicles by high-performance gel exclusion chromatography, turbidity, and dynamic light scattering. Analytical Biochemistry. 192 (2), 334-343 (1991).
- Heberle, F. A., et al. Direct label-free imaging of nanodomains in biomimetic and biological membranes by cryogenic electron microscopy. Proceedings of the National Academy of Sciences of the United States of America. 117 (33), 19943-19952 (2020).
- Cornell, C. E., Mileant, A., Thakkar, N., Lee, K. K., Keller, S. L. Direct imaging of liquid domains in membranes by cryo-electron tomography. Proceedings of the National Academy of Sciences of the United States of America. 117 (33), 19713-19719 (2020).
- Yao, X., Fan, X., Yan, N. Cryo-EM analysis of a membrane protein embedded in the liposome. Proceedings of the National Academy of Sciences of the United States of America. 117 (31), 18497-18503 (2020).
- Kučerka, N., Nieh, M. -. P., Katsaras, J. Fluid phase lipid areas and bilayer thicknesses of commonly used phosphatidylcholines as a function of temperature. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1808 (11), 2761-2771 (2011).
- Nielsen, J. E., Bjørnestad, V. A., Lund, R. Resolving the structural interactions between antimicrobial peptides and lipid membranes using small-angle scattering methods: the case of indolicidin. Soft Matter. 14 (43), 8750-8763 (2018).
- Kučerka, N., et al. Lipid bilayer structure determined by the simultaneous analysis of neutron and X-ray scattering data. Biophysical Journal. 95 (5), 2356-2367 (2008).
- Kelley, E. G., Butler, P. D., Nagao, M. Scaling of lipid membrane rigidity with domain area fraction. Soft Matter. 15 (13), 2762-2767 (2019).
- Brüning, B. -. A., et al. Bilayer undulation dynamics in unilamellar phospholipid vesicles: Effect of temperature, cholesterol and trehalose. Biochimica et Biophysica Acta (BBA) – Biomembranes. 1838 (10), 2412-2419 (2014).
- Kučerka, N., et al. Areas of monounsaturated diacylphosphatidylcholines. Biophysical Journal. 97 (7), 1926-1932 (2009).
- Sharma, V. K., Mamontov, E., Anunciado, D. B., O’Neill, H., Urban, V. S. Effect of antimicrobial peptide on the dynamics of phosphocholine membrane: role of cholesterol and physical state of bilayer. Soft Matter. 11 (34), 6755-6767 (2015).
- Kelley, E. G., Butler, P. D., Nagao, M. Collective dynamics in lipid membranes containing transmembrane peptides. Soft Matter. , (2021).
- Yu, J., et al. Structure and dynamics of lipid membranes interacting with antivirulence end-phosphorylated polyethylene glycol block copolymers. Soft Matter. 16 (4), 983-989 (2020).
- Stingaciu, L. -. R., et al. Revealing the dynamics of thylakoid membranes in living cyanobacterial cells. Scientific Reports. 6 (1), 19627 (2016).
- Stingaciu, L. -. R., O’Neill, H. M., Liberton, M., Pakrasi, H. B., Urban, V. S. Influence of chemically disrupted photosynthesis on cyanobacterial thylakoid dynamics in synechocystis sp. PCC 6803. Scientific Reports. 9 (1), 5711 (2019).
- Miller, I. R. Energetics of fluctuation in lipid bilayer thickness. Biophysical Journal. 45 (3), 643-644 (1984).
- Nagao, M. Observation of local thickness fluctuations in surfactant membranes using neutron spin echo. Physical Review E. 80 (3), 031606 (2009).

