Análise de rastreamento de nanopartículas para a quantificação e determinação de tamanho de vesículos extracelulares
Summary
Demonstramos como usar um novo instrumento de análise de rastreamento de nanopartículas para estimar a distribuição de tamanho e concentração total de partículas de vesículas extracelulares isoladas do tecido adiposo de camundongos e plasma humano.
Abstract
Os papéis fisiológicos e fisiofisiológicos de vesículas extracelulares (EVs) tornaram-se cada vez mais reconhecidos, tornando o campo EV uma área de pesquisa em rápida evolução. Existem muitos métodos diferentes para o isolamento do EV, cada um com vantagens e desvantagens distintas que afetam o rendimento a jusante e a pureza dos EVs. Assim, caracterizar a preparação de EV isolada de uma determinada fonte por um método escolhido é importante para a interpretação dos resultados a jusante e comparação dos resultados entre laboratórios. Existem vários métodos para determinar o tamanho e a quantidade de EVs, que podem ser alterados por estados da doença ou em resposta a condições externas. A análise de rastreamento de nanopartículas (NTA) é uma das tecnologias proeminentes utilizadas para análise de alto rendimento de EVs individuais. Aqui, apresentamos um protocolo detalhado para quantificação e determinação de tamanho de EVs isolados do tecido adiposo do rato e plasma humano usando uma tecnologia inovadora para a NTA representando grandes avanços no campo. Os resultados demonstram que este método pode fornecer dados de concentração de partículas e tamanho totais reprodutíveis e válidos para EVs isolados de diferentes fontes usando diferentes métodos, conforme confirmado pela microscopia eletrônica de transmissão. A adaptação deste instrumento para a NTA abordará a necessidade de padronização nos métodos NTA para aumentar o rigor e a reprodutibilidade na pesquisa de EV.
Introduction
As vesículas extracelulares (EVs) são pequenas (0,03-2 μm) de vesículas ligadas à membrana secretadas por quase todos os tipos de células1. Eles são frequentemente referidos como “exossomos”, “microvesículos” ou “corpos apoptóticos” dependendo de seu mecanismo de liberação e tamanho2. Embora inicialmente se pensasse que os EVs eram simplesmente um meio de eliminar resíduos da célula para manter a homeostase3, agora sabemos que eles também podem participar da comunicação intercelular via transferência de material molecular – incluindo DNA, RNA (mRNA, microRNA), lipídios e proteínas4,5 – e que eles são importantes reguladores da fisiologia normal, bem como processos patológicos1, 5,6,7,8.
Existem muitos métodos diferentes para isolar e quantificar EVs, que foram descritos em outros lugares9,10,11,12. O protocolo de isolamento usado, bem como a fonte de EVs, podem impactar muito o rendimento e a pureza do EV. Mesmo a centrifugação diferencial, considerada por muito tempo a abordagem “padrão-ouro” para o isolamento exóssomo, pode estar sujeita a variabilidade substancial, impactando posteriormente a população de EV obtida e análises a jusante13. Assim, as diferentes metodologias de isolamento e quantificação do EV dificultam a comparação, reprodução e interpretação dos resultados dos experimentos relatados na literatura14. Além disso, a liberação de EV pode ser regulada por condições celulares ou vários fatores externos. Tem sido sugerido que os EVs desempenham um papel na manutenção da homeostase celular protegendo as células contra o estresse intracelular15,como vários estudos têm mostrado que o estresse celular estimula a secreção de EV. Por exemplo, o aumento da liberação de EV foi relatado após exposição celular à hipóxia, estresse órticulo endoplasmático, estresse oxidativo, estresse mecânico, extrato de fumaça de cigarro e poluição atmosférica de material particulado16,17,18,19,20,21,22. A versão eV também foi mostrada como modificada in vivo; camundongos submetidos a uma dieta rica em gordura ou jejum por dezesseis horas liberaram mais EVs adipócitos23. Para investigar se um tratamento ou condição específico altera a liberação do EV, o número de EVs deve ser determinado com precisão. A avaliação da distribuição do tamanho do EV também pode indicar a origem subcelular predominante dos EVs (por exemplo, fusão de endosomes/corpos multivesiculares tardios com a membrana plasmática versus brotação da membrana plasmática)24. Assim, há necessidade de métodos robustos para medir com precisão a concentração total e a distribuição de tamanho da preparação de EV que está sendo estudada.
Um método rápido e altamente sensível para a visualização e caracterização de EVs na solução é a análise de rastreamento de nanopartículas (NTA). Uma explicação detalhada dos princípios deste método e a comparação com métodos alternativos de avaliação do tamanho e concentração de EV foram descritas anteriormente25,26,27,28. Resumidamente, durante a medição da NTA, os EVs são visualizados pela luz espalhada quando são irradiados com um raio laser. A luz dispersa é focada por um microscópio em uma câmera que registra o movimento das partículas. O software NTA rastreia o movimento térmico aleatório de cada partícula, conhecido como movimento browniano, para determinar o coeficiente de difusão que é usado para calcular o tamanho de cada partícula usando a equação de Stokes-Einstein. A NTA foi aplicada pela primeira vez à medição de EVs em uma amostra biológica em 201125. Até recentemente, havia apenas duas empresas tradicionais oferecendo instrumentos NTA comerciais29 até a introdução do ViewSizer 3000 (doravante chamado de instrumento de rastreamento de partículas) que usa uma combinação de novas soluções de hardware e software para superar limitações significativas de outras técnicas NTA.
O instrumento de rastreamento de partículas caracteriza nanopartículas em amostras líquidas analisando seu movimento browniano e caracteriza partículas maiores do tamanho de micron, analisando a fixação gravitacional. O sistema óptico único deste instrumento, que inclui iluminação multiespectral com três fontes de luz laser (a 450 nm, 520 nm e 635 nm), permite que os pesquisadores analisem uma ampla gama de tamanhos de partículas (por exemplo, exosósmos, microvesculas) simultaneamente. Um esquema da configuração do instrumento é mostrado na Figura 1.
Aqui, demonstramos como realizar a distribuição de tamanho de partículas e medições de concentração de mouses isolados e EVs humanos usando um novo instrumento NTA.
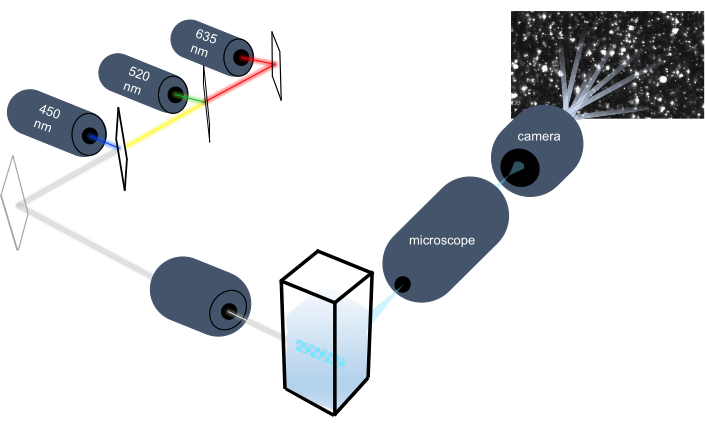
Figura 1: Sistema óptico do instrumento de rastreamento de partículas. O instrumento NTA ilumina partículas usando três lasers com os seguintes comprimentos de onda: 450 nm, 520 nm, 635 nm. A gravação de vídeo da luz dispersa de partículas individuais é detectada e rastreada por uma câmera de vídeo digital orientada a 90° do cuvette. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Aqui, demonstramos um protocolo para nta de EVs medir a distribuição de tamanho de uma ampla gama de tamanhos de partículas simultaneamente e medir a concentração total de EV em uma amostra de polidisperse. Neste estudo, o tecido adiposo do rato perigonadal e o plasma humano foram usados como fonte de EVs. No entanto, EVs isolados de outros tecidos ou fluidos biológicos, como soro, urina, saliva, leite materno, fluido amniótico e supernanato de cultura celular também podem ser usados para NTA. As medições das n…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pelos Institutos Nacionais de Saúde (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). Reconhecemos Jeffrey Bodycomb, Ph.D. da HORIBA Instruments Incorporated por sua ajuda para calibrar o instrumento.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
References
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

