Hücre Dışı Veziklinlerin Nicelleştirilmesi ve Boyut Tayini için Nanopartikül Takip Analizi
Summary
Fare perigonadal yağ dokusundan ve insan plazmasından izole edilmiş hücre dışı veznelerin boyut dağılımını ve toplam partikül konsantrasyonu tahmin etmek için yeni bir nanopartikül izleme analiz aracının nasıl kullanılacağını gösteriyoruz.
Abstract
Hücre dışı veziküllerin (EV) fizyolojik ve patofizyolojik rolleri giderek daha fazla tanınmaya devam ederek EV alanını hızla gelişen bir araştırma alanı haline getirmektedir. EV izolasyonu için, her biri EV’lerin aşağı akış verimini ve saflığını etkileyen farklı avantajlara ve dezavantajlara sahip birçok farklı yöntem vardır. Bu nedenle, belirli bir kaynaktan izole edilen EV hazırlığının seçilen bir yöntemle karakterize etmek, aşağı akış sonuçlarının yorumlanması ve sonuçların laboratuvarlar arasında karşılaştırılması için önemlidir. Hastalık durumlarıyla veya dış koşullara yanıt olarak değiştirilebilen EV’lerin boyutunu ve miktarını belirlemek için çeşitli yöntemler mevcuttur. Nanopartikül izleme analizi (NTA), bireysel EV’lerin yüksek verimli analizi için kullanılan önemli teknolojilerden biridir. Burada, NTA için alandaki büyük ilerlemeleri temsil eden çığır açan bir teknoloji kullanarak fare perigonadal yağ dokusundan ve insan plazmasından izole edilen EV’lerin nicelleştirilmesi ve boyut tespiti için ayrıntılı bir protokol sunuyoruz. Sonuçlar, bu yöntemin iletim elektron mikroskopisi ile doğrulanan farklı yöntemler kullanarak farklı kaynaklardan izole edilen EV’ler için tekrarlanabilir ve geçerli toplam parçacık konsantrasyonu ve boyut dağılımı verileri sunabileceğini göstermektedir. Bu enstrümanın NTA için uyarlanması, EV araştırmalarında titizliği ve tekrarlanabilirliği artırmak için NTA yöntemlerinde standardizasyon ihtiyacını giderecektir.
Introduction
Hücre dışı veziklinler (EV’ ler) hemen hemen tüm hücre tipleri tarafından salgılanan küçük (0,03-2 μm) membran bağlı veziküllerdir1. Serbest bırakma mekanizmalarına ve boyut2’yebağlı olarak genellikle “ekzozomlar”, “mikrovesiküller” veya “apoptotik cisimler” olarak adlandırılırlar. Başlangıçta EV’lerin homeostaz3’ükorumak için hücredeki atıkları ortadan kaldırmanın bir aracı olduğu düşünülürken, artık DNA, RNA (mRNA, mikroRNA), lipitler ve proteinler4,5 dahil olmak üzere moleküler materyal transferi yoluyla hücreler arası iletişime de katılabileceklerini ve normal fizyolojinin yanı sıra patolojik süreçlerin önemli düzenleyicileri olduklarını biliyoruz1. 5,6,7,8.
Başka bir yerde açıklananEV’leriizole etmek ve ölçmek için birçok farklı yöntem vardır 9,10,11,12. Kullanılan izolasyon protokolü ve EV’lerin kaynağı EV verimini ve saflığını büyük ölçüde etkileyebilir. Uzun zamandır eksozom izolasyonu için “altın standart” yaklaşımı olarak kabul edilen diferansiyel santrifüjleme bile, elde edilen EV popülasyonunu ve aşağı akış analizlerini etkileyen önemli değişkenliğe maruz kalabilir13. Bu nedenle, EV izolasyonu ve nicelleştirme için çeşitli farklı metodolojiler, literatürde bildirilen deneylerin sonuçlarını karşılaştırmayı, çoğaltmayı ve yorumlamayı zorlaştırır14. Ayrıca, EV salınımı hücresel koşullar veya çeşitli dış faktörler tarafından düzenlenebilir. EV’lerin hücreleri hücre içi strese karşı koruyarak hücresel homeostazın korunmasında rol oynadığı öne sürülüyor15Hücresel stresin EV salgısını uyardığını gösteren çeşitli çalışmalar. Örneğin, hipoksi, endoplazmik retikülum stresi, oksidatif stres, mekanik stres, sigara dumanı özü ve partikül madde hava kirliliği 16 , 17 , 18,19, 20,21,22‘ye hücresel maruziyet sonrası artan EV salınımı bildirilmiştir. EV sürümünün de vivo olarak değiştirildiği gösterilmiştir; on altı saat boyunca yüksek yağlı bir diyete veya oruç tutmaya maruz kalan fareler daha fazla adipositEV’si serbest bırakıldı 23. Belirli bir tedavinin veya durumun EV salınımını değiştirip değiştirmediğini araştırmak için EV sayısı doğru bir şekilde belirlenmelidir. EV boyut dağılımının değerlendirilmesi, EV’lerin baskın hücre altı kökenini de gösterebilir (örneğin, geç endozomların / multivesiküler cisimlerin plazma zarı ile füzyonu ve plazma zarının tomurcuklanmaları)24. Bu nedenle, çalışılan EV hazırlığının toplam konsantrasyonu ve boyut dağılımını doğru bir şekilde ölçmek için sağlam yöntemlere ihtiyaç vardır.
Çözeltideki EV’lerin görselleştirilmesi ve karakterizasyonu için hızlı ve son derece hassas bir yöntem nanopartikül izleme analizidir (NTA). Bu yöntemin ilkelerinin ayrıntılı bir açıklaması ve EV büyüklüğü ve konsantrasyonunun değerlendirilmesi için alternatif yöntemlerle karşılaştırılması daha önceaçıklanmıştır 25,26,27,28. Kısaca, NTA ölçümü sırasında, EV’ler bir lazer ışını ile ışınlandıklarında saçılan ışık tarafından görselleştirilir. Dağınık ışık, parçacık hareketini kaydeden bir kameraya mikroskopla odaklanır. NTA yazılımı, Stokes-Einstein denklemini kullanarak her parçacığın boyutunu hesaplamak için kullanılan difüzyon katsayısını belirlemek için Brownian hareketi olarak bilinen her parçacığın rastgele termal hareketini izler. NTA ilk olarak 2011 yılında biyolojik bir örneklemde EV ölçümüne uygulanmıştır25. Yakın zamana kadar, diğer NTA tekniklerinin önemli sınırlamalarını aşmak için yeni donanım ve yazılım çözümlerinin bir kombinasyonunu kullanan ViewSizer 3000’in (bundan böyle parçacık izleme cihazı olarak anılacaktır) tanıtımına kadar ticari NTA enstrümanları29 sunan sadece iki ana akım şirket vardı.
Parçacık izleme cihazı, Brownian hareketlerini analiz ederek sıvı numunelerdeki nanopartikülleri karakterize eder ve yerçekimsel çökeltme analiz ederek daha büyük mikron boyutlu parçacıkları karakterize eder. Üç lazer ışık kaynağına (450 nm, 520 nm ve 635 nm’de) sahip multispektral aydınlatma içeren bu cihazın benzersiz optik sistemi, araştırmacıların çok çeşitli parçacık boyutlarını (örneğin, ekzozomlar, mikrovesiküller) aynı anda analiz etmelerini sağlar. Cihaz kurulumunun şeması Şekil 1‘de gösterilmiştir.
Burada, yeni bir NTA cihazı kullanarak izole fare ve insan EV’lerinin parçacık boyutu dağılımı ve konsantrasyon ölçümlerinin nasıl gerçekleştirildiğini gösteriyoruz.
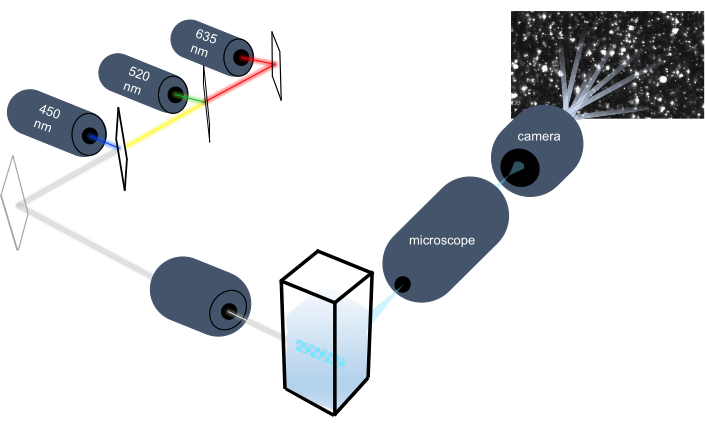
Şekil 1: Parçacık izleme cihazı optik sistemi. NTA cihazı, aşağıdaki dalga boylarına sahip üç lazer kullanarak parçacıkları aydınlatır: 450 nm, 520 nm, 635 nm. Tek tek parçacıklardan gelen dağınık ışığın video kaydı, cuvette’den 90° odaklı bir dijital video kamera tarafından algılanır ve izlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Burada, çok çeşitli parçacık boyutlarının boyut dağılımını aynı anda ölçmek ve bir polidisperz örneğinde toplam EV konsantrasyonu ölçmek için EV’lerin NTA’sı için bir protokol gösteriyoruz. Bu çalışmada EV’lerin kaynağı olarak fare perigonadal yağ dokusu ve insan plazması kullanılmıştır. Bununla birlikte, diğer dokulardan izole edilen EV’ler veya serum, idrar, tükürük, anne sütü, amniyotik sıvı ve hücre kültürü süpernatantı gibi biyolojik sıvılar da NTA için kullanılabi…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu çalışma Ulusal Sağlık Enstitüleri (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608) tarafından desteklenmiştir. Jeffrey Bodycomb’u, HORIBA Instruments Incorporated’ın doktorasını, cihazı kalibre etmedeki yardımı için kabul ediyoruz.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
References
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

