Nanopartikel-Tracking-Analyse zur Quantifizierung und Größenbestimmung extrazellulärer Vesikel
Summary
Wir zeigen, wie man ein neuartiges Nanopartikel-Tracking-Analyseinstrument verwendet, um die Größenverteilung und Gesamtpartikelkonzentration von extrazellulären Vesikeln abzuschätzen, die aus dem periigonadalen Fettgewebe der Maus und dem menschlichen Plasma isoliert wurden.
Abstract
Die physiologischen und pathophysiologischen Rollen extrazellulärer Vesikel (EVs) werden zunehmend anerkannt, was das EV-Feld zu einem sich schnell entwickelnden Forschungsgebiet macht. Es gibt viele verschiedene Methoden zur Isolierung von Elektrofahrzeugen, die jeweils unterschiedliche Vor- und Nachteile haben, die sich auf die nachgelagerte Ausbeute und Reinheit von Elektrofahrzeugen auswirken. Daher ist die Charakterisierung der EV-Vorbereitung, die aus einer bestimmten Quelle durch eine gewählte Methode isoliert wurde, wichtig für die Interpretation der nachgelagerten Ergebnisse und den Vergleich der Ergebnisse zwischen Labors. Es gibt verschiedene Methoden zur Bestimmung der Größe und Menge von Elektrofahrzeugen, die durch Krankheitszustände oder als Reaktion auf äußere Bedingungen verändert werden können. Die Nanopartikel-Tracking-Analyse (NTA) ist eine der führenden Technologien für die Hochdurchsatzanalyse einzelner Elektrofahrzeuge. Hier präsentieren wir ein detailliertes Protokoll zur Quantifizierung und Größenbestimmung von EVs, die aus periguronadalem Fettgewebe und menschlichem Plasma der Maus isoliert wurden, wobei eine bahnbrechende Technologie für NTA verwendet wurde, die große Fortschritte auf diesem Gebiet darstellt. Die Ergebnisse zeigen, dass diese Methode reproduzierbare und valide Daten zur Gesamtpartikelkonzentration und -größenverteilung für EVs liefern kann, die mit verschiedenen Methoden aus verschiedenen Quellen isoliert wurden, wie durch die Transmissionselektronenmikroskopie bestätigt. Die Anpassung dieses Instruments an NTA wird die Notwendigkeit einer Standardisierung von NTA-Methoden adressieren, um die Strenge und Reproduzierbarkeit in der EV-Forschung zu erhöhen.
Introduction
Extrazelluläre Vesikel (EVs) sind kleine (0,03-2 μm) membrangebundene Vesikel, die von fast allen Zelltypen abgesondert werden1. Sie werden oft als “Exosomen”, “Mikrovesikel” oder “apoptotische Körper” bezeichnet, abhängig von ihrem Freisetzungsmechanismus und ihrer Größe2. Während man anfangs dachte, dass EVs nur ein Mittel sind, um Abfälle aus der Zelle zu entfernen, um die Homöostaseaufrechtzuerhalten 3,wissen wir jetzt, dass sie auch an der interzellulären Kommunikation durch Transfer von molekularem Material – einschließlich DNA, RNA (mRNA, microRNA), Lipiden und Proteinen4,5 – teilnehmen können und dass sie wichtige Regulatoren der normalen Physiologie sowie pathologischer Prozesse sind1. 5,6,7,8.
Es gibt viele verschiedene Methoden zur Isolierung und Quantifizierung von EVs, die an anderer Stelle beschrieben wurden9,10,11,12. Das verwendete Isolationsprotokoll sowie die Quelle von Elektrofahrzeugen können die EV-Ausbeute und -Reinheit stark beeinflussen. Selbst die differentielle Zentrifugation, die lange als “Goldstandard” -Ansatz für die Exosomenisolierung galt, kann einer erheblichen Variabilität unterliegen, die sich anschließend auf die erhaltene EV-Population und die nachgelagerten Analysen auswirkt13. Daher erschweren die verschiedenen Methoden zur Isolierung und Quantifizierung von Elektrofahrzeugen den Vergleich, die Reproduktion und die Interpretation der Ergebnisse von Experimenten, die in der Literaturberichtet wurden 14. Darüber hinaus kann die EV-Freisetzung durch zelluläre Bedingungen oder verschiedene externe Faktoren reguliert werden. Es wurde vorgeschlagen, dass EVs eine Rolle bei der Aufrechterhaltung der zellulären Homöostase spielen, indem sie Zellen vor intrazellulärem Stressschützen 15, da mehrere Studien gezeigt haben, dass zellulärer Stress die EV-Sekretion stimuliert. Zum Beispiel wurde eine erhöhte EV-Freisetzung nach zellulärer Exposition gegenüber Hypoxie, endoplasmatischem Retikulumstress, oxidativem Stress, mechanischem Stress, Zigarettenrauchextrakt und Feinstaubluftverschmutzung berichtet16,17,18,19,20,21,22. Es wurde auch gezeigt, dass die EV-Freisetzung in vivo modifiziert wurde; Mäuse, die sechzehn Stunden lang einer fettreichen Diät oder einem Fasten unterzogen wurden, setzten mehr Adipozyten-EVsfrei 23. Um zu untersuchen, ob eine bestimmte Behandlung oder bedingung die Ev-Freisetzung verändert, muss die Anzahl der EVs genau bestimmt werden. Die Beurteilung der EV-Größenverteilung kann auch auf den vorherrschenden subzellulären Ursprung von EVs hinweisen (z. B. Fusion von späten Endosomen / multivesikulären Körpern mit der Plasmamembran vs. Knospung der Plasmamembran)24. Daher besteht ein Bedarf an robusten Methoden, um die Gesamtkonzentration und die Größenverteilung des untersuchten EV-Preps genau zu messen.
Eine schnelle und hochempfindliche Methode zur Visualisierung und Charakterisierung von Elektrofahrzeugen in Lösung ist die Nanopartikel-Tracking-Analyse (NTA). Eine detaillierte Erläuterung der Prinzipien dieser Methode und der Vergleich mit alternativen Methoden zur Beurteilung der EV-Größe und -Konzentration wurden zuvor beschrieben25,26,27,28. Kurz gesagt, während der NTA-Messung werden EVs durch das Licht visualisiert, das gestreut wird, wenn sie mit einem Laserstrahl bestrahlt werden. Das Streulicht wird von einem Mikroskop auf eine Kamera fokussiert, die die Partikelbewegung aufzeichnet. Die NTA-Software verfolgt die zufällige thermische Bewegung jedes Teilchens, bekannt als Brownsche Bewegung, um den Diffusionskoeffizienten zu bestimmen, der verwendet wird, um die Größe jedes Teilchens mit der Stokes-Einstein-Gleichung zu berechnen. NTA wurde erstmals 2011 zur Messung von Elektrofahrzeugen in einer biologischen Probe angewendet25. Bis vor kurzem gab es nur zwei Mainstream-Unternehmen, die kommerzielle NTA-Instrumente29 anboten, bis zur Einführung des ViewSizer 3000 (im Folgenden als Partikelverfolgungsinstrument bezeichnet), das eine Kombination aus neuartigen Hardware- und Softwarelösungen verwendet, um erhebliche Einschränkungen anderer NTA-Techniken zu überwinden.
Das Partikelverfolgungsinstrument charakterisiert Nanopartikel in flüssigen Proben durch Analyse ihrer Brownschen Bewegung und charakterisiert größere mikrometergroße Partikel durch Analyse der Gravitationsablagerung. Das einzigartige optische System dieses Instruments, das eine multispektrale Beleuchtung mit drei Laserlichtquellen (bei 450 nm, 520 nm und 635 nm) umfasst, ermöglicht es den Forschern, eine Vielzahl von Partikelgrößen (z. B. Exosomen, Mikrovesikel) gleichzeitig zu analysieren. Ein Schema des Geräteaufbaus ist in Abbildung 1 dargestellt.
Hier zeigen wir, wie man Partikelgrößenverteilungs- und Konzentrationsmessungen von isolierten Maus- und Human-EVs mit einem neuartigen NTA-Instrument durchführt.
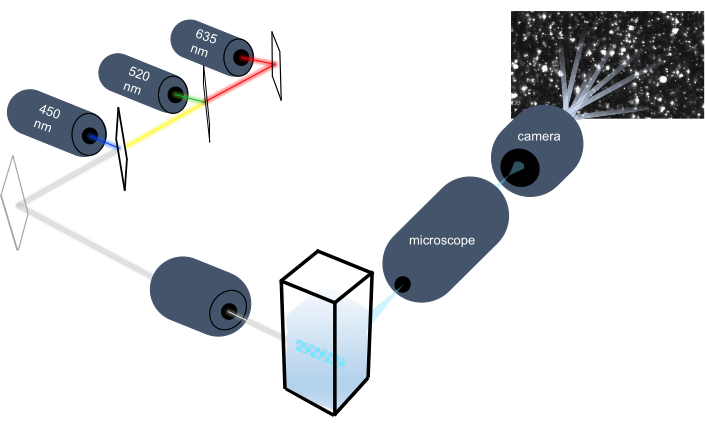
Abbildung 1:Optisches System des Partikelverfolgungsinstruments. Das NTA-Instrument beleuchtet Partikel mit drei Lasern mit folgenden Wellenlängen: 450 nm, 520 nm, 635 nm. Die Videoaufzeichnung des Streulichts einzelner Partikel wird von einer digitalen Videokamera, die 90° von der Küvette ausgerichtet ist, detektiert und verfolgt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Hier demonstrieren wir ein Protokoll für NTA von Elektrofahrzeugen, um die Größenverteilung eines breiten Spektrums von Partikelgrößen gleichzeitig zu messen und die Gesamtkonzentration von Elektrofahrzeugen in einer polydispersen Probe zu messen. In dieser Studie wurden periguronadales Fettgewebe und menschliches Plasma der Maus als Quelle für EVs verwendet. EVs, die aus anderen Geweben oder biologischen Flüssigkeiten wie Serum, Urin, Speichel, Muttermilch, Fruchtwasser und Zellkulturüberstand isoliert wurden, k…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde von den National Institutes of Health (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608) unterstützt. Wir danken Jeffrey Bodycomb, Ph.D. von HORIBA Instruments Incorporated für seine Hilfe bei der Kalibrierung des Instruments.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
References
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

