ניתוח מעקב חלקיקים לכימות וקביעת גודל של שלל חוץ-תאי
Summary
אנו מדגימים כיצד להשתמש במכשיר ניתוח ננו-חלקיקים חדשני כדי להעריך את התפלגות הגודל ואת ריכוז החלקיקים הכולל של שלל חוץ תאי מבודד רקמת שומן perigonadal עכבר ופלזמה אנושית.
Abstract
התפקידים הפיזיולוגיים והפתופיזיולוגיים של שלשלות חוץ תאיות (EVs) הפכו מוכרים יותר ויותר, מה שהופך את שדה הרכב התגנבות לתחום מחקר המתפתח במהירות. ישנן שיטות רבות ושונות לבידוד EV, כל אחת עם יתרונות וחסרונות ברורים המשפיעים על התשואה במורד הזרם וטוהר של EVs. לכן, אפיון הכנת EV מבודד ממקור נתון על ידי שיטה שנבחרה חשוב לפרשנות של תוצאות במורד הזרם והשוואת תוצאות על פני מעבדות. קיימות שיטות שונות לקביעת הגודל והכמות של כלי עבודה אלקטרוניים, אשר ניתן לשנות על ידי מצבי מחלה או בתגובה לתנאים חיצוניים. ניתוח מעקב ננו-חלקיקים (NTA) היא אחת הטכנולוגיות הבולטות המשמשות לניתוח תפוקה גבוהה של EVs בודדים. כאן, אנו מציגים פרוטוקול מפורט לכימות וקביעת גודל של כלי עבודה אלקטרוניים מבודדים מרקמת שומן perigonadal עכבר ופלזמה אנושית באמצעות טכנולוגיה פורצת דרך עבור NTA המייצגת התקדמות משמעותית בתחום. התוצאות מראות כי שיטה זו יכולה לספק נתוני ריכוז חלקיקים כוללים וחלוקת חלקיקים חוקיים לשחזור עבור EVs המבודדים ממקורות שונים בשיטות שונות, כפי שאושר על ידי מיקרוסקופיית אלקטרונים שידור. ההתאמה של מכשיר זה עבור נת”ע תתייחס לצורך בתקינה בשיטות נת”ע להגברת ההקפדה והשחזור במחקרי EV.
Introduction
שלשלות חוץ-תאיות (EVs) הן שלשלות קטנות (0.03-2 מיקרומטר) הקשורות לקרום המופרשות על ידי כמעט כל סוגי התאים1. הם מכונים לעתים קרובות “exosomes”, “microvesicles”, או “גופים אפופוטוטיים” בהתאם למנגנון השחרור שלהם וגודל2. אמנם בתחילה חשבו כי EVs היו פשוט אמצעי לחיסול פסולת מהתא כדי לשמור על הומאוסטזיס3, עכשיו אנחנו יודעים שהם יכולים גם להשתתף בתקשורת בין תאית באמצעות העברת חומר מולקולרי – כולל DNA, RNA (mRNA, microRNA), שומנים, וחלבונים4,5 – וכי הם רגולטורים חשובים של פיזיולוגיה נורמלית, כמו גם תהליכים פתולוגיים1, 5,6,7,8.
ישנן שיטות רבות ושונות כדי לבודד ולכומת EVs, אשר תוארו במקומות אחרים9,10,11,12. פרוטוקול הבידוד המשמש, כמו גם את המקור של EVs יכול להשפיע מאוד על תשואה EV וטוהר. אפילו צנטריפוגה דיפרנציאלית, שנחשבה זה מכבר לגישת “תקן הזהב” לבידוד אקסוזום, יכולה להיות כפופה לשינויים משמעותיים המשפיעים לאחר מכן על אוכלוסיית EV שהושגה ובניתוחים במורד הזרם13. לכן, המתודולוגיות השונות לבידוד וכימות EV מקשות על השוואה, שחזור ופרשנות של תוצאות ניסויים שדווחו בספרות14. יתר על כן, שחרור EV יכול להיות מוסדר על ידי תנאים הסלולר או גורמים חיצוניים שונים. הוצע כי EVs לשחק תפקיד בשמירה על הומאוסטזיס הסלולר על ידי הגנה על תאים מפני מתח תאי15, כמו מספר מחקרים הראו כי מתח תאי מגרה הפרשת EV. לדוגמה, שחרור EV מוגבר דווח לאחר חשיפה תאית היפוקסיה, לחץ רשתית אנדופלסמי, עקה חמצונית, מתח מכני, תמצית עשן סיגריות, זיהום אוויר חומר חלקיקי16,17,18,19,20,21,22. גם שחרור EV הוכח להיות שונה ב vivo; עכברים נתונים לתזונה עתירת שומן או צום במשך 16 שעות שחררו יותר adipocyte EVs23. כדי לחקור אם טיפול או מצב ספציפיים משנים את שחרור EV, יש לקבוע במדויק את מספר ה- EVs. הערכת התפלגות גודל הרכב הרך EV עשויה גם להצביע על המקור התת-תאי השולט של רכבים לוויוניים (למשל, היתוך של אנדוזומים מאוחרים/גופים רב-תאיים עם קרום הפלזמה לעומת ניצנים של קרום הפלזמה)24. לכן, יש צורך בשיטות חזקות כדי למדוד במדויק את הריכוז הכולל ואת התפלגות הגודל של הכנת EV הנלמדת.
שיטה מהירה ורגישה מאוד להדמיה ואפיון של EVs בפתרון היא ניתוח מעקב ננו-חלקיקים (NTA). הסבר מפורט על עקרונות שיטה זו והשוואה עם שיטות חלופיות להערכת גודל EV וריכוז תוארו בעבר25,26,27,28. בקצרה, במהלך מדידת NTA, EVs דמיינו על ידי האור הפזור כאשר הם מוקרן עם קרן לייזר. האור המפוזר מתמקד במיקרוסקופ למצלמה המתעד את תנועת החלקיקים. תוכנת NTA עוקבת אחר התנועה התרמית האקראית של כל חלקיק, המכונה תנועה בראונית, כדי לקבוע את מקדם הדיפוזיה המשמש לחישוב הגודל של כל חלקיק באמצעות משוואת סטוקס-איינשטיין. NTA הוחל לראשונה על מדידת EVs במדגם ביולוגי בשנת 201125. עד לאחרונה, היו רק שתי חברות מיינסטרים המציעות מכשירים מסחריים של NTA29 עד כניסתו של ViewSizer 3000 (להלן מכשיר מעקב חלקיקים) המשתמש בשילוב של פתרונות חומרה ותוכנה חדשניים כדי להתגבר על מגבלות משמעותיות של טכניקות NTA אחרות.
מכשיר המעקב אחר חלקיקים מאפיין חלקיקים בדגימות נוזליות על ידי ניתוח התנועה הבראונית שלהם ומאפיין חלקיקים גדולים יותר בגודל מיקרון על ידי ניתוח התיישבות כבידה. המערכת האופטית הייחודית של מכשיר זה, הכוללת תאורה רב-ספקטרלית עם שלושה מקורות אור לייזר (ב-450 ננומטר, 520 ננומטר ו-635 ננומטר), מאפשרת לחוקרים לנתח מגוון רחב של גדלי חלקיקים (למשל אקסוזומים, מיקרו-vesicles) בו זמנית. תרשים של הגדרת המכשיר מוצג באיור 1.
כאן, אנו מדגימים כיצד לבצע התפלגות גודל חלקיקים ומדידות ריכוז של עכבר מבודד ו- EVs אנושי באמצעות מכשיר NTA חדשני.
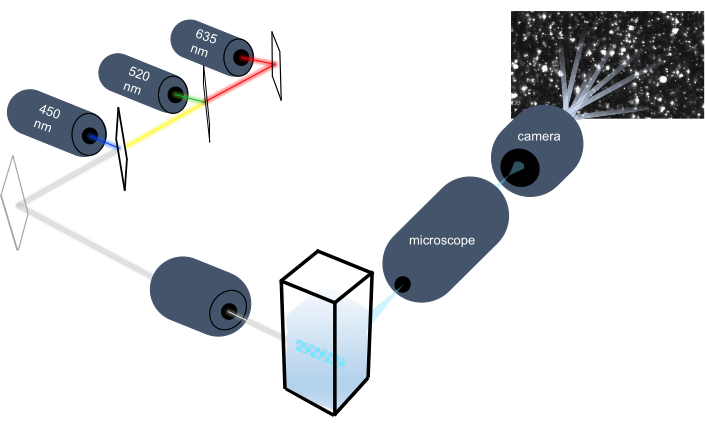
איור 1: מערכת אופטית של מכשיר מעקב חלקיקים. מכשיר NTA מאיר חלקיקים באמצעות שלושה לייזרים עם אורכי הגל הבאים: 450 ננומטר, 520 ננומטר, 635 ננומטר. הקלטת וידאו של האור המפוזר מחלקיקים בודדים מזוהה ומעקב על ידי מצלמת וידאו דיגיטלית מכוונת 90 ° מן cuvette. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
כאן, אנו מדגימים פרוטוקול עבור NTA של EVs כדי למדוד את התפלגות הגודל של מגוון רחב של גדלי חלקיקים בו זמנית ולמדוד את הריכוז הכולל של EV במדגם polydisperse. במחקר זה, רקמת השומן perigonadal עכבר ופלזמה אנושית שימשו כמקור של כלי עבודה אלקטרוניים. עם זאת, EVs מבודד מרקמות אחרות או נוזלים ביולוגיים כגון סרום, שתן…
Divulgations
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608). אנו מכירים את ג’פרי בודיקומב, Ph.D. של HORIBA מכשירים בע”מ על עזרתו בכיול המכשיר.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
References
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

