小動物放射線研究プラットフォームを用いたラット膠芽腫モデルにおける陽電子放射断層撮影に基づく線量塗装放射線療法
Summary
ここでは、精度と効率を最適化するために自社開発したアルゴリズムを使用して、ラット膠芽腫モデルにおいて前臨床陽電子放射断層撮影ベースの放射線療法を実行するためのプロトコルを提示する。
Abstract
診療所におけるヒト膠芽腫の化学放射線治療を模倣するラット膠芽腫モデルが以前に確立されていた。臨床治療と同様に、コンピュータ断層撮影法(CT)と磁気共鳴画像法(MRI)が治療計画プロセス中に組み合わされた。陽電子放射断層撮影(PET)イメージングは、その後、マイクロ照射システムを使用してサブボリュームブースティングを実施するために追加された。しかし、マイクロ照射システムを使用して3つのイメージングモダリティ(CT、MRI、PET)を組み合わせることは、マルチモーダルイメージング、治療計画、および線量送達を前臨床現場で順番に完了する必要があるため、労働集約的であることが判明しました。これにより、ワークフローが人為的エラーが発生しやすくなります。したがって、前臨床マルチモーダルイメージングベースの放射線治療計画をさらに最適化するためのユーザーフレンドリーなアルゴリズムが実装されました。このソフトウェアツールは、 in silico 試験デザインを使用して、マイクロ照射による線量塗装放射線療法の精度と効率を評価するために使用されました。線量塗装放射線療法の新しい方法論は、精度、時間効率、およびユーザー内およびユーザー間の変動性の点で、前述の方法よりも優れています。また、臨床システムとは対照的に、フォワードプランニングが依然として一般的に使用されているマイクロ照射器での逆治療計画の実施に向けた重要なステップでもあります。
Introduction
膠芽腫(GB)は、悪性で非常に攻撃的な原発性脳腫瘍である。GBは、浸潤性境界、核異型、および壊死によって典型的に特徴付けられる固体の不均一な腫瘍である1。血液脳関門の存在と免疫特権部位としての脳の地位は、化学療法および免疫療法のための新規標的の発見を困難な課題としています2,3,4。GB患者の治療は、2005年に外部ビーム放射線療法(RT)と併用テモゾロミドを組み合わせたStuppプロトコルの導入以来、ほとんど変化していないことは注目に値します5。典型的には、Stuppプロトコルの前には、最大外科的切除術が先行する。したがって、代替治療アプローチは極めて重要である。
膠芽腫患者に対する現在の放射線療法は、定義された腫瘍体積に均一な放射線量をもたらす。放射線腫瘍学では、膠芽腫には線量の増加を伴う重要な線量反応相関があり、正常な脳に対する毒性の増加により、約60Gyに制限されるようです6,7。しかし、腫瘍は非常に(放射線生物学的に)不均一であり、酸素レベルの勾配および/または細胞密度の大きな差異であり得る。PETなどの代謝イメージング技術は、これらの生物学的特徴を視覚化することができ、用量処方をカスタマイズするために利用することができる。このアプローチは、線量塗装RTとして知られています。この用語は、2000年にLingらによって導入された。著者らは、線量塗装RTを「放射線の伝播と散乱の制約内で絶妙にコンフォーマルな線量分布」を生成すると定義した8。
線量塗装RTには、ネストされたサブボリュームのセットに線量を処方する輪郭による線量塗装(DPBC)と、ボクセルレベルで線量が処方される数値による線量塗装(DPBN)の2種類がある。DPBN RTの線量分布は、機能画像から抽出することができる。各ボクセルの線量は、画像内の対応するボクセルの強度Iによって決定され、下限および上限とともに、一方では、腫瘍のあらゆる部分に十分な用量が送達されることを確認する。一方、用量は、リスクのある臓器を保護し、毒性を回避するために上限を超えない。最も直接的な方法は、最小線量Dminと最大線量Dmaxの間の線形補間(式1を参照)であり、目標体積内の最小強度Imaxと最大強度の間で比例的に変化する9,10
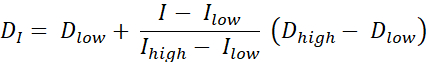 式 1
式 1
DPBN RTの品質保証については懐疑的であるため、線量の沈着は前臨床および臨床研究を通じて検証する必要があります10。しかし、臨床試験から取得できるデータは限られており、実験動物にダウンスケーリングすることでより多くの洞察が得られるという仮説が立てられています11,12。したがって、オートラジオグラフィーなどの非常に特殊な技術との結合を可能にする精密画像誘導放射線研究プラットフォームを利用した前臨床試験は、未解決の問題を検討し、個別化医療や線量塗装RT13,14などの新しい治療戦略への道を開くのに適しています。しかし、前臨床データの解釈は慎重に行う必要があり、これらの前臨床設定の欠点を考慮する必要があります14。
小動物放射線研究プラットフォーム(SARRP)などのマイクロ照射システムには、臨床的対応物と同様の技術が装備されています。オンボードコーンビームCT(CBCT)イメージング、前臨床治療計画システム(PCTPS)を含み、サブミリメートルの精度を提供します。臨床線量計算は、逆治療計画によって実行され、それによって、所望の線量分布から開始し、反復アルゴリズムを介してビームを決定する。前臨床照射器は、多くの場合、フォワードプランニングを使用します。フォワードプランニングでは、ビームの必要な量と角度が選択され、PCTPSは線量分布を計算します。計画の最適化は、手作業のかかる手動イテレーションによって実行されます15。
2009年以降、新しい開発により、これらの研究プラットフォームでの逆計画の実装が可能になりました16,17,18。臨床方法との類似性を高めるために、多葉コリメータの前臨床対応物として電動可変長方形コリメータ(MVC)が開発された。可変コリメータを利用した2次元線量塗装法がChoらによって発表された19。本研究グループは、マイクロ照射器に3次元(3D)逆治療計画プロトコルを実装し、標的体積の最小線量と最大線量、およびリスクのある臓器の最大線量を決定しました。これらの技術は主にインシリコで評価されており、その前臨床応用を探求する必要があります。
この論文は、小動物放射線研究プラットフォームを用いて、GBラットモデルにおける[18F]-フルオロエチル-L-チロシン([18F]FET)PETベースの線量塗装20,21,22の2つの方法論を比較するためのインシリコ研究を提示する。これらの2つの方法論は、(1)予め定義されたビームサイズを用いたサブボリュームブースティングと、(2)腫瘍体積におけるPETトレーサー取り込みに基づいて顎の寸法が変更される電動可変コリメータを使用した線量塗装である。[18F]FETは、脳腫瘍を検出する能力があるため、神経腫瘍学でよく使用されるPETトレーサーです23。[18F]FETは、腫瘍細胞に内在化されるが、細胞タンパク質には取り込まれない人工アミノ酸である。[18F]FETの取り込みは、細胞増殖速度、腫瘍細胞密度、および血管新生に対応します24。これは、これらの著者の研究所で最も一般的に使用されている腫瘍学的脳PETトレーサーであるため、この放射性トレーサーは、新しいワークフローを評価するために選択されました。
Protocol
Representative Results
Discussion
膠芽腫患者に対する診療所における化学放射線治療を模倣するラットGBモデルが以前に記載されていた20。臨床方法と同様に、CTとMRIを治療計画プロセス中に組み合わせて、より正確な照射を得た。動物をある画像化システムから別のイメージングシステムに移動するときに、(頭部)動きを最小限に抑えるためのマルチモダリティベッドが使用されました。その後、PETイメー?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
著者らは、この作業を支援してくれたLux Luka Foundationに感謝したいと思います。
Materials
| Cell culture | |||
| F98 Glioblastoma Cell Line | ATCC | CRL-2397 | https://www.lgcstandards-atcc.org/products/all/CRL-2397 |
| Dulbeco's Modified Eagle Medium | Thermo Fisher Scientific | 22320-030 | |
| Cell culture flasks | Thermo Fisher Scientific | 178883 | 75 cm² |
| FBS | Thermo Fisher Scientific | 10270106 | |
| L-Glutamine | Thermo Fisher Scientific | 25030-032 | 200 mM |
| Penicilline-Streptomycin | Thermo Fisher Scientific | 15140-148 | 10,000 U/mL |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 14040-224 | |
| Trypsin-EDTA | Thermo Fisher Scientific | 25300-062 | 0.05% |
| GB Rat Model | |||
| Ball-shaped burr | Foredom | A-228 | 1.8 mm |
| Bone Wax | Aesculap | 1029754 | https://www.aesculapusa.com/en/healthcare-professionals/or-solutions/or-solutions-cranial-closure/hemostatic-bone-wax.html |
| Ethilon | Ethicon | 662G/662H | FS-2, 4-0, 3/8, 19 mm |
| Fischer F344/Ico crl Rats | Charles River | – | |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| IR Lamp | Philips | HP3616/01 | |
| Meloxicam (Metacam) | Boehringer Ingelheim | – | 2 mg/mL |
| Micromotor rotary tool | Foredom | K.1090-22 | |
| Micropump system | Stoelting Co. | 53312 | Stoelting Stereotaxic Injector |
| Stereotactic frame | Stoelting Co. | 51600 | |
| Xylocaine (1%, with adrenaline 1:200,000) | Aspen | – | 1%, with adrenaline 1:200,000 |
| Xylocaine gel (2%) | Aspen | – | 2% |
| Animal Irradiation | |||
| Micro-irradiator | X-Strahl | SARRP | Version 4.2.0 |
| Software | X-Strahl | Muriplan | Preclinical treatment planning system (PCTPC), version 2.2.2 |
| Small Animal PET | |||
| [18F]FET | Inhouse made | – | PET tracer; along with Prohance: MRI/PET agent |
| Micro-PET | Molecubes | Beta-Cube | https://www.molecubes.com/b-cube/ |
| Small Animal MRI | |||
| Micro-MRI | Bruker Biospin | Pharmascan 70/16 | https://www.bruker.com/products/mr/preclinical-mri/pharmascan.html |
| 30 G Needle for IV injection | Beckton-Dickinson | 305128 | |
| PE 10 Tubing | Instech Laboratories Inc | BTPE-10 | BTPE-10, polyethylene tubing 0.011 x 0.024 in (0.28 x 60 mm), non sterile, 30 m (98 ft) spool, Instech laboratories, Inc Plymouth meeting PA USA- (800) 443-4227- http://www.instechlabs.com |
| Prohance contrast agent | Bracco Imaging | – | 279.3 mg/mL, gadolinium-contrast agent (along with [18F]FET: MRI/PET agent) |
| Tx/Rx Rat Brain – Mouse Whole Body Volumecoil | Bruker Biospin | – | 40 mm diameter |
| Water-based Heating Unit | Bruker Biospin | MT0125 | |
| Consumables | |||
| Isoflurane | Zoetis | B506 | Anesthesia |
| Insulin Syringe Microfine | Beckton-Dickinson | 320924 | 1 mL, 29 G |
| Image Analysis | |||
| MATLAB | Mathworks | – | Version R2019b |
| PMOD | PMOD technologies LLC | Preclinical and molecular imaging software |
References
- Louis, D. N., et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathologica. 131 (6), 803-820 (2016).
- Wadajkar, A. S., et al. Tumor-targeted nanotherapeutics: Overcoming treatment barriers for glioblastoma. Wiley Interdisciplinary Reviews. Nanomedicine & Nanobiotechnology. 9 (4), (2016).
- Lim, M., Xia, Y., Bettegowda, C., Weller, M. Current state of immunotherapy for glioblastoma. Nature Reviews. Clinical Oncology. 15 (7), 422 (2018).
- McGranahan, T., Li, G., Nagpal, S. History and current state of immunotherapy in glioma and brain metastasis. Therapeutic Advances in Medical Oncology. 9 (5), 347-368 (2017).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Von Neubeck, C., Seidlitz, A., Kitzler, H. H., Beuthien-Baumann, B., Krause, M. Glioblastoma multiforme: Emerging treatments and stratification markers beyond new drugs. The British Journal of Radiology. 88 (1053), 20150354 (2015).
- Mann, J., Ramakrishna, R., Magge, R., Wernicke, A. G. Advances in radiotherapy for glioblastoma. Frontiers in Neurology. 8, 748 (2018).
- Ling, C. C., et al. Towards multidimensional radiotherapy (MD-CRT): Biological imaging and biological conformality. International Journal of Radiation Oncolology, Biology, Physics. 47 (3), 551-560 (2000).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Seminars in Radiation Oncology. 21 (2), 101-110 (2011).
- Bentzen, S. M. Theragnostic imaging for radiation oncology: Dose-painting by numbers. The Lancet. Oncology. 6 (2), 112-117 (2005).
- Wong, J., et al. High-resolution, small animal radiation research platform with X-ray tomographic guidance capabilities. International Journal of Radiation Oncolology, Biology, Physics. 71 (5), 1591-1599 (2008).
- Van Hoof, S. J., Granton, P. V., Verhaegen, F. Development and validation of a treatment planning system for small animal radiotherapy: SmART-Plan. Radiotherapy and Oncology. 109 (3), 361-366 (2013).
- Verhaegen, F., Granton, P., Tryggestad, E. Small animal radiotherapy research platforms. Physics in Medicine & Biology. 56 (12), 55-83 (2011).
- Butterworth, K. T., Prise, K. M., Verhaegen, F. Small animal image-guided radiotherapy: Status, considerations and potential for translational impact. The British Journal of Radiology. 88 (1045), 20140634 (2015).
- Nasr, A., Habash, A. Dosimetric analytic comparison of inverse and forward planned IMRT techniques in the treatment of head and neck cancer. Journal of the Egyptian National Cancer Institute. 26 (3), 119-125 (2014).
- Matinfar, M., Iyer, S., Ford, E., Wong, J., Kazanzides, P. Image guided complex dose delivery for small animal radiotherapy. IEEE International Symposium on Biomedical Imaging: From Nano to Macro. , 1243-1246 (2009).
- Matinfar, M., Iordachita, I., Wong, J., Kazanzides, P. Robotic delivery of complex radiation volumes for small animal research. IEEE International Conference on Robotics and Automation. , 2056-2061 (2010).
- Balvert, M., et al. A framework for inverse planning of beam-on times for 3D small animal radiotherapy using interactive multi-objective optimisation. Physics in Medicine & Biology. 60 (14), 5681-5698 (2015).
- Cho, N. B., Wong, J., Kazanzides, P. Dose Painting with a Variable Collimator for the Small Animal Radiation Research Platform (SARRP). The Midas Journal. , 1-8 (2014).
- Bolcaen, J., et al. MRI-guided 3D conformal arc micro-irradiation of a F98 glioblastoma rat model using the Small Animal Radiation Research Platform (SARRP). Journal of Neuro-oncology. 120 (2), 257-266 (2014).
- Bolcaen, J., Descamps, B., Boterberg, T., Vanhove, C., Goethals, I. PET and MRI guided irradiation of a glioblastoma rat model using a micro-irradiator. Journal of Visualized Experiments: JoVE. (130), e56601 (2017).
- Verhoeven, J., et al. Technical feasibility of [18F]FET and [18F]FAZA PET guided radiotherapy in a F98 glioblastoma rat model. Radiation Oncology. 14 (1), 89 (2019).
- Hutterer, M., et al. FET PET: a valuable diagnostic tool in neuro-oncology, but not all that glitters is glioma. Neuro-oncology. 15 (3), 341-351 (2013).
- Stockhammer, F., Plotkin, M., Amthauer, H., Landeghem, F. K. H., Woiciechowsky, C. Correlation of F-18-fluoro-ethyl-tyrosin uptake with vascular and cell density in non-contrast-enhancing gliomas. Journal of Neuro-oncology. 88 (2), 205-210 (2008).
- . Mricron dicom to nifti converter. neuroimaging informatics tools and resources clearinghouse (nitrc) Available from: https://www.nitrc.org/projects/mricron (2015)
- . SPM12 Manual Available from: https://www.fil.ion.ucl.ac.uk/spm/doc/spm12_manual.pdf (2014)
- España, S., Marcinkowski, R., Keereman, V., Vandenberghe, S., Van Holen, R. DigiPET: Sub-millimeter spatial resolution small-animal PET imaging using thin monolithic scintillators. Physics in Medicine & Biology. 59 (13), 3405-3420 (2014).

