Migração Nuclear no Oócito de Drosophila
Summary
Em Drosophila,o núcleo oócito sofre migração dependente de microtúbulos durante a oogênese. Aqui, descrevemos um protocolo que foi desenvolvido para acompanhar a migração realizando imagens ao vivo em câmaras de ovos ex-vivo. Nosso procedimento mantém as câmaras de ovos vivas por 12 horas para adquirir filmes de lapso de tempo 3D multi-posição usando microscopia confocal de disco giratório.
Abstract
A imagem de células vivas é particularmente necessária para entender os mecanismos celulares e moleculares que regulam movimentos de organela, rearranjos de citoesqueleto ou padronagem de polaridade dentro das células. Ao estudar o posicionamento do núcleo oócito, as técnicas de imagem ao vivo são essenciais para capturar os eventos dinâmicos desse processo. A câmara de ovos Drosophila é uma estrutura multicelular e um excelente sistema modelo para estudar esse fenômeno devido ao seu grande tamanho e disponibilidade de inúmeras ferramentas genéticas. Durante a oogênese média de Drosophila, o núcleo migra de uma posição central dentro do oócito para adotar uma posição assimétrica mediada por forças geradas por microtúbulos. Essa migração e posicionamento do núcleo são necessários para determinar os eixos de polaridade do embrião e da mosca adulta subsequente. Uma característica dessa migração é que ela ocorre em três dimensões (3D), criando uma necessidade de imagem viva. Assim, para estudar os mecanismos que regulam a migração nuclear, desenvolvemos um protocolo para cultivar as câmaras de ovos dissecadas e realizar imagens ao vivo por 12h por aquisições de lapso de tempo usando microscopia confocal de disco giratório. No geral, nossas condições nos permitem preservar as câmaras de ovos de Drosophila vivas por um longo período de tempo, permitindo assim que a conclusão da migração nuclear seja visualizada em um grande número de amostras em 3D.
Introduction
Por vários anos, o oócito Drosophila emergiu como um sistema modelo para estudar a migração nuclear. O oócito Drosophila desenvolve-se em uma estrutura multicelular chamada câmara de ovos. Câmaras de ovos abrangem 16 células germinativas (15 células enfermeiras e o oócito) cercadas por uma camada epitelial de células somáticas foliculares. O desenvolvimento da câmara de ovos foi subdividido em 14 etapas (Figura 1A), durante as quais o oócito crescerá e acumulará reservas necessárias para o desenvolvimento precoce do embrião. Durante o desenvolvimento, após a reorganização microtúbula e o transporte assimétrico de determinantes maternos, o oócito polariza ao longo dos eixos antero-dorsal e dorso-ventral. Estes eixos determinam os eixos de polaridade subsequentes do embrião e do adulto decorrentes da fertilização deste oócito1. Durante a oogênese, o núcleo adota uma posição assimétrica no oócito. No estágio 6, o núcleo é centrado na célula. Após um sinal ainda não identificado emitido pelas células foliculares posteriores recebidas pelo oócito, o núcleo migra em direção à intersecção entre as membranas plasmáticas anterior e lateral no estágio 7 (Figura 1B)2,3. Esta posição assimétrica é necessária para induzir a determinação do eixo dorso-ventral.
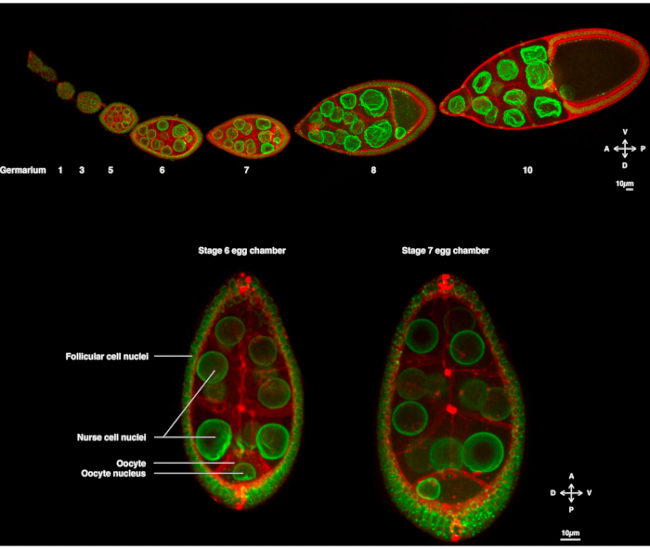
Figura 1: Câmaras deovos de melanogaster de Drosophila. (A) Ovário fixo de moscas transgênicas expressando Fs(2)Ket-GFP que rotula os envelopes nucleares e ubi-PH-RFP que rotula as membranas plasmáticas. O ovário é composto de câmaras de ovos em diferentes estágios. A maturação aumenta ao longo do eixo antero-posterior com o germário na ponta anterior (esquerda) onde reside a célula-tronco do germe e o estágio mais antigo na ponta posterior (direita). (B) Z-projeção da câmara de ovo vivo por microscopia confocal de disco giratório no estágio 6 da oogênese (esquerda), na qual o núcleo está centrado no oócito. O núcleo migrará para adotar uma posição assimétrica no estágio 7 (à direita) em contato com a membrana plasmática anterior (entre o oócito e a célula enfermeira) e a membrana plasmática lateral (entre o oócito e as células foliculares). Esta posição induzirá a determinação do lado dorsal e, assim, o eixo dorso-ventral da câmara de ovos. Clique aqui para ver uma versão maior desta figura.
Por muitas décadas, essa migração nuclear tem sido estudada em tecidos fixos por imunossuagem. Essa abordagem tornou notavelmente possível demonstrar que esse processo depende de uma densa rede de microtúbulos4,5. Mais recentemente, desenvolvemos um protocolo que oferece condições compatíveis com imagens ao vivo do oócito durante várias horas, possibilitando estudar esse processo dinamicamente6.
Assim, pela primeira vez, pudemos descrever que o núcleo tem trajetórias preferenciais e características durante sua migração, uma ao longo da membrana plasmática anterior (APM) e outra ao longo da membrana plasmática lateral (LPM) do oócito (Figura 2). Esses resultados mais recentes ressaltam a importância dos protocolos de imagem ao vivo ao estudar processos dinâmicos, como a migração nuclear.
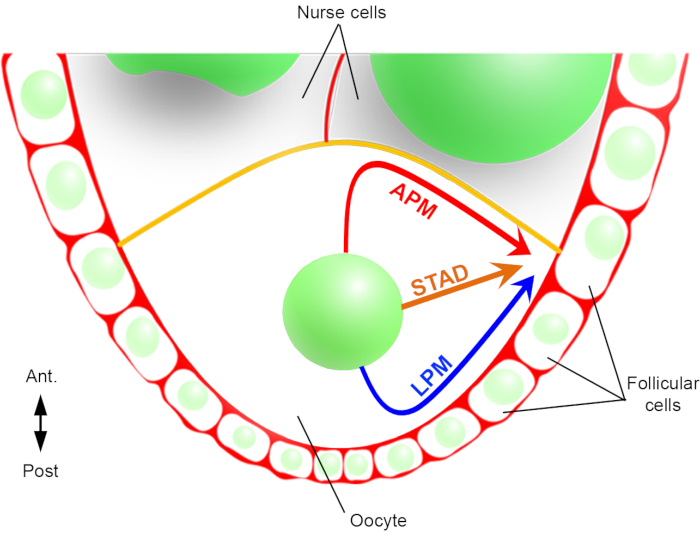
Figura 2: Representação esquemática dos diferentes caminhos migratórios do núcleo. No estágio 6 da oogênese, o oócito é uma grande célula com um núcleo central. Nesta fase, o eixo de polaridade antero-posterior é definido com uma membrana plasmática posterior/lateral do oócito em contato com as células foliculares e a membrana plasmática anterior (em amarelo) está em contato com as célulasenfermeiras 2. Já relatamos anteriormente que o núcleo poderia migrar ao longo da membrana plasmática anterior (APM), ao longo da membrana plasmática lateral (LPM), ou através do citoplasma (STAD, direto para o córtex antero-dorsal)6. Clique aqui para ver uma versão maior desta figura.
A migração do núcleo oócito é um fenômeno de cerca de 3 h6, e até agora, o evento que desencadeia o início da migração real é desconhecido. O início da migração também pode ser adiado por mutantes proteicos usados para estudar este mecanismo. Essas variáveis desconhecidas nos motivaram a adquirir imagens por longos períodos (10-12 h). É, portanto, importante garantir que os oócitos permaneçam vivos. À medida que a câmara de ovos se desenvolve, ela se alonga ao longo do eixo antero-posterior de uma forma esférica para uma forma elíptica. Esse alongamento é impulsionado pela rotação de células foliculares, que ocorre do estágio 1 ao estágio 8, perpendicular ao eixo antero-posterior7. Além disso, uma baia tubular de músculo com propriedade pulsante envolve as câmaras de ovos. Sua função fisiológica é empurrar os folículos em desenvolvimento em direção ao oviduto continuamente8. Para limitar os movimentos que induzem oscilações das câmaras de ovos após sua dissecção, projetamos uma microcerveca de observação medindo 150 μm de altura(Figura 3A). Esta altura é marginalmente maior do que o tamanho de um folículo nos estágios 10 e 11. Limita consideravelmente os movimentos verticais da amostra, preservando a rotação da câmara de ovos, resultando em defeitos limitados no desenvolvimento do folículo. Em seguida, realizamos imagens ao vivo por 12 h em câmaras de ovos dissecadas por aquisições de lapso de tempo de várias posições usando um microscópio confocal de disco giratório. Aqui descrevemos nosso protocolo para estudar a migração nuclear oócito entre as etapas 6 e 7.
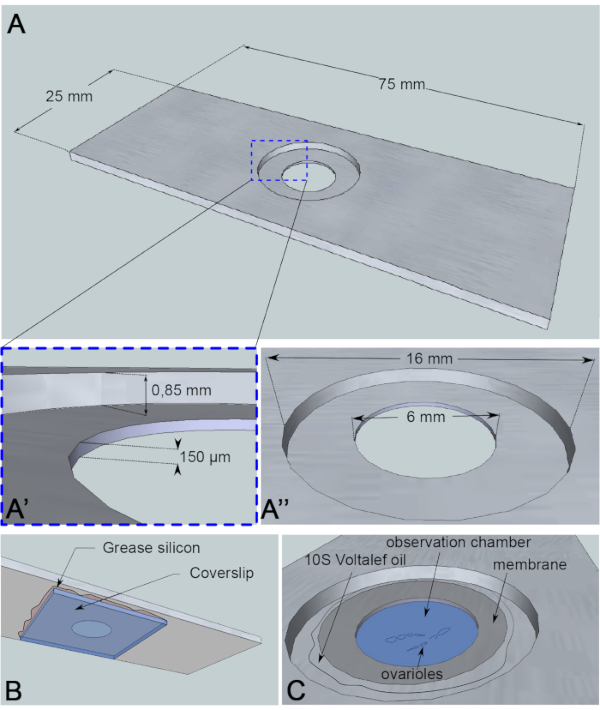
Figura 3: Representação esquemática da câmara de observação. (A) (Visão superior) Dimensões precisas do deslizamento de alumínio com as alturas (A’) e circunferências (A”) do poço perfurado no meio do slide. (B) (Vista inferior) Um deslizamento que bloqueia o poço é selado ao escorregador com graxa de silício. (C) (Visão superior) As ovários dissecadas desenvolvem-se em um meio de imagem coberto por uma membrana permeável a gás. O óleo de halocarboneto é usado para estabilizar a membrana. Clique aqui para ver uma versão maior desta figura.
Para acompanhar a migração nuclear e avaliar precisamente as trajetórias no oócito, são necessários marcadores tanto para o envelope nuclear quanto para a membrana plasmática. Com esse objetivo, dois transgenes que têm uma alta relação sinal/ruído e não desaparecem ao longo da imagem ao vivo foram selecionados. Para rotular a membrana plasmática, recomenda-se o uso de um P[ubi-PH-RFP] que codifica o domínio de Homologia Pleckstrina (PH) do Domínio de Fosfolipase Humana C ∂1 (PLC∂1) fundido à RFP. Este domínio PH se liga ao fosforinositide PI(4,5)P2 distribuído ao longo da membrana plasmática do oócito9. Para o envelope nuclear, a cepa p[PPT-un1]Fs(2)Ket-GFP protein-trap cep onde o GFP é inserido dentro do gene codificador da Drosophila ß-importin exibe um sinal homogêneo e intenso10. Moscas jovens (1-2 dias de idade) são colocadas em frascos frescos contendo levedura seca 24-48 h antes da dissecção do ovário.
Para este ensaio de imagem viva, um pedaço de alumínio de 1 mm de espessura, que não é reativo para a amostra, foi cortado nas dimensões de um slide de microscopia. Tem um orifício de 16 mm de diâmetro no centro da lâmina que foi contra-feito para 0,85 mm. Este contra-ataque tem um orifício adicional de 6 mm de diâmetro com uma profundidade de 150 μm(Figura 3A). Uma mancha de cobertura é colada com graxa de silicone (inerte para a amostra) na parte inferior da câmara dealumínio (Figura 3B). Após a colocação das amostras no poço de preenchimento médio, uma membrana permeável à troca O2/CO2 é colocada sobre o médio e cercada por óleo de halocarboneto(Figura 3C).
Para a dissecção, recomenda-se o uso de fórceps de aço inoxidável com uma dimensão de ponta de 0,05 x 0,02 mm, e agulhas de 0,20 mm de diâmetro para a separação dos ovários(Figura 4B,C). Os núcleos migratórios são retratados em um microscópio invertido de disco giratório CSU-X1 equipado com uma câmera. Imagens multi-posições foram adquiridas por lapso de tempo a cada 15 min a 24 °C. Um intervalo de 15 minutos permite a realização de aquisições multi-posições com fotobleaching limitado das proteínas fluorescentes e fototoxicidade para as amostras. Além disso, um intervalo mais curto não forneceria dados muito mais informativos para seguir as trajetórias nucleares. Os filmes são processados e analisados via software Fiji11.
Protocol
Representative Results
Discussion
Outros protocolos descrevem como preparar e cultivar câmaras de ovos Drosophila ex vivo para ensaio de imagem ao vivo12,13. A novidade deste protocolo é o uso de uma câmara de imagem construída usando um slide de alumínio oco, um deslizamento de tampa e uma membrana permeável O2/CO2. A principal vantagem desta configuração é limitar o movimento em Z sem exercer pressão sobre a amostra. Assim, o oócito ainda pode se mover …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Somos extremamente gratos a Jean-Antoine Lepesant e Nicolas Tissot que originalmente desenvolveram o protocolo e compartilharam alguns elementos gráficos da Figura 3 conosco. Agradecemos a Fanny Roland-Gosselin que tirou as fotos da Figura 4. Agradecemos também a outros membros do laboratório por discussões úteis que contribuíram para a amenização desta técnica e Nathaniel Henneman por seus comentários que ajudaram a melhorar este manuscrito. Reconhecemos a instalação central ImagoSeine do Instituto Jacques Monod, membro da France-BioImaging (ANR-10-INBS-04). Maëlys Loh é apoiada por uma bolsa de doutorado do Ministério da Pesquisa francês (MESRI). Antoine Guichet e Fred Bernard foram apoiados pelo ARC (Grant PJA20181208148), pela Association des Entreprises contre le Cancer (Grant Gefluc 2020 #221366) e por uma bolsa de emergência da IdEx Université de Paris (ANR-18-IDEX-0001).
Materials
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24×50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 – 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 – 188 | Observation-chamber preparation |
References
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891 (2009).
- Bernard, F., Lepesant, J. -. A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168 (2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Biologie du développement. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ‘ n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).

