Fibroblast afledte humane manipuleret bindevæv til screeningsapplikationer
Summary
Præsenteret her er en protokol til at generere manipuleret bindevæv til en parallel kultur på 48 væv i en multi-brønd plade med dobbelt poler, egnet til mekanistiske undersøgelser, sygdom modellering, og screening applikationer. Protokollen er kompatibel med fibroblaster fra forskellige organer og arter og er eksemplificeret her med humane primære hjertefibroblaster.
Abstract
Fibroblaster er fænotypisk meget dynamiske celler, som hurtigt transdifferentierer sig til myokbroblaster som reaktion på biokemiske og biomekaniske stimuli. Den nuværende forståelse af fibrotiske processer, herunder hjertefibrose, er fortsat dårlig, hvilket hæmmer udviklingen af nye anti-fibrotiske behandlinger. Kontrollerbare og pålidelige menneskelige modelsystemer er afgørende for en bedre forståelse af fibrosepatologi. Dette er en meget reproducerbar og skalerbar protokol til at generere manipuleret bindevæv (ECT) i en 48-brønd støbning plade til at lette undersøgelser af fibroblaster og patofysiologi af fibrotisk væv i en 3-dimensionel (3D) miljø. ECT genereres omkring polerne med tunable stivhed, giver mulighed for undersøgelser under en defineret biomekanisk belastning. Under de definerede belastningsforhold kan fænotypiske tilpasninger, der kontrolleres af cellematrixinteraktioner, studeres. Parallel testning er mulig i 48-brønd-format med mulighed for time-course analyse af flere parametre, såsom væv komprimering og sammentrækning mod belastningen. Fra disse parametre kan biomekaniske egenskaber som vævsstivhed og elasticitet studeres.
Introduction
En væsentlig hindring i studiet af fibrotiske sygdomme er manglen på repræsentative menneskelige 3D-vævsmodeller, der giver indsigt i fibroblasters adfærd og deres patologiske derivater. For at studere fibrotiske processer er standard 2D-kultursystemer suboptimale, da isolerede fibroblaster hurtigt transdifferentierer sig til α-smooth muscle actin (SMA)-udtrykke myokbroblaster, når de dyrkes på ikke-kompatible 2D-substrater1,2,3. Fibroblaster i standard 2D-kulturen afspejler således ikke en regelmæssig “sund” vævsfænotype3,4,5,6. Kulturer på bøjelige substrater er blevet indført for at simulere ikke-fibrotiske (10 kPa) og fibrotiske (35 kPa) vævsmiljøer7, men disse mangler den tredje dimension, hvilket er meget vigtigt med hensyn til patofysiologi. Vævsteknik giver mulighed for at overvinde denne begrænsning ved at tillade fibroblastkultur i en defineret og eksperimentelt tunable ekstracellulær matrix (ECM)-kontekst, for eksempel ved ændringer i cellulæritet, ECM-sammensætning og ECM-koncentration, som alle kan bestemme vævsbiomekanikken.
Forskellige 3D-modeller er blevet genereret ved hjælp af fibroblaster. Flydende diske og mikrosfærer var blandt de første og viser, at kollagen er ombygget og komprimeret på en tidsafhængig måde. Fibroblaster udøver trækkraft på kollagen fibrils, en proces, der kan lettes ved tilsætning af pro-fibrotiske midler såsom omdanne vækstfaktor-beta 1 (TGF-β1)8,9,10,11,12,13,14,15,16. Frit flydende kulturer giver dog ikke mulighed for kontrolleret ekstern belastning og udgør derfor kontinuerligt krympende eller komprimeringsmodeller. Arklignende manipuleret væv åbnede muligheden for at studere homøostatisk regulering af vævs biomekaniske egenskaber, nemlig gennem uni- bi-, multiaxial- eller cyklisk stammetest17,18,19,20. Disse modeller er blevet anvendt, f.eks. til at påvise cellenummerets indflydelse på vævsstivheden, som viste sig at korrelere positivt med cytoskeletonintegritet og actomyosin cytoskeleton contractility18,19. Det er dog vigtigt at bemærke, at kraft-til-stamme konverteringer kompliceres af den ikke-ensartede væv deformation omkring klemme punkter af kraft transducere og ankerpunkter. Denne iboende begrænsning kan omgås af hunde-knogle eller ring-formede væv, tilbyder nogle væv håndhævelse på anker-punkter21,22,23. Ringformede væv kan fremstilles ved at distribuere en celle-kollagen hydrogel i ringformede forme. Som hydrogel komprimerer, et væv former omkring dekomprimerbare indre stang af formen, som giver resistens for yderligere væv sammentrækning24,25,26,27. Efter indledende og typisk maksimal komprimering kan væv også overføres til justerbare afstandslænde til yderligere at begrænse cirkulære ECT på en defineret vævslængde3,24,25,26,27,28,29,30. Biofysiske egenskaber kan vurderes i standard horisontale eller lodrette belastningsspændingsenheder med passende belastningsceller under ensrettet eller dynamisk stamme3. Da vævene har en stort set ensartet cirkulær struktur og kan holdes på stænger / kroge (forankringspunkter og / eller krafttransducere), selvom disse stadig kan omslutte kompressionsområder omkring læssestængerne, giver dette format en mere ensartet stammevariation sammenlignet med fastspænding3. Desuden fremkalder forankret væv en bipolar celleform, og cellerne tilpasser sig vævskræfterne ved forlængelse langs kraftlinjer, der fremmer anisotropisk trækkraft31,32,33,34,35,36. Vi har tidligere anvendt ringformet ECT fra rotte- og humane hjertefibroblaster (CF) omkring en enkelt stiv stang i funktionelle stress-stammeforsøg og udført gain og tab af funktionsundersøgelser ved hjælp af viralt transduced fibroblaster24,25,26 og farmakologiske undersøgelser37. Desuden kunne vi identificere kønsforskelle i CF-medieret fibrose i ECT-modellen27.
Følgende protokol for generering af human ECT, eksemplificeret med primær human CF opnået som cryopreserved CF fra kommercielle leverandører (se Tabel over materialer), kombinerer fordelene ved ringformede væv med en nem og hurtig måde at producere makroskopisk væv til en 48-brønd platform designet til parallel højindhold test.
Det er vigtigt, at ECT-modellen ikke er begrænset til en bestemt fibroblasttype med dokumenteret anvendelse i forbindelse med undersøgelse af andre fibroblaster, f.eks. Desuden fungerer fibroblaster fra patientens biopsier lige så godt, og valget af fibroblaster afhænger i sidste ende af det videnskabelige spørgsmål, der skal løses.
Den platform, der anvendes til generering af ECT, der er beskrevet i denne protokol, er en kommercielt tilgængelig 48-brønd 3D-celle/vævskulturplade (figur 1A). Metoderne til forberedelse, dyrkning og overvågning af ECT-dannelse og -funktion under en defineret geometri og mekanisk belastning ved hjælp af 48-brøndpladen er beskrevet. Den dannede ECT holdes af integrerede fleksible poler, og den mekaniske belastning kan finjusteres i henhold til det endelige formål ved at bruge poler med forskellig hårdhed (Shore A-værdi 36-89), hvilket påvirker deres bøjningsstivheder. Polakker med en kyst En værdi på 46 anbefales. Protokollen er desuden kompatibel med en tidligere beskrevet brugerdefineret cirkulær form, hvor ECT holdes omkring en enkelt stiv stang37. Dimensionerne af denne form er angivet i figur 1B.
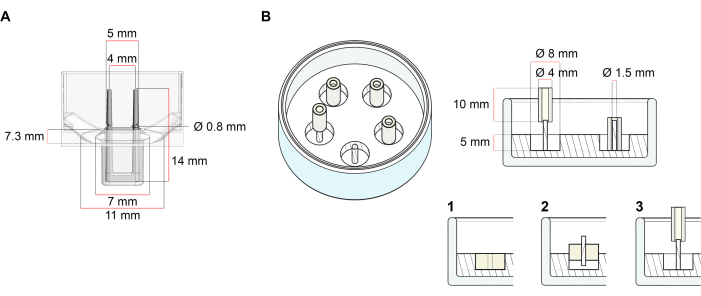
Figur 1: Skematisk repræsentation af støbning forme. A) Teknisk tegning og dimensioner af en støbeform med to fleksible poler. Formen består af en indre omkreds afgrænset af en kort væg, der holder dobbelt fastholde poler på formens hovedkrop. De fleksible poler har en fri vandret afstand til hinanden og er forbundet ved bunden. Formen giver mulighed for 180 μL støbning volumen. Brønden af hver form giver en volumen kapacitet på mindst 600 μL af kultur medier. Forskellige materialesammensætninger kan bruges til at producere poler med specifikke stivheder (f.eks. TM5MED-TM9MED). (B) Teknisk tegning og dimensioner af en ringformet form med en enkelt stiv stang. Dette er en alternativ form med tydelig geometri og mekanisk miljø, som kan bruges med ECT støbning protokol37. Den ringformede skimmelsamlingsmetode blev tilpasset fra offentliggjorte større formater28,41. Kort sagt omfatter metoden (1) prægning af polytetrafluoroethylen (PTFE) støbningsrumsstykker (8 mm diameter) i polydimethylsiloxan (PDMS, silikone), hældt i glasskåle (diameter 60 mm) og (2) fastgørelse af en PDMS-stangholder (1,5 mm diameter) koncentrisk inde i det dannede hulrum, som tjener til (3) at holde en aftagelig stang (4 mm diameter silikonerør). Den hule rum resulterende giver mulighed for 180 μL af støbning volumen. Hver glasskål kan comport flere påtrykte forme (eksemplarisk vist med 5 forme) og har kapacitet til op til 5 mL kulturmedium. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Den præsenterede protokol beskriver dannelsen af ECT fra primær human CF, som gør det muligt at studere disse cellers mekaniske indvirkning på deres ekstracellulære matrixmiljø og omvendt.
Fibroblastene skal udvides til at give tilstrækkelige celler til de planlagte ECT-eksperimenter (0,75 x 106 celler/ECT). For at opnå den bedste reproducerbarhed anbefales det at prækulturelle frosne eller vævsbaserede fibroblaster i 2D monolagskultur i en standardiseret varighed på op t…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af Det Tyske Hjerteselskab (DGK Research Fellowship for GLS) og af den tyske forskningsfond (DFG gennem projektet IRTG 1816 for GLS og AD; DFG 417880571 og DFG TI 956/1-1 for MT; SFB 1002 TP C04 for MT og WHZ; SFB 1002 TP S01 for WHZ; og EXC 2067/1-390729940J for WHZ). WHZ støttes af det tyske forbundsministerium for videnskab og uddannelse (BMBF gennem projektet IndiHEART) og Fondation Leducq (20CVD04). MT, WHZ og SL støttes af det tyske Center for Cardiovascular Research (DZHK).
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
References
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

