Tissu conjonctif humain dérivé de fibroblastes pour les applications de dépistage
Summary
Présenté ici est un protocole pour générer des tissus conjonctifs modifiés pour une culture parallèle de 48 tissus dans une plaque multi-puits avec des doubles pôles, adapté aux études mécanistes, à la modélisation des maladies et aux applications de dépistage. Le protocole est compatible avec les fibroblastes de différents organes et espèces et est illustré ici avec les fibroblastes cardiaques primaires humains.
Abstract
Les fibroblastes sont des cellules phénotypiquement très dynamiques, qui se transdifférencient rapidement en myofibroblastes en réponse à des stimuli biochimiques et biomécaniques. La compréhension actuelle des processus fibrotiques, y compris la fibrose cardiaque, reste médiocre, ce qui entrave le développement de nouvelles thérapies anti-fibrotiques. Des systèmes modèles humains contrôlables et fiables sont essentiels pour une meilleure compréhension de la pathologie de la fibrose. Il s’agit d’un protocole hautement reproductible et évolutif pour générer des tissus conjonctifs (ECT) dans une plaque de coulée de 48 puits afin de faciliter l’étude des fibroblastes et la physiopathologie du tissu fibrotique dans un environnement en 3 dimensions (3D). Les ECT sont générés autour des pôles avec une rigidité accordable, ce qui permet des études sous une charge biomécanique définie. Dans les conditions de charge définies, les adaptations phénotypiques contrôlées par les interactions cellule-matrice peuvent être étudiées. Les tests parallèles sont réalisables dans le format 48 puits avec la possibilité d’analyser le temps de plusieurs paramètres, tels que le compactage et la contraction des tissus par rapport à la charge. À partir de ces paramètres, des propriétés biomécaniques telles que la rigidité et l’élasticité des tissus peuvent être étudiées.
Introduction
Un obstacle majeur dans l’étude des maladies fibrotiques est le manque de modèles de tissus 3D humains représentatifs qui fournissent un aperçu du comportement des fibroblastes et de leurs dérivés pathologiques. Pour étudier les processus fibrotiques, les systèmes de culture 2D standard sont sous-optimaux puisque les fibroblastes isolés se transdifférencient rapidement en myofibroblastes exprimant l’actine musculaire α lisse (SMA) lorsqu’ils sont cultivés sur des substrats 2D non conformes1,2,3. Ainsi, les fibroblastes de la culture 2D standard ne reflètent pas un phénotype tissulaire « sain » régulier3,4,5,6. Des cultures sur substrats souples ont été introduites pour simuler des environnements tissulaires non fibrotiques (10 kPa) et fibrotiques (35 kPa)7, mais ceux-ci n’ont pas la troisième dimension, ce qui est très important en ce qui concerne la physiopathologie. L’ingénierie tissulaire offre la possibilité de surmonter cette limitation en permettant la culture de fibroblastes dans un contexte défini et expérimentalement accordable de matrice extracellulaire (ECM), par exemple, par des altérations de la cellularité, de la composition ecm et de la concentration ECM, qui peuvent toutes déterminer la biomécanique tissulaire.
Divers modèles 3D ont été générés à l’aide de fibroblastes. Les disques flottants et les microsphères ont été parmi les premiers et démontrent que le collagène est remodelé et compacté en fonction du temps. Les fibroblastes exercent des forces de traction sur les fibrilles de collagène, un processus qui peut être facilité par l’ajout d’agents pro-fibrotiques tels que le facteur de croissance transformant bêta 1 (TGF-β1)8,9,10,11,12,13,14,15,16. Cependant, les cultures flottant librement ne permettent pas la charge externe contrôlée et constituent donc des modèles de rétrécissement ou de compactage continus. Les tissus modifiés en forme de feuille ont ouvert la possibilité d’étudier la régulation homéostatique des propriétés biomécaniques des tissus, notamment par des tests de déformation uni, bi, multiaxiale ou cyclique.17,18,19,20. Ces modèles ont été utilisés, par exemple, pour démontrer l’influence du nombre de cellules sur la rigidité tissulaire, qui s’est avérée être en corrélation positive avec l’intégrité du cytosquelette et la contractilité du cytosquelette d’actomyosine.18,19. Cependant, il est important de noter que les conversions force-déformation sont compliquées par la déformation tissulaire non uniforme autour des points de serrage des transducteurs de force et des points d’ancrage. Cette limitation inhérente peut être contournée par des tissus en forme d’os de chien ou d’anneau, offrant une certaine application tissulaire aux points d’ancrage.21,22,23. Les tissus en forme d’anneau peuvent être préparés en distribuant un hydrogel de collagène cellulaire dans des moules en forme d’anneau. Au fur et à mesure que l’hydrogel se compacte, un tissu se forme autour de la tige interne incompressible du moule, ce qui offre une résistance à la contraction ultérieure des tissus.24,25,26,27. Après un compactage initial et généralement maximal, les tissus peuvent également être transférés à des entretoises réglables pour restreindre davantage l’ECT circulaire à une longueur de tissu définie.3,24,25,26,27,28,29,30. Les propriétés biophysiques peuvent être évaluées dans des dispositifs de contrainte de déformation horizontaux ou verticaux standard avec des capteurs de pesage appropriés sous déformation unidirectionnelle ou dynamique3. Comme les tissus ont une structure circulaire largement uniforme et peuvent être maintenus sur des barres / crochets (points d’ancrage et / ou transducteurs de force), bien que ceux-ci puissent encore entourer des zones de compression autour des barres de chargement, ce format permet une variation de déformation plus uniforme par rapport au serrage3. De plus, les tissus ancrés provoquent une forme de cellule bipolaire, et les cellules s’adaptent aux forces tissulaires en s’allongeant le long des lignes de force favorisant la traction anisotrope31,32,33,34,35,36. Nous avons déjà appliqué de l’ECT en forme d’anneau à partir de fibroblastes cardiaques (FK) de rats et d’humains autour d’un seul pôle rigide dans des expériences de contrainte fonctionnelle et effectué des études de gain et de perte de fonction en utilisant des fibroblastes transductés viralement24,25,26 et études pharmacologiques37. De plus, nous avons pu identifier les différences entre les sexes dans la fibrose médiée par la mucoviscidose dans le modèle ECT27.
Le protocole suivant pour la génération d’ECT humain, illustré par la mucoviscidose humaine primaire obtenue sous forme de mucoviscidose cryoconservée auprès de fournisseurs commerciaux (voir Tableau des matériaux), combine les avantages des tissus en forme d’anneau avec un moyen simple et rapide de produire des tissus macroscopiques pour une plate-forme de 48 puits conçue pour des tests parallèles à haute teneur.
Il est important de noter que le modèle ECT ne se limite pas à un type spécifique de fibroblastes, avec l’utilisation documentée dans l’étude d’autres fibroblastes, par exemple les fibroblastes de la peau38,39. De plus, les fibroblastes issus des biopsies des patients fonctionnent tout aussi bien, et le choix des fibroblastes dépend en fin de compte de la question scientifique à aborder.
La plate-forme utilisée pour la génération d’ECT décrite dans ce protocole est une plaque de culture cellulaire/tissulaire 3D de 48 puits disponible dans le commerce (Figure 1A). Les méthodes de préparation, de culture et de surveillance de la formation et du fonctionnement de l’ECT sous une géométrie et une charge mécanique définies à l’aide de la plaque de 48 puits sont décrites. Les ECT formés sont maintenus par des poteaux flexibles intégrés et la charge mécanique peut être ajustée en fonction de l’objectif final en utilisant des poteaux de dureté différente (valeur Shore A 36-89), influençant leurs rigidités en flexion. Les poteaux avec un rivage Une valeur de 46 sont recommandés. Le protocole est, en outre, compatible avec un moule circulaire personnalisé décrit précédemment, où l’ECT est maintenu autour d’une seule tige rigide37. Les dimensions de ce moule sont données à la figure 1B.
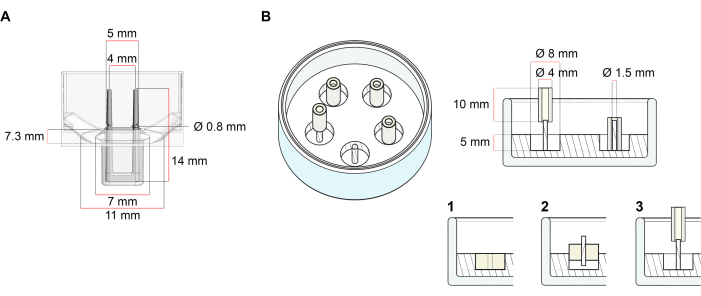
Figure 1 : Représentation schématique des moules de coulée. (A) Dessin technique et dimensions d’un moule de coulée avec deux pôles flexibles. Le moule comprend une circonférence intérieure délimitée par une paroi courte qui maintient des doubles pôles de retenue au corps principal du moule. Les pôles flexibles ont une distance horizontale libre les uns par rapport aux autres et sont connectés à la base. Le moule permet un volume de coulée de 180 μL. Le puits de chaque moule permet une capacité de volume d’au moins 600 μL de milieux de culture. Différentes compositions de matériaux peuvent être utilisées pour produire des pôles avec des rigidités spécifiques (par exemple, TM5MED-TM9MED). (B) Dessin technique et dimensions d’un moule en forme d’anneau avec une seule tige rigide. Il s’agit d’un moule alternatif avec une géométrie et un environnement mécanique distincts, qui peut être utilisé avec le protocole de coulée ECT37. La méthode d’assemblage du moule en forme d’anneau a été adaptée à partir de formats plus grands publiés28,41. En bref, la méthode comprend (1) l’impression d’entretoises de moulage en polytétrafluoroéthylène (PTFE) (8 mm de diamètre) dans du polydiméthylsiloxane (PDMS, silicone) versé dans des boîtes en verre (diamètre 60 mm), et (2) la fixation d’un support de poteau PDMS (1,5 mm de diamètre) concentriquement à l’intérieur de la cavité creuse formée, qui sert à (3) maintenir un pôle amovible (tube en silicone de 4 mm de diamètre). L’espace creux résultant permet 180 μL de volume de coulée. Chaque plat en verre peut contenir plusieurs moules imprimés (illustrés de manière exemplaire avec 5 moules) et a une capacité allant jusqu’à 5 mL de milieu de culture. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Le protocole présenté décrit la génération d’ECT à partir de la mucoviscidose humaine primaire, ce qui permet d’étudier l’impact mécanique de ces cellules sur leur environnement de matrice extracellulaire et vice versa.
Les fibroblastes doivent être élargis pour produire suffisamment de cellules pour les expériences ECT prévues (0,75 x 106 cellules / ECT). Pour une meilleure reproductibilité, il est conseillé de pré-cultiver des fibroblastes congelés ou dériv?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par la Société allemande de cardiologie (bourse de recherche DGK pour GLS) et par la Fondation allemande pour la recherche (DFG à travers le projet IRTG 1816 pour GLS et AD; DFG 417880571 et DFG TI 956/1-1 pour MT; SFB 1002 TP C04 pour MT et WHZ; SFB 1002 TP S01 pour WHZ; et EXC 2067/1-390729940J pour WHZ). WHZ est soutenu par le ministère fédéral allemand de la Science et de l’Éducation (BMBF à travers le projet IndiHEART) et la Fondation Leducq (20CVD04). MT, WHZ et SL sont soutenus par le Centre allemand de recherche cardiovasculaire (DZHK).
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
References
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Biologie du développement. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

