Tejido conectivo de ingeniería humana derivado de fibroblastos para aplicaciones de detección
Summary
Aquí se presenta un protocolo para generar tejidos conectivos diseñados para un cultivo paralelo de 48 tejidos en una placa de múltiples pocillos con polos dobles, adecuado para estudios mecanicistas, modelado de enfermedades y aplicaciones de detección. El protocolo es compatible con fibroblastos de diferentes órganos y especies y se ejemplifica aquí con fibroblastos cardíacos primarios humanos.
Abstract
Los fibroblastos son células fenotípicamente altamente dinámicas, que se transdiferencian rápidamente en miofibroblastos en respuesta a estímulos bioquímicos y biomecánicos. La comprensión actual de los procesos fibróticos, incluida la fibrosis cardíaca, sigue siendo deficiente, lo que dificulta el desarrollo de nuevas terapias antifibróticas. Los sistemas de modelos humanos controlables y confiables son cruciales para una mejor comprensión de la patología de la fibrosis. Este es un protocolo altamente reproducible y escalable para generar tejidos conectivos (TEC) diseñados en una placa de fundición de 48 pocillos para facilitar los estudios de fibroblastos y la fisiopatología del tejido fibrótico en un entorno tridimensional (3D). Los ECT se generan alrededor de los polos con rigidez sintonizable, lo que permite estudios bajo una carga biomecánica definida. Bajo las condiciones de carga definidas, se pueden estudiar adaptaciones fenotípicas controladas por interacciones célula-matriz. Las pruebas paralelas son factibles en el formato de 48 pocillos con la oportunidad de analizar el curso de tiempo de múltiples parámetros, como la compactación y contracción del tejido contra la carga. A partir de estos parámetros, se pueden estudiar propiedades biomecánicas como la rigidez y elasticidad de los tejidos.
Introduction
Un obstáculo importante en el estudio de las enfermedades fibróticas es la falta de modelos representativos de tejidos humanos en 3D que proporcionen información sobre el comportamiento de los fibroblastos y sus derivados patológicos. Para estudiar los procesos fibróticos, los sistemas de cultivo 2D estándar son subóptimos, ya que los fibroblastos aislados se transdiferencian rápidamente en miofibroblastos que expresan actina del músculo α liso (AME) cuando se cultivan en sustratos 2D no conformes1,2,3. Por lo tanto, los fibroblastos en el cultivo 2D estándar no reflejan un fenotipo tisular “sano” regular3,4,5,6. Se han introducido cultivos sobre sustratos flexibles para simular ambientes tisulares no fibróticos (10 kPa) y fibróticos (35 kPa)7, pero estos carecen de la tercera dimensión, que es muy importante con respecto a la fisiopatología. La ingeniería de tejidos brinda la oportunidad de superar esta limitación al permitir el cultivo de fibroblastos en un contexto de matriz extracelular (ECM) definido y experimentalmente sintonizable, por ejemplo, por alteraciones en la celularidad, la composición de ECM y la concentración de ECM, todo lo cual puede determinar la biomecánica del tejido.
Se han generado varios modelos 3D utilizando fibroblastos. Los discos flotantes y las microesferas estuvieron entre los primeros y demuestran que el colágeno se remodela y compacta de una manera dependiente del tiempo. Los fibroblastos ejercen fuerzas de tracción sobre las fibrillas de colágeno, un proceso que puede facilitarse mediante la adición de agentes profibróticos como el factor de crecimiento transformador beta 1 (TGF-β1)8,9,10,11,12,13,14,15,16. Sin embargo, los cultivos que flotan libremente no permiten la carga externa controlada y, por lo tanto, constituyen modelos que se encogen o compactan continuamente. Los tejidos diseñados en forma de lámina abrieron la posibilidad de estudiar la regulación homeostática de las propiedades biomecánicas de los tejidos, es decir, a través de pruebas de deformación uni, bi, multiaxial o cíclica.17,18,19,20. Estos modelos se han utilizado, por ejemplo, para demostrar la influencia del número de células en la rigidez del tejido, que se encontró que se correlaciona positivamente con la integridad del citoesqueleto y la contractilidad del citoesqueleto de actomiosina.18,19. Sin embargo, es importante tener en cuenta que las conversiones de fuerza a deformación se complican por la deformación no uniforme del tejido alrededor de los puntos de sujeción de los transductores de fuerza y los puntos de anclaje. Esta limitación inherente puede ser evitada por tejidos de hueso de perro o en forma de anillo, ofreciendo cierta aplicación de tejidos en los puntos de anclaje.21,22,23. Los tejidos en forma de anillo se pueden preparar distribuyendo un hidrogel de colágeno celular en moldes en forma de anillo. A medida que el hidrogel se compacta, se forma un tejido alrededor de la varilla interna incompresible del molde, que ofrece resistencia para una mayor contracción del tejido.24,25,26,27. Después de la compactación inicial y típicamente máxima, los tejidos también pueden transferirse a espaciadores ajustables para restringir aún más la TEC circular a una longitud de tejido definida.3,24,25,26,27,28,29,30. Las propiedades biofísicas pueden evaluarse en dispositivos estándar de tensión por deformación horizontal o vertical con células de carga adecuadas bajo deformación unidireccional o dinámica3. Como los tejidos tienen una estructura circular en gran medida uniforme y se pueden sostener en barras / ganchos (puntos de anclaje y / o transductores de fuerza), aunque estos aún pueden encerrar áreas de compresión alrededor de las barras de carga, este formato permite una variación de deformación más uniforme en comparación con el sujeción.3. Además, los tejidos anclados provocan una forma de célula bipolar, y las células se adaptan a las fuerzas del tejido por elongación a lo largo de las líneas de fuerza que promueven la tracción anisotrópica.31,32,33,34,35,36. Anteriormente hemos aplicado TEC en forma de anillo de fibroblastos cardíacos (FQ) de rata y humanos alrededor de un solo polo rígido en experimentos funcionales de tensión y tensión y hemos realizado estudios de ganancia y pérdida de función mediante el uso de fibroblastos transducidos viralmente.24,25,26 y estudios farmacológicos37. Además, pudimos identificar diferencias de sexo en la fibrosis mediada por FQ en el modelo de TEC27.
El siguiente protocolo para la generación de TEC humana, ejemplificado con la FQ humana primaria obtenida como FQ criopreservada de proveedores comerciales (ver Tabla de Materiales), combina las ventajas de los tejidos en forma de anillo con una forma fácil y rápida de producir tejidos macroscópicos para una plataforma de 48 pocillos diseñada para pruebas paralelas de alto contenido.
Es importante destacar que el modelo TEC no se restringe a un tipo específico de fibroblastos, con el uso documentado en la investigación de otros fibroblastos, por ejemplo, fibroblastos cutáneos38,39. Además, los fibroblastos de las biopsias del paciente funcionan igualmente bien, y la elección de los fibroblastos depende en última instancia de la cuestión científica que se debe abordar.
La plataforma utilizada para la generación de TEC descrita en este protocolo es una placa de cultivo de células/tejidos 3D de 48 pocillos disponible comercialmente (Figura 1A). Se describen los métodos para la preparación, el cultivo y el monitoreo de la formación y función de ECT bajo una geometría definida y carga mecánica con la ayuda de la placa de 48 pocillos. Los ECT formados se sujetan mediante postes flexibles integrados y la carga mecánica se puede ajustar de acuerdo con el propósito final mediante el uso de postes con diferente dureza (valor Shore A 36-89), influyendo en sus rigideces de flexión. Se recomiendan los polos con una orilla Un valor de 46. El protocolo es, además, compatible con un molde circular personalizado descrito anteriormente, donde el ECT se mantiene alrededor de una sola varilla rígida37. Las dimensiones de este molde se dan en la Figura 1B.
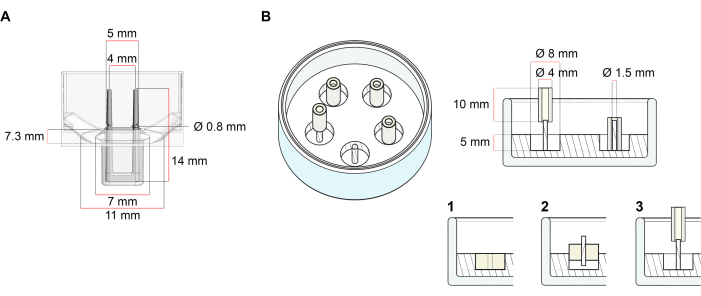
Figura 1: Representación esquemática de moldes de fundición. (A) Plano técnico y dimensiones de un molde de fundición con dos postes flexibles. El molde comprende una circunferencia interior delimitada por una pared corta que sostiene postes de retención dobles en el cuerpo principal del molde. Los polos flexibles tienen una distancia horizontal libre entre sí y están conectados en la base. El molde permite un volumen de fundición de 180 μL. El pozo de cada molde permite una capacidad de volumen de al menos 600 μL de medios de cultivo. Se pueden utilizar diferentes composiciones de materiales para producir postes con rigideces específicas (por ejemplo, TM5MED-TM9MED). (B) Dibujo técnico y dimensiones de un molde en forma de anillo con una sola varilla rígida. Se trata de un molde alternativo con geometría y entorno mecánico distintos, que se puede utilizar con el protocolo de fundición ECT37. El método de ensamblaje de moldes en forma de anillo se adaptó de formatos más grandes publicados28,41. En resumen, el método incluye (1) la impresión de espaciadores de moldeo de politetrafluoroetileno (PTFE) (8 mm de diámetro) en polidimetilsiloxano (PDMS, silicona) vertidos en platos de vidrio (diámetro 60 mm), y (2) la fijación de un soporte de poste PDMS (1,5 mm de diámetro) concéntricamente dentro de la cavidad hueca formada, que sirve para (3) sostener un poste extraíble (tubo de silicona de 4 mm de diámetro). El espacio hueco resultante permite 180 μL de volumen de fundición. Cada plato de vidrio puede contener múltiples moldes impresos (se muestra ejemplarmente con 5 moldes) y tiene la capacidad de hasta 5 ml de medio de cultivo. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El protocolo presentado describe la generación de TEC a partir de la FQ humana primaria, lo que permite estudiar el impacto mecánico de estas células en su entorno de matriz extracelular y viceversa.
Los fibroblastos deben expandirse para producir suficientes células para los experimentos de TEC planificados (0,75 x 106 células / TEC). Para la mejor reproducibilidad, se aconseja precultivar fibroblastos congelados o derivados de tejidos en cultivo monocapa 2D durante una duraci…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por la Sociedad Alemana de Cardiología (DGK Research Fellowship for GLS) y por la Fundación Alemana de Investigación (DFG a través del proyecto IRTG 1816 para GLS y AD; DFG 417880571 y DFG TI 956/1-1 para MT; SFB 1002 TP C04 para MT y WHZ; SFB 1002 TP S01 para WHZ; y EXC 2067/1-390729940J para WHZ). WHZ cuenta con el apoyo del Ministerio Federal Alemán de Ciencia y Educación (BMBF a través del proyecto IndiHEART) y la Fundación Leducq (20CVD04). MT, WHZ y SL cuentan con el apoyo del Centro Alemán de Investigación Cardiovascular (DZHK).
Materials
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
References
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095 (2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force–Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519 (2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Biologie du développement. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).

