Études des interactions chaperonne-cochapéroé à l’aide d’un essai homogène à base de billes
Summary
Ce protocole présente une technique pour sonder les interactions protéine-protéine à l’aide de perles de donneur liées au glutathion avec des co-chaperons à motif TPR fusionnés GST et des perles accepteurs couplées à un peptide dérivé de Hsp90. Nous avons utilisé cette technique pour dépister de petites molécules afin de perturber les interactions Hsp90-FKBP51 ou Hsp90-FKBP52 et identifié des inhibiteurs puissants et sélectifs de l’interaction Hsp90-FKBP51.
Abstract
Le ciblage des interactions protéine de choc thermique 90 (Hsp90)-cochaperone offre la possibilité de réguler spécifiquement les processus intracellulaires dépendants de Hsp90. Le pentapeptide MEEVD conservé à la terminaison C de Hsp90 est responsable de l’interaction avec le motif de répétition tétratricopeptide (TPR) des co-chaperons. FK506-binding protein (FKBP) 51 et FKBP52 sont deux co-chaperons similaires à motif TPR impliqués dans des maladies hormono-dépendantes stéroïdiennes avec des fonctions différentes. Par conséquent, l’identification de molécules bloquant spécifiquement les interactions entre Hsp90 et FKBP51 ou FKBP52 offre un potentiel thérapeutique prometteur pour plusieurs maladies humaines. Nous décrivons ici le protocole d’un test homogène de proximité luminescente amplifié pour sonder les interactions entre Hsp90 et ses co-chaperons partenaires FKBP51 et FKBP52. Tout d’abord, nous avons purifié les protéines FKBP51 et FKBP52 contenant des motifs TPR sous forme marquée glutathion S-transférase (GST). En utilisant les perles de donneur liées au glutathion avec des protéines À motif TPR fusionnées à la TPS et les perles accepteurs couplées à un peptide C-terminal 10-mer de Hsp90, nous avons sondé les interactions protéine-protéine dans un environnement homogène. Nous avons utilisé ce test pour dépister de petites molécules afin de perturber les interactions Hsp90-FKBP51 ou Hsp90-FKBP52 et identifié des inhibiteurs puissants et sélectifs de l’interaction Hsp90-FKBP51.
Introduction
Les chaperons moléculaires contribuent à l’homéostasie des protéines, y compris le repliement, le transport et la dégradation des protéines. Ils régulent plusieurs processus cellulaires et sont liés à de nombreuses maladies telles que le cancer et les maladies neurodégénératives1. La protéine de choc thermique 90 (Hsp90) est l’un des chaperons les plus importants dont la fonction dépend des changements conformationnels entraînés par l’hydrolyse de l’ATP et la liaison avec les protéines clientes médiées par ses co-chaperons2. Malgré un potentiel évident de Hsp90 en tant que cible thérapeutique, affiner sa fonction représente un grand défi. Il existe plusieurs inhibiteurs de Hsp90 ciblant la région de liaison de l’ATP N-terminal, qui ont été évalués dans des essais cliniques, mais aucun d’entre eux n’a été approuvé pour lacommercialisation 3. En raison de l’absence d’une poche de liaison au ligand4bien définie, le ciblage de la région C-terminale de Hsp90 a eu un succès limité4. Récemment, la perturbation des interactions Hsp90-cochaperone par de petites molécules a été étudiée comme stratégie alternative5. Le ciblage des interactions Hsp90-cochaperone ne provoquerait pas de réponse générale au stress cellulaire et offre la possibilité de réguler spécifiquement divers processus intracellulaires. Le pentapeptide MEEVD conservé à la terminaison C de Hsp90 est responsable de l’interaction avec le motif de répétition tétratricopeptide (TPR) des co-chaperons6. Sur les 736 protéines contenant des motifs TPR annotées dans la base de données des protéines humaines, environ 20 protéines différentes interagissent avec Hsp90 via ce peptide7. Les molécules en concurrence pour la liaison peptidique MEEVD perturberaient les interactions entre Hsp90 et les co-chaperons contenant un domaine TPR. Le site de liaison peptidique a une structure tertiaire similaire, mais l’homologie globale entre les différents domaines du motif TPR est relativement faible7,ce qui offre la possibilité d’identifier des molécules spécifiquement capables de bloquer les interactions entre Hsp90 et des co-chaperons particuliers à motif TPR. Parmi ces co-chaperons à motif TPR, la protéine de liaison FK506 (FKBP) 51 et FKBP52 sont des régulateurs de la signalisation des récepteurs hormonaux stéroïdiens (SHR) et impliqués dans plusieurs maladies hormono-dépendantes des stéroïdes, y compris le cancer, les maladies liées au stress, les maladies métaboliques et la maladie d’Alzheimer8. Bien que FKBP51 et FKBP52 partagent > similitude de séquence de 80%, leurs fonctions diffèrent: FKBP52 est un régulateur positif de l’activité SHR, tandis que FKBP51 est un régulateur négatif dans la plupart des cas8. Par conséquent, l’identification de molécules, bloquant spécifiquement les interactions entre Hsp90 et FKBP51 ou FKBP52, offre un potentiel thérapeutique prometteur pour les maladies connexes.
Unessai amplifié Luminescent Proximity Homogenous A(AlphaScreen) a été développé pour la première fois en 1994 par Ullman EF et al.9. Maintenant, il est largement utilisé pour détecter différents types d’interactions biologiques, telles que lepeptide 10,la protéine11,l’ADN12,l’ARN13et le sucre14. Dans cette technique, il existe deux types de perles (diamètre 200 nm), l’une est la perle donneuse et l’autre est la perle accepteuse. Les biomolécules sont immobilisées sur ces perles; leurs interactions biologiques rapprochent les perles donneuses et accepteuses. À 680 nm, un photosensibilisateur dans la perle du donneur éclaire et convertit l’oxygène en oxygène syté. Parce que l’oxygène syt a une courte durée de vie, il ne peut diffuser que jusqu’à 200 nm. Si la bille accepteur est à proximité, son dérivé de thioxène réagit avec l’oxygène singulet générant une chimiluminescence à 370 nm. Cette énergie active en outre les fluorophores dans la même bille accepteur pour émettre de la lumière à 520-620 nm15. Si les interactions biologiques sont perturbées, la perle accepteur et la perle donneuse ne peuvent pas atteindre la proximité, ce qui entraîne la désintégration de l’oxygène syulet et un faible signal produit.
Nous décrivons ici un protocole utilisant cette technique pour le criblage de petites molécules inhibant les interactions entre Hsp90 et les co-chaperons TPR, en particulier FKBP51 et FKBP52. Les 10 peptides longs d’acides aminés correspondant à Hsp90 extrême C-terminus sont attachés à des billes acceptrices. Les co-chaperons TPR purifiés marqués de la TPS interagissent avec les perles de donneurs liées au glutathion. Lorsque l’interaction entre les peptides dérivés de Hsp90 et les co-chaperons à motif TPR rassemble les billes, un signal amplifié est produit(Figure 1A). Si les petites molécules criblées peuvent inhiber les interactions entre Hsp90 et les co-chaperons à motif TPR, ce signal amplifié sera diminué(Figure 1B). Leur IC50 peut être calculé par mesure quantitative. Ce protocole peut être étendu à toutes les interactions chaperon -TPR-motif co-chaperon d’intérêt et est d’une grande importance dans le développement de nouvelles molécules, bloquant spécifiquement l’interaction entre Hsp90 et FKBP51 ou FKBP52.
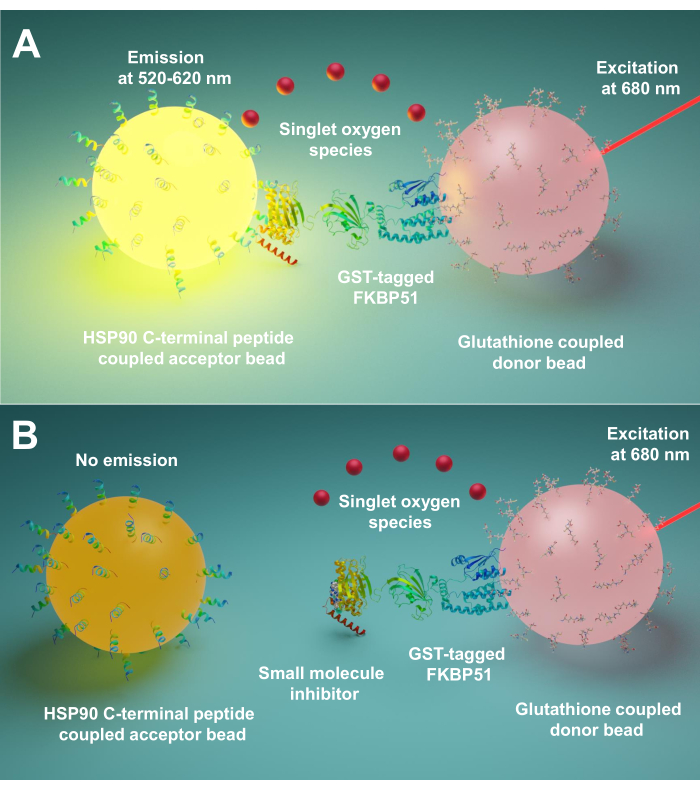
Figure 1: Principe de base de ce test. (A) La GST-FKBP51 purifiée interagit avec les billes de donneur liées au glutathion. Les 10 peptides longs d’acides aminés correspondant à l’extrême C-terminus de Hsp90 sont attachés à des billes acceptrices. L’interaction entre les peptides dérivés de Hsp90 et le domaine TPR de FKBP51 rapproche les perles donneuses et acceptrices. À 680 nm, un photosensibilisateur dans la perle du donneur éclaire et convertit l’oxygène en oxygène syté. Le dérivé de thioxène sur la bille accepteur réagit avec l’oxygène syt et génère une chimiluminescence à 370 nm. Cette énergie active en outre les fluorophores dans la même bille accepteur pour émettre de la lumière à 520-620 nm. (B) Lorsque de petites molécules inhibent les interactions entre Hsp90 et FKBP51, les perles donneuses et acceptatrices ne peuvent pas atteindre la proximité. Ensuite, l’oxygène syt avec une courte durée de vie se désintègre et aucun signal détectable n’est produit. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Nous décrivons ici un protocole utilisant le test pour le criblage de petites molécules inhibant les interactions entre Hsp90 et les co-chaperons à motif TPR, en particulier FKBP51 et FKBP52. Son score Z’ élevé (>0,8) démontre la robustesse et la fiabilité d’un format à haut débit. Les résultats peuvent être obtenus en une heure et de petites quantités de perles, de protéines et de composés sont nécessaires. De plus, ce protocole pourrait facilement être étendu à toutes les interactions de co-chaperon…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Cette étude a été soutenue par des subventions du Conseil suédois de la recherche (2018-02843), de la Brain Foundation (Fo 2019-0140), de la Foundation for Geriatric Diseases du Karolinska Institutet, de la Gunvor and Josef Anérs Foundation, de la Magnus Bergvalls Foundation, de la Gun and Bertil Stohnes Foundation, de la Tore Nilssons Foundation for medical research, de la Margaretha af Ugglas Foundation et de la Foundation for Old Servants.
Materials
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
References
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer’s disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).

