Studier av förkläde-cokaperoninteraktioner med homogen pärlbaserad analys
Summary
Detta protokoll presenterar en teknik för sondering protein-protein interaktioner med glutation-kopplade donator pärlor med GST-smälta TPR-motiv co-chaperones och acceptor pärlor i kombination med en Hsp90-härledda peptid. Vi har använt denna teknik för att screena små molekyler för att störa Hsp90-FKBP51 eller Hsp90-FKBP52 interaktioner och identifierat potenta och selektiva Hsp90-FKBP51 interaktionshämmare.
Abstract
Inriktning på värmechockprotein 90 (Hsp90)-cochaperone interaktioner ger möjlighet att specifikt reglera Hsp90-beroende intracellulära processer. Den bevarade MEEVD pentapeptiden vid C-ändstationen i Hsp90 är ansvarig för interaktionen med tetratricopeptidrepetitionsmotivet (TPR) av co-chaperones. FK506-bindande protein (FKBP) 51 och FKBP52 är två liknande TPR-motiv co-chaperones inblandade i steroidhormon-beroende sjukdomar med olika funktioner. Att identifiera molekyler som specifikt blockerar interaktioner mellan Hsp90 och FKBP51 eller FKBP52 ger därför en lovande terapeutisk potential för flera mänskliga sjukdomar. Här beskriver vi protokollet för en förstärkt luminescent närhet homogen analys för sond interaktioner mellan Hsp90 och dess partner co-chaperones FKBP51 och FKBP52. För det första har vi renat TPR-motivinnehållande proteiner FKBP51 och FKBP52 i glutation S-transferase (GST)-märkt form. Med hjälp av glutation-kopplade donatorpärlor med GST-smälta TPR-motiv proteiner och acceptor pärlor i kombination med en 10-mer C-terminal peptid av Hsp90, har vi sonderat protein-protein interaktioner i en homogen miljö. Vi har använt denna analys för att screena små molekyler för att störa Hsp90-FKBP51 eller Hsp90-FKBP52 interaktioner och identifierat potenta och selektiva Hsp90-FKBP51 interaktionshämmare.
Introduction
Molekylära förkläde bidrar till proteinhomeostas, inklusive proteinveckning, transport och nedbrytning. De reglerar flera cellulära processer och är kopplade till många sjukdomar som cancer och neurodegenerativa sjukdomar1. Värmechockprotein 90 (Hsp90) är ett av de viktigaste förklädena vars funktion är beroende av konformationsförändringar som drivs av ATP-hydrolys och bindning med klientproteiner medierade av dess co-chaperones2. Trots en uppenbar potential hos Hsp90 som terapeutiskt mål, finjusterar dess funktion representerar en stor utmaning. Det finns flera Hsp90-hämmare riktade mot N-terminal ATP-bindningsregionen, som har utvärderats i kliniska prövningar, men ingen av dem har godkänts för marknadsföring3. På grund av bristen på en väldefinierad ligand-bindandeficka 4, inriktning på C-terminal regionen Hsp90 har haft begränsad framgång4. Nyligen har störningar av Hsp90-cochaperone interaktioner av små molekyler undersökts som en alternativ strategi5. Att rikta in sig på Hsp90-cochaperone interaktioner skulle inte framkalla allmänna cell stress svar och ger möjlighet att specifikt reglera olika intracellulära processer. Den bevarade MEEVD pentapeptiden vid C-ändstationen i Hsp90 är ansvarig för interaktionen med tetratricopeptidrepetitionsmotivet (TPR) av co-chaperones6. Av de 736 TPR-motivinnehållande proteinerna som kommenteras i den mänskliga proteindatabasen interagerar ~ 20 olika proteiner med Hsp90 via denna peptid7. Molekyler som konkurrerar om MEEVD-peptidbindning skulle störa interaktionerna mellan Hsp90 och co-chaperones som innehåller en TPR-domän. Peptidbindningsstället har liknande tertiär struktur men den övergripande homologin mellan olika TPR-motivdomäner är relativtlåg 7, vilket ger en möjlighet att identifiera molekyler som specifikt kan blockera interaktioner mellan Hsp90 och vissa TPR-motiv co-chaperones. Bland dessa TPR-motiv co-chaperones, FK506-bindande protein (FKBP) 51 och FKBP52 är regulatorer av steroidhormon receptorn (SHR) signalering och inblandade i flera steroidhormon-beroende sjukdomar inklusive cancer, stressrelaterade sjukdomar, metabola sjukdomar, och Alzheimers sjukdom8. Även om FKBP51 och FKBP52 delar > 80% sekvenslikhet, skiljer sig deras funktioner: FKBP52 är en positiv regulator för SHR-aktivitet, medan FKBP51 i de flesta fall är en negativ regulator8. Att identifiera molekyler, som specifikt blockerar interaktioner mellan Hsp90 och FKBP51 eller FKBP52, ger därför en lovande terapeutisk potential för relaterade sjukdomar.
Enmplified Luminescent Proximity Homogen Assay (AlphaScreen) utvecklades först 1994 av Ullman EF et al.9. Nu används det ofta för att upptäcka olika typer av biologiska interaktioner, såsom peptid10, protein11,DNA12,RNA13, och socker14. I denna teknik finns det två typer av pärlor (diameter 200 nm), en är donatorplädren och den andra är acceptorpläd. Biomolekylerna är immobiliserade på dessa pärlor; deras biologiska interaktioner för donator- och acceptorpärlor i närheten. Vid 680 nm lyser en ljuskänslig i donatorpärlan upp och omvandlar syre till singlet syre. Eftersom singlet syre har en kort livslängd, det kan bara diffusa upp till 200 nm. Om acceptorpärlan är i närheten reagerar dess tiooxenderivat med singlet syre som genererar chemiluminescens vid 370 nm. Denna energi aktiverar ytterligare fluorforer i samma acceptorpläde för att avge ljus vid 520-620 nm15. Om de biologiska interaktionerna störs kan acceptorpläd och donatorplädla inte nå närheten, vilket resulterar i singlet syreförfall och lågproducerad signal.
Här beskriver vi ett protokoll med denna teknik för screening av små molekyler som hämmar interaktioner mellan Hsp90 och TPR co-chaperones, särskilt FKBP51 och FKBP52. De 10 aminosyra långa peptiderna som motsvarar Hsp90 extrema C-ändstation är fästa vid acceptorpärlor. Renade GST-märkta TPR-co-chaperones interagerar med glutation-länkade donatorpärlor. När interaktionen mellan Hsp90-härledda peptider och TPR-motiv co-chaperones för samman pärlor, produceras en förstärkt signal (Figur 1A). Om de screenade små molekylerna kan hämma interaktionerna mellan Hsp90- och TPR-motivsamförkläde, kommer denna förstärkta signal att minskas (figur 1B). Deras IC50 kan beräknas genom kvantitativ mätning. Detta protokoll kan utvidgas till alla förkläde – TPR-motiv samförkläde interaktioner av intresse och är av stor betydelse i utvecklingen av nya molekyler, specifikt blockerar interaktionen mellan Hsp90 och FKBP51 eller FKBP52.
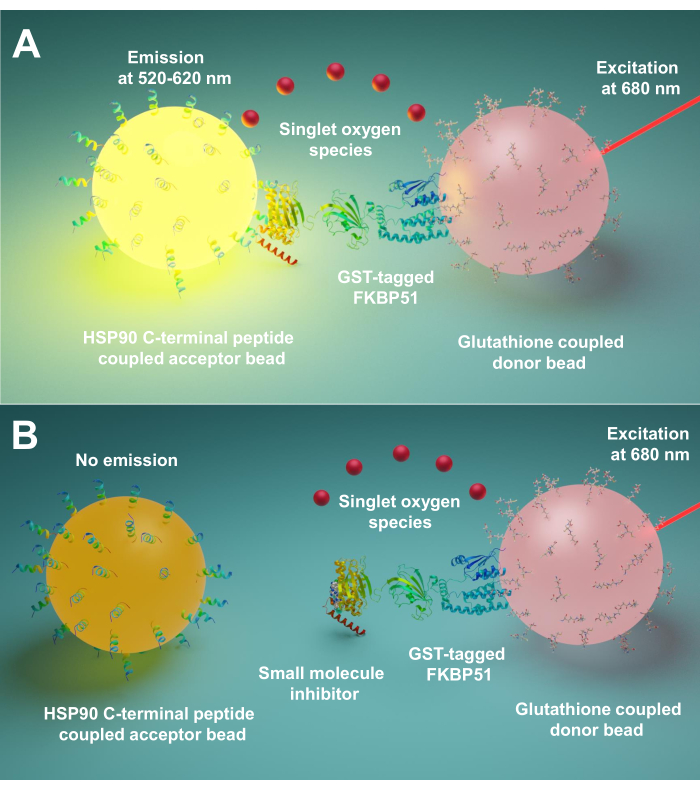
Figur 1: Den grundläggande principen i dennaanalys. (A) Renad GST-FKBP51 interagerar med glutation-kopplade donatorpärlor. De 10 aminosyra långa peptiderna som motsvarar den extrema C-ändstationen av Hsp90 är fästa vid acceptorpärlor. Interaktionen mellan Hsp90-härledda peptider och TPR-domänen i FKBP51 för donatorn och acceptorpärlor i närheten. Vid 680 nm lyser en ljuskänslig i donatorpärlan upp och omvandlar syre till singlet syre. Tiooxenderivatet på acceptorpärlan reagerar med singlet syre och genererar chemiluminescens vid 370 nm. Denna energi aktiverar ytterligare fluorforer i samma acceptorpläde för att avge ljus vid 520-620 nm. B)När små molekyler hämmar samspelet mellan Hsp90 och FKBP51 kan donatorn och acceptorpärlorna inte nå närheten. Sedan sönderfaller singlet syret med kort livslängd, och ingen detekterbar signal produceras. Klicka här om du vill visa en större version av den här figuren.
Protocol
Representative Results
Discussion
Här beskriver vi ett protokoll med hjälp av analysen för screening av små molekyler som hämmar interaktioner mellan Hsp90 och TPR-motiv co-chaperones, särskilt FKBP51 och FKBP52. Dess höga Z- poäng (>0,8) visar robustheten och tillförlitligheten för ett höggenomströmningsformat. Resultat kan erhållas inom en timme, och små mängder pärlor, protein och föreningar krävs. Dessutom kan detta protokoll enkelt utvidgas till alla Hsp90/Hsp70 – TPR-motiv samförkläde interaktioner av intresse. Flera TPR-motiv c…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Studien fick stöd av anslag från Vetenskapsrådet (2018-02843), Hjärnfonden (Fo 2019-0140), Stiftelsen för geriatriska sjukdomar vid Karolinska Institutet, Gunvor och Josef Anérs Stiftelse, Magnus Bergvalls Stiftelse, Gun och Bertil Stohnes Stiftelse, Tore Nilssons Stiftelse för medicinsk forskning, Margaretha af Ugglas stiftelse och Stiftelsen för gamla tjänstemän.
Materials
| 384-well plates | Perkin Elmer | 6008350 | Assay volume 25 ml |
| Amicon 10.000 MWCO centrifugation unit | Millipore | UFC901008 | Concentrate protein |
| Ampicillin | Sigma | A0166 | Antibiotics |
| Bacteria shaker Unimax 1010 | Heidolph | Culture bacteria | |
| cDNA clones for human FKBP51 | Source BioScience | clone id: 5723416 | pCMV-SPORT6 vector |
| cDNA clones for human FKBP52 | Source BioScience | clone id: 7474554 | pCMV-SPORT6 vector |
| Chemically Competent E. coli | Invitrogen | C602003 | One Shot BL21 Star (DE3) |
| Data analysis software | GraphPad Prism | 9.0.0 | Analysis data and make figures |
| Data analysis software | Excel | Analysis data | |
| DMSO | Supelco | 1.02952.1000 | Dilute compounds |
| DPBS | Gibco | 14190-144 | Prepare solution |
| EDTA | Calbiochem | 344504 | Prevent proteolysis during sonication |
| Glutathione | Sigma | G-4251 | Elute GST-tagged proteins |
| Glutathione donor beads | Perkin Elmer | 6765300 | Donor bead |
| GST-trap column | Cytiva (GE Healthcare) | 17528201 | Purify GST-tagged proteins |
| Isopropyl-β-D-thiogalactoside | Thermo Fisher Scientific | R0392 | Induce protein expression |
| LB Broth (Miller) | Sigma | L3522 | Microbial growth medium |
| PCR instrument | BIO-RAD | S1000 Thermal Cycler | Amplification/PCR |
| PD-10 column | Cytiva (GE Healthcare) | 17085101 | Solution exchange |
| pGEX-6P-1 vector | Cytiva (GE Healthcare) | 28954648 | Plasmid |
| pGEX-6P-2 vector | Cytiva (GE Healthcare) | 28954650 | Plasmid |
| Plate reader | Perkin Elmer | EnSpire 2300 Multilabel Reader | Read alpha plate |
| Plate reader software | Perkin Elmer | EnSpire Manager | Plate reader software |
| Plate reader software protocol | Perkin Elmer | Alpha 384-well Low volume | Use this protocol to read plate |
| PMSF | Sigma | P7626 | Prevent proteolysis during sonication |
| protease inhibitor cocktail | Sigma | S8830 | Prevent proteolysis during sonication |
| Sodium azide | Sigma | S2002 | As a preservative |
| Sodium cyanoborohydride (NaBH3CN) | Sigma | 156159 | Activates matrix for coupling |
| Ten amino acid peptide NH2-EDASRMEEVD-COOH corresponding to amino acids 714-724 of human Hsp90 beta isoform | Peptide 2.0 inc | Synthesize Hsp90 C-terminal peptide | |
| Test-Tube Rotator | LABINCO | Make end-over-end agitation | |
| Tris-HCl | Sigma | 10708976001 | Block unreacted sites of acceptor beads |
| Tween-20 | Sigma | P1379 | Prevent beads aggregation |
| Ultra centrifuge Avanti J-20 XP | Beckman Coulter | Centrifuge to get bacteria cell pellets | |
| Ultrasonic cell disruptor | Microson | Sonicate cells to release protein | |
| Unconjugated acceptor beads | Perkin Elmer | 6762003 | Acceptor beads |
| XCell SureLock Mini-Cell and XCell II Blot Module | Invitrogen | EI0002 | SDS-PAGE |
References
- Muchowski, P. J., Wacker, J. L. Modulation of neurodegeneration by molecular chaperones. Nature Reviews Neuroscience. 6 (1), 11-22 (2005).
- Eckl, J. M., Richter, K. Functions of the Hsp90 chaperone system: lifting client proteins to new heights. International Journal of Biochemistry and Molecular Biology. 4 (4), 157-165 (2013).
- Yuno, A. Clinical evaluation and biomarker profiling of Hsp90 inhibitors. Methods in Molecular Biology. 1709, 426-441 (2018).
- Dutta Gupta, S., Bommaka, M. K., Banerjee, A. Inhibiting protein-protein interactions of Hsp90 as a novel approach for targeting cancer. European Journal of Medicinal Chemistry. 178, 48-63 (2019).
- Pavlov, P. F., Hutter-Paier, B., Havas, D., Windisch, M., Winblad, B. Development of GMP-1 a molecular chaperone network modulator protecting mitochondrial function and its assessment in fly and mice models of Alzheimer’s disease. Journal of Cellular and Molecular Medicine. 22 (7), 3464-3474 (2018).
- Young, J. C., Obermann, W. M., Hartl, F. U. Specific binding of tetratricopeptide repeat proteins to the C-terminal 12-kDa domain of hsp90. Journal of Biological Chemistry. 273 (29), 18007-18010 (1998).
- Scheufler, C., et al. Structure of TPR domain-peptide complexes: critical elements in the assembly of the Hsp70-Hsp90 multichaperone machine. Cell. 101 (2), 199-210 (2000).
- Storer, C. L., Dickey, C. A., Galigniana, M. D., Rein, T., Cox, M. B. FKBP51 and FKBP52 in signaling and disease. Trends in Endocrinology & Metabolism. 22 (12), 481-490 (2011).
- Ullman, E. F., et al. Luminescent oxygen channeling immunoassay: measurement of particle binding kinetics by chemiluminescence. Proceedings of the National Academy of Sciences of the United States of America. 91 (12), 5426-5430 (1994).
- Wigle, T. J., et al. Screening for inhibitors of low-affinity epigenetic peptide-protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. Journal of Biomolecular Screening. 15 (1), 62-71 (2010).
- Guenat, S., et al. Homogeneous and nonradioactive high-throughput screening platform for the characterization of kinase inhibitors in cell lysates. Journal of Biomolecular Screening. 11 (8), 1015-1026 (2006).
- Sabatucci, A., et al. A new methodological approach for in vitro determination of the role of DNA methylation on transcription factor binding using AlphaScreen(R) analysis: Focus on CREB1 binding at hBDNF promoter IV. Journal of Neuroscience Methods. 341, 108720 (2020).
- Mills, N. L., Shelat, A. A., Guy, R. K. Assay Optimization and Screening of RNA-Protein Interactions by AlphaScreen. Journal of Biomolecular Screening. 12 (7), 946-955 (2007).
- Huang, X., et al. A competitive alphascreen assay for detection of hyaluronan. Glycobiology. 28 (3), 137-147 (2018).
- Principles of alphascreen amplified luinescent proximmity homogenous assay. PerkinElmer Life Sciences Available from: https://www.perkinelmer.com/lab-solutions/resources/docs/APP_AlphaScreen_Principles.pdf (2021)
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).

