호스트-미생물군유병 상호 분석을 위한 장 내 장관 장기 배양 시스템
Summary
이 문서는 전 생체 내 실험을 위한 새로운 창자 기관 배양 시스템을 사용하여 호스트-미생물군유전체 상호 작용을 분석하기 위한 독특한 방법을 제시합니다.
Abstract
창 자 조직의 구조 호스트와 창 자 microbiota 사이 밀접 하 고 상호 상호 상호 작용을 촉진. 이러한 교차 회담은 지역적이고 체계적인 항상성을 유지하는 데 매우 중요합니다. 창자 microbiota 조성에 변경 (dysbiosis) 인간의 질병의 넓은 배열과 연결. 숙주-미생물군유동성 상호작용을 해부하는 방법은 생리조직 구조(생체내 동물 모델에서 사용할 때)와 실험 인자에 대한 제어 수준(간단한 체외 세포 배양 시스템에서와 같이)의 보존 중 내재된 절충을 포함한다. 이 절충을 해결하기 위해 Yissachar 외는 최근에 장 기관 배양 시스템을 개발했습니다. 이 시스템은 순진한 결장 조직 구조 및 세포 메커니즘을 보존하고 또한 엄격한 실험 제어를 허용, 쉽게 생체 내에서수행 할 수없는 실험을 촉진. 발광 성 변류 (혐기성 또는 호기성 미생물, 쥐 또는 인간, 약물 및 대사 산물의 전체 미생물 샘플 포함)에 다양한 창자 구성 요소 (예 : 상피, 면역 학적 및 뉴런 요소)의 단기 반응을 해부하는 것이 최적입니다. 여기에서는 맞춤형 창자 배양 장치를 사용하여 여러 장 조각의 장기 문화에 최적화된 프로토콜에 대한 자세한 설명을 제공합니다. 발광 성 변투에 대한 숙주 반응은 조직 섹션 또는 전산 조직 단편의 면역 형광 염색, 처투 내 혼성화 (FISH) 또는 시간 경과 이미징에 의해 시각화 될 수 있습니다. 이 시스템은 차세대 시퀀싱, 유동 세포측정, 다양한 세포 및 생화학 적 분석을 포함한 광범위한 판독을 지원합니다. 전반적으로, 이 3차원 기관 배양 시스템은 크고 온전한 장 조직의 배양을 지원하고 현지 창자 환경에서 숙주 미생물 작용의 고해상도 분석 및 시각화를 위한 광범위한 응용을 가지고 있습니다.
Introduction
소장은 세포가 상호 작용하고 발광 함량 (microbiota, 음식 등)과 상호 작용하고 통신 할 수있는 특정 구조로 조직 된 광범위한 세포 유형 (상피 세포, 면역 계통 세포, 뉴런 등을 포함하는 매우 복잡한 기관)입니다. 1. 현재, 숙주 -microbiota 상호 작용을 분석할 수 있는 연구 툴박스에는 체외 세포 배양 및 생체 내 동물 모델2를포함한다. 생체 내 동물 모델은 생리조직 구조3을 제공하지만 실험 조절이 불량하고 실험 조건을 조작할 수 있는 능력이 제한적이다. 시험관 내 배양 시스템은, 다른 한편으로는, 미생물4로 보충될 수 있는 1차 세포 또는 세포주를 사용하여실험파라미터를 단단히 통제하지만 세포 복잡성 및 조직 아키텍처가 결여된다. 현대 체외 학적 제는 마우스 또는 인간소스에서파생 된 상피 오르가노이드와 같은 건강하고 병리학적인 인간 조직 샘플의 고급 사용을허용5,6,점막 미세 환경을 모방 샘플7. 또 다른 예는 인간 대장 상피 세포주 (Caco2), 세포외 매트릭스 및 미세 유체 채널을 포함하는 ‘칩에 내장’분석8. 그러나, 시험관 내 샘플처럼 고급적이고 혁신적인 바와 같이, 그들은 정상적인 조직 아키텍처 또는 순진한 세포 조성을 유지하지 않습니다.
이를 해결하기 위해 Yissachar 외는 최근 생체 내 및 체외 모델 모두의 장점을 활용하여 온전한 장 부각 을유지하는 전 생체 오르간 배양 시스템9(그림 1)을 개발했다. 이 전 생체 내 창자 장기 배양 시스템은 6개의 결장 조직의 멀티플렉스 배양을 지원하는 맞춤형 배양 장치를 기반으로 하며, 시스템의 입력 및 출력을 제어하면서 유사한 조건에서 실험 입력을 검토할 수 있도록 합니다. 최근 연구는 이 시스템이 개별 장내 세균9,전체 인간 미생물대사산물 10 및 미생물 대사산물(11)에 대한장 내 반응을 분석하는 데 유용하다는 것을 입증하였다. 이 시스템은 처음으로 숙주, 미생물 및 환경 구성 요소에 대한 높은 수준의 제어와 이러한 초기 숙주 – 미생물 상호 작용의 연구를 할 수 있습니다. 또한 실험 전반에 걸쳐 실시간으로 시스템을 모니터링하고 조작할 수 있습니다.
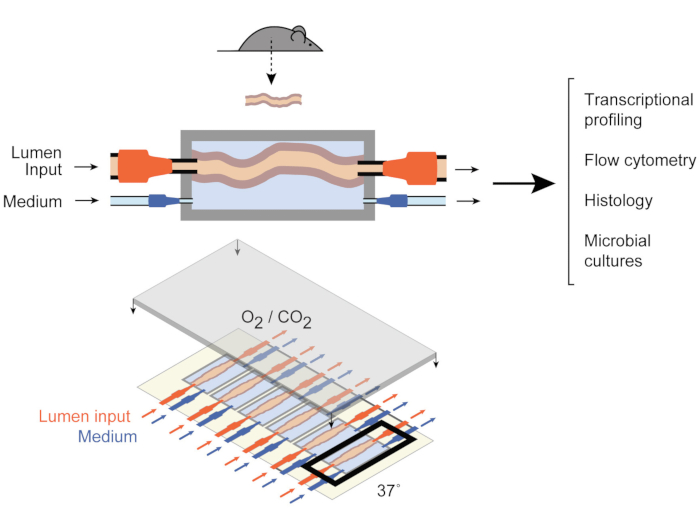
그림 1: 창자 배양 장치의 회로도. 전체 장 조직 단편은 챔버(top)의 출력 및 입력 포트에 부착되며, 펌프는 루멘 내부와 외부 중간 챔버에서 중간 흐름을 조절한다. 전체 장치(아래쪽)에는 6개의 챔버가 포함되어 있습니다. 이 수치는 Yissachar 외 2017에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
이 문서는 Yissachar 등최근 개발 한 ex vivo 창자 장기 문화에 대한 최적화 된 프로토콜을 설명합니다 (게시된 9 및 게시되지 않은 데이터). 창자 기관 배양 시스템은 발광 흐름을 유지하면서 온전한 장 조각의 멀티플렉스 배양을 지원합니다. 그것은 내- 및 초광도 환경 (자극 복용량, 노출 시간 및 유량을 포함)에 대한 완전한 제어를 제공하고 순진한 장 조직 구조와 세포 복잡?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
우리는 창자 기관 문화 시스템 프로토콜을 최적화에 그들의 귀중 한 기여에 대 한 Yissachar 실험실의 과거와 현재 회원 감사. 원고의 비판적 편집에 대한 야엘 로어에게 감사드립니다. 이 작품은 이스라엘 과학 재단 (3114831 보조금 없음), 이스라엘 과학 재단 – 브로드 연구소 공동 프로그램 (8165162 보조금) 및 의료 연구를위한 가스너 기금, 이스라엘에 의해 지원되었다.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
References
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

