التصوير والتحليل الآليان لتحديد كمية الماكروبينوسومات الموسومة بالفلورسنت
Summary
تعد المقايسات الآلية باستخدام الصفائح الدقيقة متعددة الآبار طرقا مفيدة لتحديد منظمي المسارات من خلال السماح بتقييم العديد من الظروف في تجربة واحدة. هنا ، قمنا بتكييف بروتوكول التصوير والقياس الكمي الراسخ في macropinosome إلى تنسيق microplate 96-well وتوفير مخطط شامل للأتمتة باستخدام قارئ لوحات متعدد الأوضاع.
Abstract
Macropinocytosis هو مسار امتصاص غير محدد في مرحلة السوائل يسمح للخلايا باستيعاب شحنات كبيرة خارج الخلية ، مثل البروتينات ومسببات الأمراض وحطام الخلايا ، من خلال داء الخلايا الداخلية بالجملة. يلعب هذا المسار دورا أساسيا في مجموعة متنوعة من العمليات الخلوية ، بما في ذلك تنظيم الاستجابات المناعية واستقلاب الخلايا السرطانية. وبالنظر إلى هذه الأهمية في الوظيفة البيولوجية، فإن فحص ظروف زراعة الخلايا يمكن أن يوفر معلومات قيمة من خلال تحديد المنظمين لهذا المسار وتحسين الظروف لاستخدامها في اكتشاف أساليب علاجية جديدة. تصف الدراسة تقنية تصوير وتحليل آلي باستخدام معدات مختبرية قياسية وقارئ لوحات متعدد الأوضاع لتصوير الخلايا من أجل القياس الكمي السريع لمؤشر الخلايا الكبيرة في الخلايا الملتصقة. تعتمد الطريقة الآلية على امتصاص ديكستران الفلورسنت عالي الوزن الجزيئي ويمكن تطبيقها على 96 لوحة دقيقة لتسهيل تقييمات الظروف المتعددة في تجربة واحدة أو عينات ثابتة مثبتة على أغطية زجاجية. ويهدف هذا النهج إلى زيادة قابلية التكرار إلى أقصى حد والحد من التباين التجريبي مع توفير الوقت والفعالية من حيث التكلفة.
Introduction
يسمح المسار الداخلي غير المحدد لندرة الخلايا الكبيرة للخلايا باستيعاب مجموعة متنوعة من المكونات خارج الخلية، بما في ذلك العناصر الغذائية والبروتينات والمستضدات ومسببات الأمراض، من خلال الامتصاص الأكبر للسوائل خارج الخلية ومكوناتها1. على الرغم من أهميته لبيولوجيا العديد من أنواع الخلايا، إلا أنه يوصف بشكل متزايد مسار زيادة عدد الخلايا الكبيرة بأنه يلعب دورا أساسيا في بيولوجيا الورم، حيث، من خلال امتصاص الخلايا السرطانية الكبيرة، تكون قادرة على البقاء والتكاثر في وجود بيئة دقيقة مستنفدة للمغذيات2،3. يوفر امتصاص الجزيئات الكبيرة خارج الخلية ، بما في ذلك الألبومين والمصفوفة خارج الخلية ، وحطام الخلايا الميتة ، مصدرا غذائيا بديلا لإنتاج الكتلة الحيوية عن طريق إنشاء الأحماض الأمينية والسكريات والدهون والنيوكليوتيدات من خلال هدم البضائع بوساطة اندماج الماكروبينوسوم والليزوسوم 4،5،6،7،8.
تحريض وتنظيم كثرة الخلايا الكبيرة معقدة ويمكن أن تختلف اعتمادا على السياق الخلوي. حتى الآن ، تم تحديد العديد من محفزات زيادة عدد الخلايا الكبيرة وتشمل الأربطة ، مثل عامل نمو البشرة (EGF) ، وعامل النمو المشتق من الصفائح الدموية (PDGF) ، و galectin-3 ، و Wnt3A9,10,11,12,13. بالإضافة إلى ذلك ، يمكن أن تؤدي ظروف الزراعة التي تحاكي البيئة الدقيقة للورم إلى تنشيط المسار. الأورام الغدية في القنوات البنكرياسية (PDAC) محرومة من المغذيات ، خاصة بالنسبة للغلوتامين الحمضي الأميني ، الذي يتسبب في اعتماد كل من الخلايا السرطانية والخلايا الليفية المرتبطة بالسرطان (CAFs) على زيادة ندرة الخلايا الكبيرة للبقاء على قيد الحياة7،13،14،15. علاوة على ذلك، يمكن لضغوط الورم، مثل نقص الأكسجة والإجهاد التأكسدي، تنشيط مسار الكسح هذا16. بالإضافة إلى العديد من المؤثرين الخارجيين الذين يمكنهم تحفيز زيادة عدد الخلايا الكبيرة ، تتحكم مجموعة متنوعة من المسارات داخل الخلايا في تكوين macropinosome. التحول بوساطة راس الورمي يكفي لبدء آلية الخلايا الكبيرة ، وتظهر أنواع متعددة من السرطان زيادة الخلايا الكبيرة التأسيسية التي يحركها راس الورمي 4،5،9،17. بدلا من ذلك ، تم تحديد تنشيط Ras من النوع البري والمسارات المستقلة عن Ras لتنشيط macropinocytosis في الخلايا السرطانية و CAFs10،11،15،18. أدى استخدام نماذج مختلفة في المختبر بالاشتراك مع العلاجات المثبطة إلى تحديد العديد من معدلات ندرة الخلايا الكبيرة ، والتي تشمل مبادلات الصوديوم والهيدروجين ، و GTPase Rac1 الصغير ، و phosphoinositide 3-kinase (PI3K) ، و kinase المنشط p21 (Pak) ، و AMP-activated protein kinase (AMPK) 4,13,15 . ومع ذلك ، بالنظر إلى العديد من العوامل والظروف الموصوفة التي تنظم ندرة الخلايا الكبيرة ، فمن المتصور أن العديد من المعدلات والمحفزات الأخرى لا تزال غير مكتشفة. يمكن تسهيل تحديد المعدلات والمحفزات الجديدة من خلال التقييم الآلي للعديد من الحالات في تجربة واحدة. يمكن لهذه المنهجية أن تلقي الضوء على العوامل التي ينطوي عليها تكوين الماكروبينوسوم وقد تسمح باكتشاف جزيئات صغيرة جديدة أو بيولوجية تستهدف هذا المسار.
هنا ، قمنا بتكييف بروتوكولنا الذي تم إنشاؤه مسبقا لتحديد مدى ندرة الخلايا السرطانية في الخلايا السرطانية في المختبر إلى تنسيق microplate 96-well والتصوير الآلي وتحديد الكم19,20. يعتمد هذا البروتوكول على الفحص المجهري الفلوري ، والذي أصبح معيارا في هذا المجال لتحديد ندرة الخلايا الكبيرة في المختبر وفي الجسم الحي 4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. يمكن تمييز Macropinosomes عن مسارات الخلايا الداخلية الأخرى من خلال قدرتها على استيعاب الجزيئات الكبيرة الكبيرة ، مثل dextran عالي الوزن الجزيئي (أي 70 kDa) 2,3,4,20,21,22,23. وبالتالي ، يمكن تعريف macropinosomes من خلال امتصاص الفلوروفور خارج الخلية المسمى 70 kDa dextran. ونتيجة لذلك ، تظهر الحويصلات ذات الخلايا الكبيرة على شكل مجموعات داخل الخلايا من البقع الفلورية بأحجام تتراوح بين 0.2-5 ميكرومتر. يمكن تصوير هذه الثقوب مجهريا وتحديدها كميا لاحقا لتحديد مدى ندرة الخلايا الكبيرة في الخلية – “مؤشر الخلايا الكبيرة”.
في هذا البروتوكول ، يتم وصف الخطوات الأساسية لتصور الماكروبينوسومات في الخلايا الملتصقة في المختبر على صفيحة دقيقة من 96 بئرا وأغطية باستخدام معدات المختبرات القياسية (الشكل 1). بالإضافة إلى ذلك ، يتم توفير التوجيهات لأتمتة الحصول على الصور وتحديد كميتها لمؤشر macropinocytic باستخدام قارئ لوحة متعدد الأوضاع لتصوير الخلايا. تقلل هذه الأتمتة من الوقت والتكلفة والجهد مقارنة ببروتوكولاتنا الموصوفة سابقا19,20. بالإضافة إلى ذلك ، فإنه يتجنب الحصول على التصوير وتحليله بشكل غير مقصود ، وبالتالي يعزز قابلية التكرار والموثوقية. يمكن بسهولة تكييف هذه الطريقة مع أنواع الخلايا المختلفة أو قارئات الألواح أو استخدامها لتحديد ميزات macropinosome البديلة ، مثل الحجم والعدد والموقع. الطريقة الموصوفة هنا مناسبة بشكل خاص لفحص ظروف زراعة الخلايا التي تحفز ندرة الخلايا الكبيرة ، أو تحديد المعدلات الجديدة ، أو تحسين تركيزات الأدوية للمثبطات المعروفة.
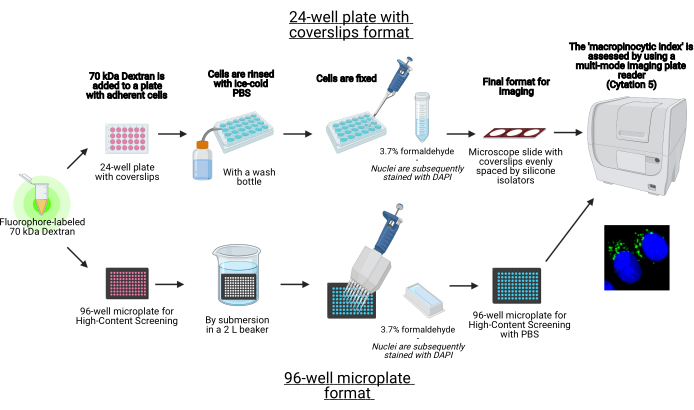
الشكل 1: مخطط للفحص الآلي لتحديد “مؤشر الخلايا الكبيرة” في الخلايا الملتصقة. تم إنشاؤه باستخدام BioRender. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
تعتمد جودة التجارب والحصول على البيانات بشكل كبير على جودة الكواشف ، وتحسين الإعدادات ، ونظافة الأغطية والألواح الدقيقة. وينبغي أن تعطي النتائج النهائية الحد الأدنى من التباين بين النسخ المتماثلة؛ ومع ذلك ، فإن الاختلافات البيولوجية تحدث بشكل طبيعي أو قد تكون ناجمة عن عدد من العوامل. قد ?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من خلال منح NIH / NCI (R01CA207189 ، R21CA243701) إلى C.C. KMO.G. حاصل على جائزة زمالة ما بعد الدكتوراه TRDRP (T30FT0952). BioTek Cytation 5 هو جزء من Sanford Burnham Prebys Cell Imaging Core ، الذي يتلقى دعما ماليا من منحة دعم مركز NCI للسرطان (P30 CA030199). تم إنشاء الأشكال 1-3 باستخدام BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Recherche en cancérologie. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Recherche en cancérologie. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

