用于荧光标记大促卵体定量的自动成像和分析
Summary
使用多孔微孔板的自动测定是识别通路调节剂的有利方法,因为它允许在单个实验中评估多种条件。在这里,我们将完善的巨噬菌体成像和定量方案改编为96孔微孔板格式,并为使用多模读板仪的自动化提供了全面的概述。
Abstract
大吞细胞增多症是一种非特异性液相摄取途径,允许细胞通过大量内吞作用内吞化大细胞外货物,如蛋白质、病原体和细胞碎片。该途径在各种细胞过程中起着至关重要的作用,包括免疫反应和癌细胞代谢的调节。鉴于这种在生物学功能中的重要性,检查细胞培养条件可以通过识别该途径的调节因子并优化用于发现新治疗方法的条件来提供有价值的信息。该研究描述了一种使用标准实验室设备和细胞成像多模读板仪的自动成像和分析技术,用于快速定量贴壁细胞中的大旋囊细胞指数。该自动化方法基于高分子量荧光葡聚糖的摄取,可应用于96孔微孔板,以方便评估一个实验中的多种条件或安装在玻璃盖玻片上的固定样品。这种方法旨在最大限度地提高可重复性并减少实验变异,同时节省时间和成本效益。
Introduction
巨噬细胞增多症的非特异性内吞途径允许细胞通过大量摄取细胞外液及其成分来内化各种细胞外成分,包括营养素、蛋白质、抗原和病原体1。虽然对许多细胞类型的生物学很重要,但越来越多地描述了巨细胞增多途径在肿瘤生物学中起着至关重要的作用,其中通过大囊泡摄取,肿瘤细胞能够在营养耗尽的微环境中存活和增殖2,3。细胞外大分子(包括白蛋白和细胞外基质)以及坏死细胞碎片的摄取,通过大卵子体和溶酶体融合介导的货物分解代谢产生氨基酸、糖、脂质和核苷酸,为生物质生产提供了替代营养来源4,5,6,7,8。
巨噬细胞增多症的诱导和调节是复杂的,并且可能因细胞环境而异。到目前为止,已经确定了几种大吞细胞增多症的诱导剂,包括配体,例如表皮生长因子(EGF),血小板衍生生长因子(PDGF),半乳糖凝集素-3和Wnt3A9,10,11,12,13。此外,模拟肿瘤微环境的培养条件可以触发该途径的激活。胰腺导管腺癌(PDAC)肿瘤营养不足,特别是对于氨基酸谷氨酰胺,它导致癌细胞和癌症相关成纤维细胞(CAFs)依赖巨噬细胞增多症生存7,13,14,15。此外,缺氧和氧化应激等肿瘤应激可以激活这种清除途径16。除了可以诱导巨噬细胞增多症的众多外在影响因素外,多种细胞内途径控制着巨噬细胞体的形成。致癌性Ras介导的转化足以启动大棘球机制,多种癌症类型表现出致癌Ras驱动的组成性巨噬细胞增多症4,5,9,17。或者,已经鉴定出野生型Ras激活和Ras非依赖性途径可以激活癌细胞和CAFs中的巨肺细胞增多症10,11,15,18。使用各种体外模型与抑制剂治疗相结合,已经鉴定出几种巨噬细胞增多调节剂,包括钠氢交换剂,小GTP酶Rac1,磷酸肌醇3-激酶(PI3K),p21活化激酶(Pak)和AMP活化蛋白激酶(AMPK)4,13,15.然而,鉴于调节巨噬细胞增多症的众多所述因素和条件,可以想象更多的调节剂和刺激仍未被发现。通过在单个实验中自动评估多种条件,可以促进新型调节剂和刺激的鉴定。这种方法可以阐明参与大卵子体形成的因素,并可能允许发现靶向该途径的新型小分子或生物制剂。
在这里,我们将先前建立的用于在体外测定癌细胞中巨噬细胞中巨噬细胞作用程度的方案调整为96孔微孔板格式以及自动成像和定量19,20。该协议基于荧光显微镜,已成为在体外和体内确定巨肺细胞增多症领域的标准4,5,6,7,9,10,11,12,13,15,16,17,18,19,20,21,22。大卵磷脂体可以通过其内化大分子的能力与其他内吞途径区分开来,例如高分子量葡聚糖(即70 kDa)2,3,4,20,21,22,23。因此,可以通过摄取细胞外施用的荧光团标记的70 kDa葡聚糖来定义大卵子体。结果,大脊髓细胞囊泡表现为细胞内荧光点簇,大小范围为0.2-5μm。这些点可以进行显微镜成像并随后进行定量,以确定细胞中巨肺细胞增多的程度 – “大棘球细胞指数”。
在该协议中,描述了使用标准实验室设备在96孔微孔板和盖玻片上 体外 可视化贴壁细胞中巨卵子体的基本步骤 (图1)。此外,还提供了使用细胞成像多模读板仪自动获取图像和定量大旋心核细胞指数的方向。与我们之前描述的协议相比,这种自动化减少了时间、成本和工作量19,20。此外,它避免了无意中偏倚的成像采集和分析,从而提高了再现性和可靠性。该方法可以很容易地适应不同的细胞类型或读板器,或者用于确定替代的大促卵子体特征,如大小,数量和位置。本文描述的方法特别适用于筛选诱导巨噬细胞增多症的细胞培养条件,鉴定新型调节剂,或优化已知抑制剂的药物浓度。
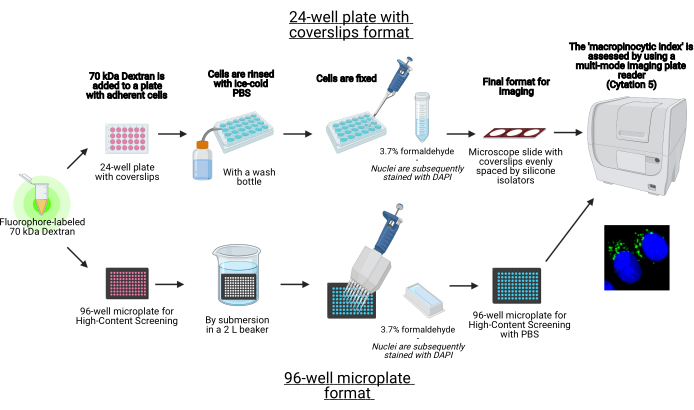
图1:用于确定贴壁细胞中”大脊髓细胞指数”的自动测定示意图。 使用BioRender创建。 请点击此处查看此图的放大版本。
Protocol
Representative Results
Discussion
实验和数据采集的质量在很大程度上取决于试剂的质量、设置的优化以及盖玻片和微孔板的清洁度。最终结果应给出重复之间的最小差异;然而,生物变异确实是自然发生的,或者可能是由许多因素引起的。细胞密度可能导致细胞或多或少地对巨噬细胞增多诱导剂或抑制剂作出反应。因此,遵守协议中建议的80%汇合度至关重要。或者,微孔板制造商有充分的记录,即介质蒸发发生在96孔微孔板上。?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
这项工作得到了NIH / NCI资助(R01CA207189,R21CA243701)的支持,C.C. KMO.G.是TRDRP博士后奖学金(T30FT0952)的获得者。BioTek Cytation 5是Sanford Burnham Prebys Cell Imaging Core的一部分,该核心获得了NCI癌症中心支持补助金(P30 CA030199)的财政支持。图1-3是使用BioRender创建的。
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Recherche en cancérologie. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Recherche en cancérologie. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

