Automatiseret billeddannelse og analyse til kvantificering af fluorescerende mærkede makropinosomer
Summary
Automatiserede assays ved hjælp af mikroplader med flere brønde er fordelagtige tilgange til identifikation af vejregulatorer ved at muliggøre vurdering af en lang række betingelser i et enkelt eksperiment. Her har vi tilpasset den veletablerede makropinosombilleddannelses- og kvantificeringsprotokol til et 96-brønds mikropladeformat og giver en omfattende oversigt over automatisering ved hjælp af en multi-mode pladelæser.
Abstract
Makropinocytose er en ikke-specifik væskefaseoptagelsesvej, der gør det muligt for celler at internalisere stor ekstracellulær last, såsom proteiner, patogener og celleaffald, gennem bulkendocytose. Denne vej spiller en væsentlig rolle i en række cellulære processer, herunder regulering af immunresponser og kræftcellemetabolisme. I betragtning af denne betydning i biologisk funktion kan undersøgelse af cellekulturbetingelser give værdifuld information ved at identificere regulatorer af denne vej og optimere betingelser, der skal anvendes i opdagelsen af nye terapeutiske tilgange. Undersøgelsen beskriver en automatiseret billeddannelses- og analyseteknik ved hjælp af standard laboratorieudstyr og en cellebilleddannelse multi-mode pladelæser til hurtig kvantificering af det makropinocytiske indeks i klæbende celler. Den automatiserede metode er baseret på optagelse af fluorescerende dextran med høj molekylvægt og kan anvendes på mikroplader med 96 brønde for at lette vurderinger af flere forhold i et eksperiment eller faste prøver monteret på glasdæksler. Denne tilgang sigter mod at maksimere reproducerbarheden og reducere eksperimentel variation, samtidig med at den er både tidsbesparende og omkostningseffektiv.
Introduction
Den ikke-specifikke endocytiske vej for makropinocytose gør det muligt for celler at internalisere en række ekstracellulære komponenter, herunder næringsstoffer, proteiner, antigener og patogener, gennem bulkoptagelse af ekstracellulær væske og dets bestanddele1. Selvom det er vigtigt for biologien hos mange celletyper, beskrives makropinocytosevejen i stigende grad at spille en væsentlig rolle i tumorbiologi, hvor tumorceller gennem makropinocytisk optagelse er i stand til at overleve og sprede sig i nærvær af et næringsstofudtømt mikromiljø2,3. Optagelsen af ekstracellulære makromolekyler, herunder albumin og ekstracellulær matrix og nekrotisk celleaffald, giver en alternativ næringskilde til biomasseproduktion ved at skabe aminosyrer, sukkerarter, lipider og nukleotider gennem makropinosom og lysosomfusionsmedieret lastkatabolisme4,5,6,7,8.
Induktion og regulering af makropinocytose er kompleks og kan variere afhængigt af cellulær kontekst. Indtil videre er flere inducere af makropinocytose blevet identificeret og omfatter ligander, såsom epidermal vækstfaktor (EGF), blodpladeafledt vækstfaktor (PDGF), galectin-3 og Wnt3A9,10,11,12,13. Derudover kan dyrkningsbetingelser, der efterligner tumormikromiljøet, udløse aktivering af vejen. Pankreas duktal adenocarcinom (PDAC) tumorer er næringsstofberøvet, især for aminosyren glutamin, hvilket får både kræftceller og kræftassocierede fibroblaster (CAF’er) til at stole på makropinocytose for overlevelse7,13,14,15. Desuden kan tumorspændinger, såsom hypoxi og oxidativ stress, aktivere denne ådselsvej16. Ud over de mange ydre påvirkere, der kan inducere makropinocytose, styrer en række intracellulære veje makropinosomdannelse. Onkogen Ras-medieret transformation er tilstrækkelig til at starte det makropinocytiske maskineri, og flere kræfttyper udviser onkogen Ras-drevet konstitutiv makropinocytose4,5,9,17. Alternativt er vildtype Ras-aktivering og Ras-uafhængige veje blevet identificeret for at aktivere makropinocytose i kræftceller og CAF’er10,11,15,18. Anvendelsen af forskellige in vitro-modeller i kombination med inhibitorbehandlinger har resulteret i identifikation af flere makropinocytosemodulatorer, som omfatter natrium-hydrogenbyttere, den lille GTPase Rac1, phosphoinositid 3-kinase (PI3K), p21-aktiveret kinase (Pak) og AMP-aktiveret proteinkinase (AMPK)4,13,15 . I betragtning af de mange beskrevne faktorer og tilstande, der regulerer makropinocytose, er det imidlertid tænkeligt, at mange flere modulatorer og stimuli forbliver uopdagede. Identifikationen af nye modulatorer og stimuli kan lettes ved automatiseret vurdering af en lang række forhold i et enkelt eksperiment. Denne metode kan kaste lys over de faktorer, der er involveret i makropinosomdannelse og kan muliggøre opdagelsen af nye små molekyler eller biologiske lægemidler, der er målrettet mod denne vej.
Her har vi tilpasset vores tidligere etablerede protokol til bestemmelse af omfanget af makropinocytose i kræftceller in vitro til et 96-brønds mikropladeformat og automatiseret billeddannelse og kvantificering19,20. Denne protokol er baseret på fluorescerende mikroskopi, som er blevet en standard på området til bestemmelse af makropinocytose in vitro og in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Makropinosomer kan skelnes fra andre endocytiske veje gennem deres evne til at internalisere store makromolekyler, såsom højmolekylær dextran (dvs. 70 kDa)2,3,4,20,21,22,23. Således kan makropinosomer defineres ved optagelse af ekstracellulært administreret fluorofor-mærket 70 kDa dextran. Som et resultat manifesterer makropinocytiske vesikler sig som intracellulære klynger af fluorescerende puncta med størrelser fra 0,2-5 μm. Disse puncta kan mikroskopisk afbildes og efterfølgende kvantificeres for at bestemme omfanget af makropinocytose i cellen – ‘det makropinocytiske indeks’.
I denne protokol beskrives de væsentlige trin til visualisering af makropinosomer i klæbende celler in vitro på en 96-brønds mikroplade og dæksedler ved hjælp af standard laboratorieudstyr (figur 1). Derudover gives anvisningerne til automatisering af billedindsamling og kvantificering af det makropinocytiske indeks ved hjælp af en cellebilleddannelsespladelæser med flere tilstande. Denne automatisering reducerer tid, omkostninger og kræfter sammenlignet med vores tidligere beskrevne protokoller19,20. Derudover undgår det utilsigtet forudindtaget billedindsamling og analyse og forbedrer derved reproducerbarheden og pålideligheden. Denne metode kan let tilpasses forskellige celletyper eller pladelæsere eller bruges til at bestemme alternative makropinosomfunktioner, såsom størrelse, antal og placering. Den heri beskrevne metode er især velegnet til screening af cellekulturbetingelser, der inducerer makropinocytose, identifikation af nye modulatorer eller optimering af lægemiddelkoncentrationer af kendte hæmmere.
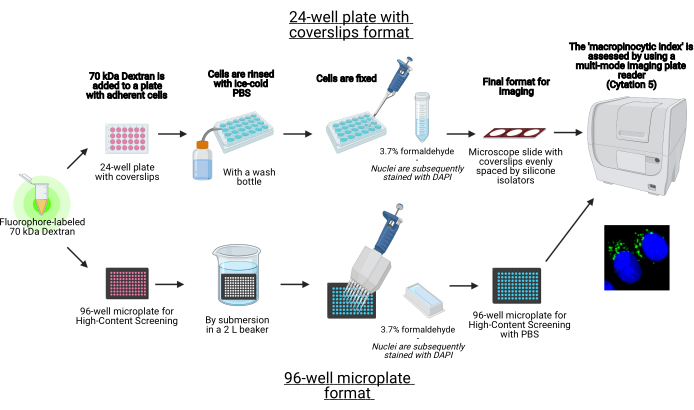
Figur 1: Skematisk over det automatiserede assay til bestemmelse af det ‘makropinocytiske indeks’ i klæbende celler. Oprettet ved hjælp af BioRender. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Kvaliteten af eksperimenterne og dataindsamlingen afhænger i høj grad af reagensernes kvalitet, optimeringen af indstillingerne og renheden af dæksedlerne og mikropladen. De endelige resultater bør give minimal variation mellem replikater; biologiske variationer forekommer dog naturligt eller kan på anden måde skyldes en række faktorer. Celletæthed kan få celler til at reagere mere eller mindre på makropinocytoseinducere eller hæmmere. Det er derfor afgørende at overholde 80% sammenløbet som foreslået her i…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af NIH/NCI-tilskud (R01CA207189, R21CA243701) til C.C. KMO.G. er modtager af en TRDRP Postdoc Fellowship Award (T30FT0952). BioTek Cytation 5 er en del af Sanford Burnham Prebys Cell Imaging Core, som modtager økonomisk støtte fra NCI Cancer Center Support Grant (P30 CA030199). Figur 1-3 blev oprettet ved hjælp af BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Recherche en cancérologie. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Recherche en cancérologie. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

