Imaging e analisi automatizzati per la quantificazione di macropinosomi marcati fluorescentemente
Summary
I saggi automatizzati che utilizzano micropiastre multi-pozzo sono approcci vantaggiosi per identificare i regolatori di percorso consentendo la valutazione di una moltitudine di condizioni in un singolo esperimento. Qui, abbiamo adattato il consolidato protocollo di imaging e quantificazione dei macropinosomi a un formato di micropiastre a 96 pozzetti e forniamo uno schema completo per l’automazione utilizzando un lettore di piastre multimodale.
Abstract
La macropinocitosi è una via di assorbimento in fase fluida non specifica che consente alle cellule di internalizzare grandi carichi extracellulari, come proteine, agenti patogeni e detriti cellulari, attraverso l’endocitosi di massa. Questo percorso svolge un ruolo essenziale in una varietà di processi cellulari, tra cui la regolazione delle risposte immunitarie e il metabolismo delle cellule tumorali. Data questa importanza nella funzione biologica, l’esame delle condizioni di coltura cellulare può fornire informazioni preziose identificando i regolatori di questo percorso e ottimizzando le condizioni da impiegare nella scoperta di nuovi approcci terapeutici. Lo studio descrive una tecnica automatizzata di imaging e analisi che utilizza apparecchiature di laboratorio standard e un lettore di piastre multimodale per l’imaging cellulare per la rapida quantificazione dell’indice macropinocitico nelle cellule aderenti. Il metodo automatizzato si basa sull’assorbimento di destrano fluorescente ad alto peso molecolare e può essere applicato a micropiastre a 96 pozzetti per facilitare la valutazione di più condizioni in un esperimento o campioni fissi montati su coperture di vetro. Questo approccio mira a massimizzare la riproducibilità e ridurre la variazione sperimentale, risparmiando tempo ed economicamente vantaggioso.
Introduction
La via endocitica non specifica della macropinocitosi consente alle cellule di interiorizzare una varietà di componenti extracellulari, tra cui nutrienti, proteine, antigeni e agenti patogeni, attraverso l’assorbimento di massa del fluido extracellulare e dei suoi costituenti1. Sebbene importante per la biologia di numerosi tipi cellulari, sempre più spesso, la via della macropinocitosi è descritta per svolgere un ruolo essenziale nella biologia tumorale, dove, attraverso l’assorbimento macropinocitico, le cellule tumorali sono in grado di sopravvivere e proliferare in presenza di un microambiente impoverito di nutrienti2,3. L’assorbimento di macromolecole extracellulari, tra cui albumina e matrice extracellulare, e detriti cellulari necrotici, fornisce una fonte alternativa di nutrienti per la produzione di biomassa creando aminoacidi, zuccheri, lipidi e nucleotidi attraverso il catabolismo cargo mediato da macropinosomi e lisosomi4,5,6,7,8.
L’induzione e la regolazione della macropinocitosi sono complesse e possono variare a seconda del contesto cellulare. Finora, sono stati identificati diversi induttori della macropinocitosi e includono ligandi, come il fattore di crescita epidermico (EGF), il fattore di crescita derivato dalle piastrine (PDGF), la galectina-3 e Wnt3A9,10,11,12,13. Inoltre, le condizioni di coltura che imitano il microambiente tumorale possono innescare l’attivazione del percorso. I tumori dell’adenocarcinoma duttale pancreatico (PDAC) sono privi di nutrienti, in particolare per l’aminoacido glutammina, che fa sì che sia le cellule tumorali che i fibroblasti associati al cancro (CAS) si affidino alla macropinocitosi per la sopravvivenza7,13,14,15. Inoltre, gli stress tumorali, come l’ipossia e lo stress ossidativo, possono attivare questa via di scavenging16. Oltre ai numerosi influenzatori estrinseci che possono indurre macropinocitosi, una varietà di percorsi intracellulari controlla la formazione di macropinosomi. La trasformazione oncogenica mediata da Ras è sufficiente per avviare il meccanismo macropinocitico e più tipi di cancro presentano macropinocitosi costitutiva oncogenica guidata da Ras4,5,9,17. In alternativa, sono state identificate l’attivazione di Ras wild-type e le vie Ras-indipendenti per attivare la macropinocitosi nelle cellule tumorali e nelle CAF10,11,15,18. L’uso di vari modelli in vitro in combinazione con trattamenti inibitori ha portato all’identificazione di diversi modulatori della macropinocitosi, che includono scambiatori di sodio-idrogeno, la piccola GTPasi Rac1, fosfoinositide 3-chinasi (PI3K), chinasi attivata da p21 (Pak) e proteina chinasi attivata da AMP (AMPK)4,13,15 . Tuttavia, data la moltitudine di fattori e condizioni descritti che regolano la macropinocitosi, è concepibile che molti più modulatori e stimoli rimangano sconosciuti. L’identificazione di nuovi modulatori e stimoli può essere facilitata dalla valutazione automatizzata di una moltitudine di condizioni in un singolo esperimento. Questa metodologia può far luce sui fattori coinvolti nella formazione dei macropinosomi e può consentire la scoperta di nuove piccole molecole o biologici che mirano a questo percorso.
Qui, abbiamo adattato il nostro protocollo precedentemente stabilito per determinare l’estensione della macropinocitosi nelle cellule tumorali in vitro a un formato di micropiastre a 96 pozzetti e l’imaging e la quantificazione automatizzati19,20. Questo protocollo si basa sulla microscopia fluorescente, che è diventata uno standard nel campo per determinare la macropinocitosi in vitro e de vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. I macropinosomi possono essere distinti da altre vie endocitiche attraverso la loro capacità di internalizzare macromolecole di grandi dimensioni, come il destrano ad alto peso molecolare (cioè 70 kDa)2,3,4,20,21,22,23. Pertanto, i macropinosomi possono essere definiti attraverso l’assorbimento di 70 kDa destrano 70 kDa somministrato extracellulare. Di conseguenza, le vescicole macropinocitiche si manifestano come cluster intracellulari di puncta fluorescenti con dimensioni comprese tra 0,2 e 5 μm. Questi puncta possono essere ripresi al microscopio e successivamente quantificati per determinare l’estensione della macropinocitosi nella cellula – “l’indice macropinocitico”.
In questo protocollo, vengono descritti i passaggi essenziali per visualizzare i macropinosomi nelle cellule aderenti in vitro su una micropiastra a 96 pozzetti e coverslip utilizzando apparecchiature di laboratorio standard (Figura 1). Inoltre, vengono fornite le indicazioni per automatizzare l’acquisizione dell’immagine e la quantificazione dell’indice macropinocitico utilizzando un lettore di lastre multimodale di imaging cellulare. Questa automazione riduce tempi, costi e sforzi rispetto ai nostri protocolli descritti in precedenza19,20. Inoltre, evita l’acquisizione e l’analisi di immagini involontariamente distorte e quindi migliora la riproducibilità e l’affidabilità. Questo metodo può essere facilmente adattato a diversi tipi di celle o lettori di piastre o essere utilizzato per determinare caratteristiche macropinosomiche alternative, come dimensioni, numero e posizione. Il metodo qui descritto è particolarmente adatto per lo screening di condizioni di coltura cellulare che inducono macropinocitosi, l’identificazione di nuovi modulatori o l’ottimizzazione delle concentrazioni di farmaci di inibitori noti.
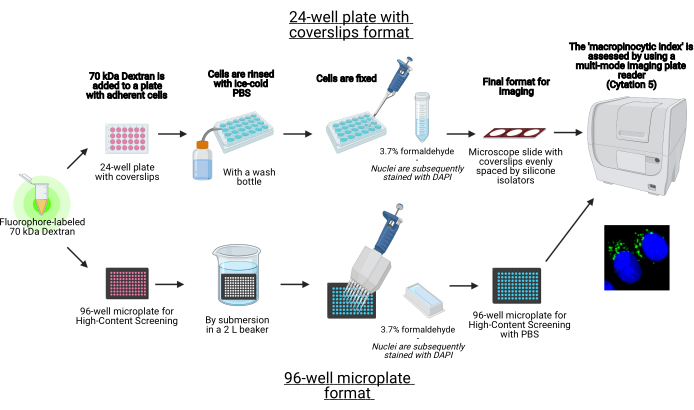
Figura 1: Schema del test automatizzato per determinare l'”indice macropinocitico” nelle cellule aderenti. Creato utilizzando BioRender. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocol
Representative Results
Discussion
La qualità degli esperimenti e dell’acquisizione dei dati dipende molto dalla qualità dei reagenti, dall’ottimizzazione delle impostazioni e dalla pulizia delle coperture e delle micropiastre. I risultati finali dovrebbero dare una variazione minima tra le repliche; tuttavia, le variazioni biologiche si verificano naturalmente o possono essere altrimenti causate da una serie di fattori. La densità cellulare può indurre le cellule a rispondere più o meno agli induttori o agli inibitori della macropinocitosi. E’ quind…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato supportato da sovvenzioni NIH / NCI (R01CA207189, R21CA243701) a C.C. KMO.G. ha ricevuto un TRDRP Postdoctoral Fellowship Award (T30FT0952). BioTek Cytation 5 fa parte del Sanford Burnham Prebys Cell Imaging Core, che riceve sostegno finanziario dal NCI Cancer Center Support Grant (P30 CA030199). Le figure 1-3 sono state create utilizzando BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Recherche en cancérologie. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Recherche en cancérologie. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

