Автоматизированная визуализация и анализ для количественной оценки флуоресцентно меченых макропиносом
Summary
Автоматизированные анализы с использованием микропластин с несколькими скважинами являются выгодными подходами для идентификации регуляторов путей, позволяя оценивать множество условий в одном эксперименте. Здесь мы адаптировали хорошо зарекомендовавший себя протокол визуализации и количественной оценки макропиносом к формату микропластин с 96 лунками и предоставили всестороннюю схему автоматизации с использованием многорежимного считывателя пластин.
Abstract
Макропиноцитоз — это неспецифический путь поглощения жидкой фазы, который позволяет клеткам усваивать большие внеклеточные грузы, такие как белки, патогены и клеточный мусор, посредством объемного эндоцитоза. Этот путь играет важную роль в различных клеточных процессах, включая регуляцию иммунных реакций и метаболизма раковых клеток. Учитывая эту важность в биологической функции, изучение условий клеточной культуры может предоставить ценную информацию путем выявления регуляторов этого пути и оптимизации условий, которые будут использоваться при открытии новых терапевтических подходов. В исследовании описывается автоматизированный метод визуализации и анализа с использованием стандартного лабораторного оборудования и многомодового считывателя пластин для визуализации клеток для быстрой количественной оценки макропиноцитарного индекса в адгезивных клетках. Автоматизированный метод основан на поглощении высокомолекулярного флуоресцентного декстрана и может быть применен к 96-луночным микропластинкам для облегчения оценки нескольких условий в одном эксперименте или фиксированным образцам, установленным на стеклянных крышках. Этот подход направлен на максимизацию воспроизводимости и сокращение экспериментальных вариаций при одновременной экономии времени и рентабельности.
Introduction
Неспецифический эндоцитарный путь макропиноцитоза позволяет клеткам усваивать различные внеклеточные компоненты, включая питательные вещества, белки, антигены и патогены, путем массового поглощения внеклеточной жидкости и ее составляющих1. Хотя это важно для биологии многочисленных типов клеток, все чаще описывается, что путь макропиноцитоза играет важную роль в биологии опухоли, где благодаря макропиноцитарному поглощению опухолевые клетки способны выживать и размножаться в присутствии истощенного питательными веществами микросреды2,3. Поглощение внеклеточных макромолекул, включая альбумин и внеклеточный матрикс, а также некротический клеточный мусор, обеспечивает альтернативный источник питательных веществ для производства биомассы путем создания аминокислот, сахаров, липидов и нуклеотидов через макропиносомы и лизосомы, опосредованные слиянием, катаболизм груза4,5,6,7,8.
Индукция и регуляция макропиноцитоза сложны и могут варьироваться в зависимости от клеточного контекста. До сих пор было идентифицировано несколько индукторов макропиноцитоза, которые включают лиганды, такие как эпидермальный фактор роста (EGF), тромбоцитарный фактор роста (PDGF), галектин-3 и Wnt3A9,10,11,12,13. Кроме того, условия культивирования, которые имитируют микроокружение опухоли, могут вызвать активацию пути. Опухоли аденокарциномы протоков поджелудочной железы (PDAC) лишены питательных веществ, особенно для аминокислоты глутамина, которая заставляет как раковые клетки, так и связанные с раком фибробласты (CAF) полагаться на макропиноцитоз для выживания7,13,14,15. Кроме того, опухолевые стрессы, такие как гипоксия и окислительный стресс, могут активировать этот путь очистки16. В дополнение к многочисленным внешним инфлюенсорам, которые могут индуцировать макропиноцитоз, различные внутриклеточные пути контролируют образование макропиносом. Онкогенная Ras-опосредованная трансформация достаточна для инициирования макропиноцитарного механизма, и несколько типов рака проявляют онкогенный Ras-управляемый конститутивный макропиноцитоз4,5,9,17. В качестве альтернативы, была идентифицирована активация Ras дикого типа и Ras-независимые пути для активации макропиноцитоза в раковых клетках и CAFs10,11,15,18. Использование различных моделей in vitro в сочетании с ингибиторами лечения привело к идентификации нескольких модуляторов макропиноцитоза, которые включают натриево-водородные обменники, малый GTPase Rac1, фосфоинозитид-3-киназу (PI3K), p21-активированную киназу (Pak) и AMP-активированную протеинкиназу (AMPK)4,13,15 . Однако, учитывая множество описанных факторов и условий, регулирующих макропиноцитоз, вполне возможно, что многие другие модуляторы и стимулы остаются неоткрытыми. Идентификация новых модуляторов и стимулов может быть облегчена автоматизированной оценкой множества условий в одном эксперименте. Эта методология может пролить свет на факторы, участвующие в образовании макропиносом, и может позволить обнаружить новые малые молекулы или биологические препараты, которые нацелены на этот путь.
Здесь мы адаптировали наш ранее установленный протокол для определения степени макропиноцитоза в раковых клетках in vitro к формату микропластин с 96 лунками и автоматической визуализации и количественной оценке19,20. Этот протокол основан на флуоресцентной микроскопии, которая стала стандартом в этой области для определения макропиноцитоза in vitro и in vivo4,5,6,7,9,10,11,12,13,15,16,17,18, 19,20,21,22. Макропиносомы можно отличить от других эндоцитарных путей благодаря их способности усваивать крупные макромолекулы, такие как высокомолекулярный декстран (т.е. 70 кДа)2,3,4,20,21,22,23. Таким образом, макропиносомы могут быть определены путем поглощения внеклеточного вводимого флуорофором меченого декстрана 70 кДа. В результате макропиноцитарные везикулы проявляются в виде внутриклеточных скоплений флуоресцентных пункт с размерами от 0,2-5 мкм. Эти пункты могут быть микроскопически изображены и впоследствии количественно определены для определения степени макропиноцитоза в клетке – «макропиноцитарного индекса».
В этом протоколе описаны основные этапы визуализации макропиносом в адгезивных клетках in vitro на 96-луночной микропластине и крышках с использованием стандартного лабораторного оборудования (рисунок 1). Кроме того, приведены указания по автоматизации получения изображения и количественной оценки макропиноцитарного индекса с помощью многомодового пластинчатого считывателя клеточной визуализации. Эта автоматизация сокращает время, затраты и усилия по сравнению с нашими ранее описанными протоколами19,20. Кроме того, он позволяет избежать непреднамеренно предвзятого получения и анализа изображений и тем самым повышает воспроизводимость и надежность. Этот метод может быть легко адаптирован к различным типам клеток или считывателям пластин или использоваться для определения альтернативных признаков макропиносом, таких как размер, количество и местоположение. Описанный в настоящем описании способ особенно подходит для скрининга условий клеточной культуры, которые индуцируют макропиноцитоз, идентификации новых модуляторов или оптимизации концентраций лекарственного средства известных ингибиторов.
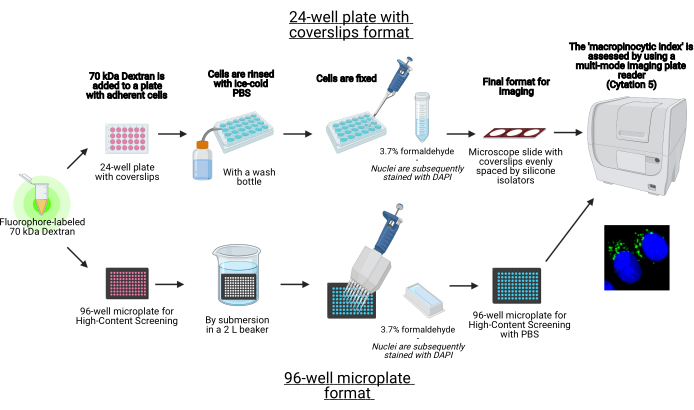
Рисунок 1: Схема автоматизированного анализа для определения «макропиноцитарного индекса» в адгезивных клетках. Создано с помощью BioRender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Качество экспериментов и сбора данных в значительной степени зависит от качества реагентов, оптимизации настроек и чистоты крышек и микропластин. Окончательные результаты должны давать минимальные различия между репликами; однако биологические изменения происходят естественным об?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана грантами NIH / NCI (R01CA207189, R21CA243701) C.C. KMO.G. является получателем премии TRDRP Postdoctoral Fellowship Award (T30FT0952). BioTek Cytation 5 является частью Sanford Burnham Prebys Cell Imaging Core, которое получает финансовую поддержку от гранта NCI Cancer Center Support Grant (P30 CA030199). Рисунки 1-3 были созданы с помощью BioRender.
Materials
| 0.25% Trypsin | Corning | 25053CI | 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate |
| 1.5 mL Microcentrifuge tube | Fisherbrand | 05-408-129 | |
| 10-cm Tissue culture dish | Greiner Bio-One | 664160 | CELLSTAR |
| 15 mL Centrifuge tube | Fisherbrand | 07-200-886 | |
| 2 L Beaker | Fisherbrand | 02-591-33 | |
| 24-well Tissue culture plate | Greiner Bio-One | 662160 | CELLSTAR |
| 25 mL Reagent reservoir | Genesee Scientific Corporation | 28-121 | |
| 500 mL Beaker | Fisherbrand | 02-591-30 | |
| 6-cm Tissue culture dish | Greiner Bio-One | 628160 | CELLSTAR |
| 8-Channel aspiration adapter | Integra Biosciences | 155503 | |
| 8-Channel aspiration adapter for standard tips | Integra Biosciences | 159024 | |
| 95% Ethanol | Decon Laboratories Inc | 4355226 | |
| Ammonia-free glass cleaner | Sparkle | FUN20500CT | |
| Black 96-well high-content screening microplate | PerkinElmer | 6055300 | CellCarrier-96 Ultra |
| Cotton-tipped applicator | Fisherbrand | 23-400-101 | |
| Coverslips | Fisherbrand | 12-545-80 | 12 mm diameter |
| Cytation 5 Cell Imaging Multi-Mode Reader | Biotek | CYT5FW | |
| DAPI | Millipore Sigma | 5.08741 | |
| Dextran 70 kDa – FITC | Life Technologies | D1822 | Lysine-fixable |
| Dextran 70 kDa – TMR | Life Technologies | D1819 | |
| DMSO | Millipore Sigma | D1435 | |
| DPBS | Corning | 21031CV | Without Calcium and Magnesium |
| Forceps | Fine Science Tools | 11251-20 | Dumont #5 |
| Formaldehyde, 37% | Ricca Chemical | RSOF0010-250A | ACS Reagent Grade |
| Glycerol | Fisher BioReagents | BP229-1 | |
| Hardening fluorescence mounting media | Agilent Tech | S302380-2 | DAKO |
| Hoechst 33342 | Millipore Sigma | B2261 | |
| Hydrochloric acid (HCl) | Fisher Chemical | A144-212 | Certified ACS Plus, 36.5%–38.0% |
| Lint-free wipes | Kimberly-Clark | 34155 | Kimwipes |
| Miscroscope slides | Fisherbrand | 12-544-1 | Premium plain glass |
| Multichannel pipette | Gilson | FA10013 | 8 channels, 0.5–10 µL |
| Multichannel pipette | Gilson | FA10012 | 12 channels, 20–200 µL |
| Multichannel pipette | Gilson | FA10011 | 8 channels, 20–200 µL |
| Parafilm M | Pechiney | PM996 | |
| Plastic wrap | Kirkland Signature | 208733 | Stretch-Tite |
| Silicone isolators | Grace Bio Labs Inc | 664107 | 13 mm Diameter X 0.8 mm Depth ID, 25 mm X 25 mm |
| Slide adapter | Biotek | 1220548 | |
| Wash bottle | Fisherbrand | FB0340922C |
References
- Lin, X. P., Mintern, J. D., Gleeson, P. A. Macropinocytosis in different cell types: similarities and differences. Membranes. 10 (8), 21 (2020).
- Recouvreux, M. V., Commisso, C. Macropinocytosis: a metabolic adaptation to nutrient stress in cancer. Frontiers in Endocrinology. 8, (2017).
- Zhang, Y. J., Commisso, C. Macropinocytosis in cancer: a complex signaling network. Trends in Cancer. 5 (6), 332-334 (2019).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497 (7451), 633-637 (2013).
- Kim, S. M., et al. PTEN deficiency and AMPK activation promote nutrient scavenging and anabolism in prostate cancer cells. Cancer Discovery. 8 (7), 866-883 (2018).
- Jayashankar, V., Edinger, A. L. Macropinocytosis confers resistance to therapies targeting cancer anabolism. Nature Communications. 11 (1), (2020).
- Kamphorst, J. J., et al. Human pancreatic cancer tumors are nutrient poor and tumor cells actively scavenge extracellular protein. Recherche en cancérologie. 75 (3), 544-553 (2015).
- Olivares, O., et al. Collagen-derived proline promotes pancreatic ductal adenocarcinoma cell survival under nutrient limited conditions. Nature Communications. 8, (2017).
- Seguin, L., et al. Galectin-3, a druggable vulnerability for KRAS-addicted cancers. Cancer Discovery. 7 (12), 1464-1479 (2017).
- Redelman-Sidi, G., et al. The canonical Wnt pathway drives macropinocytosis in cancer. Recherche en cancérologie. 78 (16), 4658-4670 (2018).
- Tejeda-Munoz, N., Albrecht, L. V., Bui, M. H., De Robertis, E. M. Wnt canonical pathway activates macropinocytosis and lysosomal degradation of extracellular proteins. Proceedings of the National Academy of Sciences of the United States of America. 116 (21), 10402-10411 (2019).
- Schmees, C., et al. Macropinocytosis of the PDGF beta-receptor promotes fibroblast transformation by H-RasG12V. Molecular Biology of the Cell. 23 (13), 2571-2582 (2012).
- Lee, S. -. W., et al. EGFR-Pak signaling selectively regulates glutamine deprivation-induced macropinocytosis. Developmental Cell. 50 (3), 381-392 (2019).
- Recouvreux, M. V., et al. Glutamine depletion regulates Slug to promote EMT and metastasis in pancreatic cancer. Journal of Experimental Medicine. 217 (9), (2020).
- Zhang, Y., et al. Macropinocytosis in cancer-associated fibroblasts is dependent on CaMKK2/ARHGEF2 signaling and functions to support tumor and stromal cell fitness. Cancer Discovery. 11 (7), 1808-1825 (2021).
- Su, H., et al. Cancer cells escape autophagy inhibition via NRF2-induced macropinocytosis. Cancer Cell. 39 (5), 678-693 (2021).
- Bar-Sagi, D., Feramisco, J. R. Induction of membrane ruffling and fluid-phase pinocytosis in quiescent fibroblasts by ras proteins. Science. 233 (4768), 1061-1068 (1986).
- Mishra, R., et al. Stromal epigenetic alterations drive metabolic and neuroendocrine prostate cancer reprogramming. Journal of Clinical Investigation. 128 (10), 4472-4484 (2018).
- Commisso, C., Flinn, R. J., Bar-Sagi, D. Determining the macropinocytic index of cells through a quantitative image-based assay. Nature Protocols. 9 (1), 182-192 (2014).
- Galenkamp, K. M. O., Alas, B., Commisso, C. Quantitation of macropinocytosis in cancer cells. Methods in Molecular Biology. 1928, 113-123 (2019).
- Wang, J. T. H., Teasdale, R. D., Liebl, D. Macropinosome quantitation assay. MethodsX. 1, 36-41 (2014).
- Lee, S. -. W., Alas, B., Commisso, C. Detection and quantification of macropinosomes in pancreatic tumors. Methods in Molecular Biology. 1882, 171-181 (2019).
- Williams, T., Kay, R. R. High-throughput measurement of dictyostelium discoideum macropinocytosis by flow cytometry. Journal of Visualized Experiments: JoVE. (139), e58434 (2018).

