ストップフローと小角中性子散乱によるナノスケール材料の時間発展の測定
Summary
このプロトコルは、小角中性子散乱測定中に複数の液体溶液を その場 で迅速に混合し、ナノメートルの長さスケールと秒の時間スケールで運動過程を研究するために、ストップフローサンプル環境の使用を提示します。
Abstract
この論文では、ストップフロー小角中性子散乱(SANS)サンプル環境を使用して、液体サンプルをすばやく混合し、数秒から数分の時間スケールでナノスケールの運動プロセスを研究します。ストップフローサンプル環境では、市販のシリンジポンプを使用して必要な量の液体サンプルを混合し、ダイナミックミキサーを介して石英ガラスセルに約1秒で注入します。時間分解SANSデータ収集は、サンプル混合と同期して、混合後の溶液中のナノ構造の進化を追跡します。
中性子ビーム時間を最も効率的に利用するために、一連のフローセレクターバルブを使用して、測定の合間にセルを自動的にロード、すすぎ、乾燥させ、複数のサンプル注入を通じて繰り返しデータ収集を可能にします。十分な中性子散乱統計が収集されるまで、サンプル注入が繰り返されます。混合セットアップは、さまざまな混合比、サンプル濃度、添加剤濃度、および温度で動態を測定するために、条件を体系的に変化させるようにプログラムできます。注入ごとに必要な最小サンプル量は、石英セルの経路長に応じて約150 μLです。
このストップフローサンプル環境を使用した代表的な結果は、添加剤であるシクロデキストリンの存在下での迅速な脂質交換速度について示されています。小胞は数秒のオーダーで外側のリーフレット(外部)脂質を交換し、数時間以内に内部と外部の両方の脂質を完全に交換します。脂質交換速度論を測定するには、in situ 混合で高速(秒)と低速(分)のプロセスをキャプチャし、速度定数を抽出する必要があります。同じサンプル環境を使用して、脂質ナノ粒子、タンパク質、界面活性剤、ポリマー、エマルジョン、無機ナノ粒子などの他のタイプの液体サンプルでの分子交換を調べることもできます。交換または反応系のナノスケールの構造変換と動力学を測定することで、ナノスケールで進化するプロセスへの新しい洞察が得られます。
Introduction
小角中性子散乱(SANS)は、≈1 nmから≈100 nm 1,2,3までの長さスケールでさまざまな材料のサイズ、形状、相互作用、および組織を測定する独自の方法を提供します。集束ミラーを備えたVSANS(超小角中性子散乱)装置を含む最近の機器は、最大≈1000nm4,5までのさらに大きな長さスケールの測定に向けて限界を押し広げています。一般に、中性子散乱法に固有のユニークな散乱コントラストは、医薬品製剤中の成分の凝集6、ポリマー系における架橋およびゲル化反応7,8、膜タンパク質のメソ結晶化9,10、タンパク質の分解およびアンフォールディング11,12など、ナノスケール構造の時間発展を測定する上でいくつかの利点を提供する。、およびシリカ系材料の成長13、14、15。独自の散乱コントラストにより、時間分解SANS(TR-SANS)は、他のストップフローベースの測定を補完するのに便利です。
ストップフロー混合法は、小角X線散乱(SAXS)16,17,18,19,20,21、蛍光分光法22,23,24,25,26、および光散乱27,28,29,30においてしばしば実施される。ミリ秒の時間スケールで運動過程を研究するための31,32の実験。SANSとSAXSの重要な違いは、中性子散乱は非破壊的な特性評価技術であり、そのため、SANSを使用して、高フラックスX線散乱実験中に発生する可能性のある、サンプルへの電離放射線損傷なしに、同じサンプルを数時間または数日間測定できることです33。SANS測定を繰り返してもプローブ分子やサンプルの化学構造は変化しないため、例えば蛍光に依存する速度論測定を複雑にする可能性のある光退色の影響なしに時間発展を研究することができます23,24。さらに、SANSは、動的光散乱などの光ベースの技術では特性評価が難しいことが多い、高濃度で光学的に不透明なサンプルの測定に使用できます。
ナノスケールの構造情報を提供することに加えて、SANSを使用して、中性子散乱長密度コントラストの変化を通じてこれらの構造の局所組成を調べることができます。異なる元素の散乱長密度(SLD)は周期表全体でランダムに変化し、同じ元素の異なる同位体によって変化します。一般的に利用されている例は、水素(1HまたはH)と重水素(2HまたはD)であり、これらは中性子散乱長が大きく異なります。したがって、界面活性剤、脂質、タンパク質、RNA、DNA、その他のポリマーなどの水素に富む材料は、システムの物理的特性を大幅に変更することなく、SANSを使用して重水素化溶媒と区別できます。ただし、H/D交換はサンプルの密度、水素結合、および相転移温度に影響を与える可能性があることに注意することが重要です。それにもかかわらず、水素に富む材料に対するSANSのユニークな感度は、SAXSなどのX線ベースの技術で関心のあるサンプルの散乱コントラストとシグナルが低いソフトマター研究で特に役立ちます。同位体置換により、SANSは、H標識分子とD標識分子を混合するだけで、水素が豊富な材料の分子交換速度を研究するための強力なツールになります。同位体置換は、嵩高い蛍光色素が目的の界面活性剤または脂質分子よりも大きく、交換速度論に影響を与える可能性がある系において特に有用である34、35。
時間分解SANS測定は、測定された強度が時間、長さスケール、およびSLDコントラストの関数であるため、有利です。そのため、TR-SANS実験は、空間分布とサンプルの組成の時間依存の変化を調べるように設計できます。SANSのこれらのユニークな利点は、界面活性剤36,37,38、エマルジョン39,40,41、脂質34,42,43,44,45,46,47,48,49などの多くのソフトマテリアルシステムにおける速度論的プロセスに関する重要な洞察をもたらしました。、50、およびポリマー51、52、53、54、55、56、57、58、59、60、61、62。ほとんどのTR-SANS研究は、数分から数時間の時間スケールに焦点を当てています。しかし、関心のある多くの運動過程は2番目の時間スケールで発生し、根底にあるメカニズムを理解するために不可欠です。これらの初期の時点を捉えるには、溶液を迅速に混合し、その場で測定する必要があり、停止流光散乱27、28、29、30、31、32、蛍光22、23、24、25、26、およびX線中に混合をデータ収集と同期させる必要があります。16、17、18、19、20、21の実験。この研究では、複数の液体サンプルを迅速に混合し、TR-SANS測定のために混合物を石英ガラスセルに注入するように設計されたサンプル環境の使用について説明します。混合装置は、最近開発されたキャピラリーレオSANS装置63の適応であり、複数のシリンジポンプおよびバルブを使用して、サンプル混合を制御し、細胞洗浄を自動化する。シリンジポンプを一連のフローセレクターバルブに接続することで、複数の入口ストリームを繰り返し混合、測定、すすぎ、乾燥して、秒単位でのTR-SANS測定を容易にすることができます。
現在の手順では、目的のサンプルが特定され、準備されていることを前提としています。私たちは、その場での混合セットアップとTR-SANSデータを収集する方法に焦点を当てています。中性子散乱データは、NIST中性子研究センター(NCNR)のVSANS機器で収集されました。ただし、この手順は他のSANS機器にも適用できるはずです。他のSANS機器に同様のプロトコルを実装することに関心のある読者は、地元の機器科学者に相談して、目的の速度論プロセスに最も関連する望ましい長さスケールと時間スケールで中性子束を最大化するための最適な機器構成を決定する必要があります。ここに示されているデータは、空間分解能5の損失で中性子数を最大化するために、VSANSの高フラックス「ホワイトビーム」構成を使用して収集されました。検出器キャリッジは、0.005 Å-1 < q < 0.5 Å-1の範囲の散乱ベクトル(q)をカバーするように配置され、≈130 nmから≈13 nmの長さスケールに対応します。散乱ベクトルはq = 4π/λ sin(θ/2)と定義され、λは中性子波長、θは散乱角である。
TR-SANS測定に使用されるストップフロー混合装置は、 図1に示すように、複数のポンプ、リンスシリンジ、サンプルシリンジ、フローセレクター、およびアダイナミックミキサー、サンプルセル、および混合サンプル容器で構成されています。すべての密閉流体経路は、シリンジ、バルブ、接続チューブ、ダイナミックミキサー、サンプルセルを含む空調されたエンクロージャ内に配置されています。プログラム可能な熱電エアコンを使用して、エンクロージャの温度を10°Cから50°Cの範囲で±1°C以内に制御します。 エンクロージャの断熱材の一部は、デバイスの動作部分を示すために取り外されていることに注意してください。メインのミキシングデバイスの筐体は、NCNRのNG3 VSANSビームラインの並進ステージに配置されています。エンクロージャの位置は、平行移動ステージを使用して調整され、サンプルセルを中性子ビームの経路(黄色の破線)に配置します。

図1:NIST中性子研究センターのVSANSビームラインでのストップフロー混合と小角中性子散乱測定を組み合わせるためのセットアップ例。 セットアップには、4つのシリンジポンプ、溶剤すすぎ用の2つのシリンジ、サンプル注入用の2つのシリンジ、4つのポンプセレクターバルブ、2つのミキサーセレクターバルブ、ダイナミックミキサー、フロースルー石英セル、および混合サンプルコンテナが含まれています。入射した中性子は、サンプルセル内にある混合サンプルから散乱します。石英窓と熱電空調ユニットを備えた断熱エンクロージャを使用して、サンプルとすべての機器を一定温度で制御します。黄色の破線は中性子ビームの経路を示しています。スケールバー= 10 cm。 この図の拡大版を表示するには、ここをクリックしてください。
図1に示すデバイスは、2つのサンプルシリンジ、2つのすすぎシリンジ、および 1 つのサンプルセルで構成されています。プロトコルのさまざまなステップに対応するフロー図を 図2に示します。所望の量の2つの異なるサンプルをミキサーおよびサンプルセルに注入する(図2A)。サンプルセルが充填されると、インレットスイッチバルブ(ISV)とアウトレットスイッチバルブ(OSV)を閉じて、サンプルセルをダイナミックミキサーから隔離し、TR-SANSデータ収集中にサンプルがセルに逆拡散するのを防ぎます(図2B)。ダイナミックミキサーの前は、接続チューブの長さは10cmから1mまで変化し、混合遅延時間には影響しません。ただし、ダイナミックミキサーとサンプルセル間のチューブ接続は、混合遅延時間と必要なサンプル注入量に影響します。ダイナミックミキサー、ミキサーセレクターバルブ(MSV1およびMSV2)、およびISVおよびOSVを接続するために、内径0.04インチ(1 mm)、長さ100 mmのプレカットステンレス鋼チューブが使用されます。内径1mm、長さ115mmのフッ素系チューブを使用して、ISVとOSV(またはダイナミックミキサー出口)をサンプルセルに接続します。混合遅延時間に影響を与える総ボイド容量には、ミキサーのボイド容量(0.15 mL)、ミキサー出口とサンプルセル入口の間のチューブ(0.09 mL)、およびサンプルセル容量(0.16 mL)が含まれます。この例では、総空隙容積は0.4mLである。バルブの内部ボイドボリュームは、チューブ、ミキサー、およびサンプルセルのボイドボリュームと比較してごくわずかです。例えば、採用された低圧セレクターバルブ(ボア径0.75mm)のボイド体積は約4μL、高圧セレクターバルブとスイッチバルブ(ボア径0.25mm)のボイド体積は約0.5μLです。
TR-SANS測定が完了したら、サンプルを溶媒とともにセルから押し出し、リンス溶媒をセルに繰り返しポンプで送り込んで、残留サンプルを除去し、サンプルセルを洗浄します(図2C)。リンスシリンジは、ポンプセレクター値を介してより大きな溶媒リザーバー(水やエタノールなど)に接続され、測定の実行間でサンプルセルを洗浄するのに十分な溶媒量を確保します。可燃性液体を含む溶媒源、サンプル源、および混合サンプル容器は、考えられるすべての発火源を排除するために、電気機器のない別のエンクロージャに配置されます。さらに、可燃性蒸気と溶剤の蒸発を最小限に抑えるために、ベーパーロックボトルキャップが使用されます。最後に、サンプルセルを窒素ガス流で乾燥させて、残留すすぎ溶媒を除去します(図2D)。ミキサーセレクターバルブへの入口窒素ガス圧力は、窒素ガスボンベにある手動圧力調整器を使用して、約2バール(0.2MPa、ゲージ圧)に調整されます。サンプルセルが十分に洗浄および乾燥されると、新しく混合されたサンプルが次の測定サイクルのためにサンプルセルに注入されます(図 2Aのフロー図に示されている混合と注入を繰り返します)。
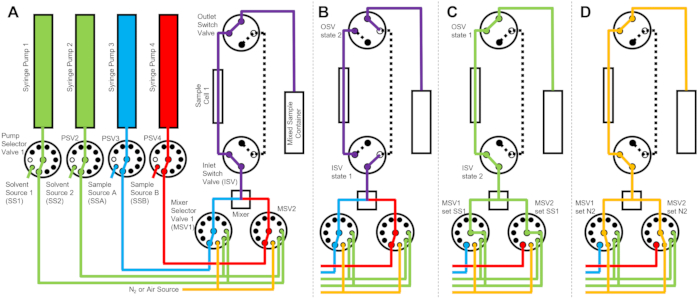
図2:1つのサンプルセル、2つのサンプル混合、および洗浄用の2つのリンス溶媒を使用したフロー図の例。 (a)サンプルA(青)とサンプルB(赤)を混合し、混合したサンプル(紫)をサンプルセルに流します。(B)データ収集中、ISVおよびOSVスイッチバルブが閉じてサンプルセルを分離し、データ収集中のサンプルの逆拡散を防止する停止フローデバイス状態。(C)データ収集後にサンプルセルをSS1(緑色)からのリンス溶剤ですすぐ洗浄ステップ。(d)試料セルを窒素ガス(オレンジ色)で乾燥する乾燥工程。略語:PSV =ポンプセレクターバルブ。MSV =ミキサーセレクターバルブ;OSV =アウトレットスイッチバルブ;ISV = インレットスイッチバルブ;SS1 = 溶媒源 1;SSA = サンプル ソース A;N2 =窒素ガス源。この図の拡大版を表示するには、ここをクリックしてください。
図3は、混合セットアップが同じスイッチバルブに接続された2つの別々のサンプルセルで構成されている場合の、わずかに異なるバージョンのフロー図を示しています(図3A)。TR-SANSデータがサンプルセル1に収集されている間、サンプルセル2はすすぎ(図3B)、乾燥されます(図3C)。サンプルセル1のデータ収集が完了すると、インレットスイッチバルブは、データ収集のために新しく混合されたサンプルをサンプルセル2に導きます(図3D)。TR-SANSデータがサンプルセル2に収集されている間、サンプルセル1はすすぎおよび乾燥されます(図3E)。2つのサンプルセル間のこの交互の並列プロセスは、後続のサンプル注入間の時間を最小限に抑え、中性子ビームの使用時間を最大化します。
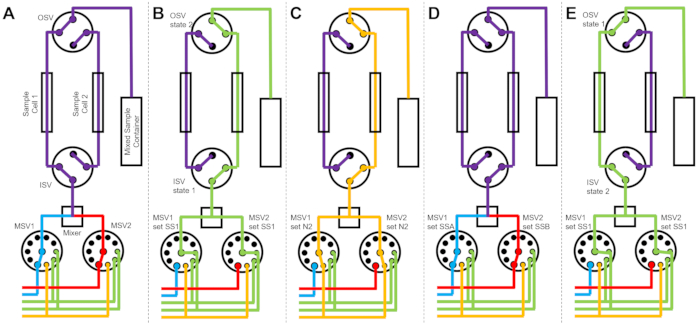
図3:2つのサンプルセル、2つのサンプルの混合、および洗浄用の2つのリンス溶媒を使用したフロー図の例。 (A)サンプルA(青)とサンプルB(赤)を混合し、混合サンプル(紫)をサンプルセル1に流します。(b)試料セル2がSS1からの溶媒ですすがれている間の試料セル1上のデータ収集中の停止流動装置状態(緑色)。(c)試料セル2を窒素ガスで乾燥させている間の試料セル1でのデータ収集中の停止流動装置状態(オレンジ色)。(d)サンプルセル1のデータ収集が完了すると、すぐに新しいサンプル(紫色)が混合され、サンプルセル2に流入されます。(e)試料セル1がSS1からの溶媒ですすがれている間の試料セル2でのデータ収集中の停止流動装置状態(緑色)。一方のサンプルセルが測定されている間、もう一方のサンプルセルは洗浄および乾燥されています。ストップフロー測定プロセスは、2つのサンプルセル間で交互に行われ、後続のサンプル混合注入間の時間を最小限に抑えます。略語:PSV =ポンプセレクターバルブ。MSV =ミキサーセレクターバルブ;OSV =アウトレットスイッチバルブ;ISV = インレットスイッチバルブ;SS1 = 溶媒源 1;SSA = サンプル ソース A;N2 =窒素ガス源。この図の拡大版を表示するには、ここをクリックしてください。
ポンプとチューブラインの接続、システムのプライミング、サンプルセルのすすぎと乾燥、混合サンプルの注入に関する段階的なプロトコルを以下に説明します。シンプルにするためにシングルセル構成が示されていますが(図2)、柔軟なモジュラーセットアップ、プロトコル、およびスクリプトを簡単に変更して、図3に示す2サンプルセル構成など、より多くのシリンジポンプ、バルブ、ミキサー、またはサンプルセル構成を実装することができます。混合および洗浄注入サイクル全体で収集された代表的な生中性子計数率データを図4に示し、3つの異なる温度で測定された脂質交換速度論および交換された脂質の割合に対応する抽出された正規化散乱強度をそれぞれ図5および図6に示す。
Protocol
Representative Results
Discussion
現在の手順では、混合装置とストップフローTR-SANS測定を実行する手順について説明します。デバイスとプロトコルは、対象の時間スケールが≈1秒から5分の低粘度液体サンプル用に最適化されています。5分を超える時間スケールの場合、サンプルを手動で混合して標準的な散乱セルにロードすることは、特に高粘度のサンプル、ゲル、またはペーストの場合、より簡単で望ましい場合があり…
Divulgations
The authors have nothing to disclose.
Acknowledgements
NG3 VSANSへのアクセスは、協定番号DMR-2010792に基づいて、国立標準技術研究所と国立科学財団の間のパートナーシップである高解像度中性子散乱センターによって提供されました。M.H.L.Nは、Mitacs Globalink(カナダ)から提供された資金提供を認めています。商用製品または商号の特定は、理解を促進するためのものであり、米国国立標準技術研究所による承認または推奨を意味するものではありません。
Materials
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
References
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101 (2007).
- Grillo, I., Borsali, R., Pecora, R. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. , (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31 (2015).
- Barker, J. G., Kline, S., et al. . 2019 NCNR Annual Report, Special Publication (NIST SP). , (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470 (2021).
- van’t Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948 (2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349 (2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227 (2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142 (2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874 (2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) – Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -. T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -. T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101 (2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591 (2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667 (2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302 (2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D., Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. , 51 (2013).
- Choi, S. -. H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802 (2010).
- Choi, S. -. H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599 (2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov Available from: https://github.com/usnistgov/stopped-flow-sans (2021)
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111 (2020).

