섬모 박동 빈도의 정량화를 위한 1차 인간 비강 상피 세포 모델의 수집, 확장 및 분화
Summary
이 프로토콜은 비강 상피 세포 수집, 확장 및 기관형 기도 상피 세포 모델로의 분화와 라이브 셀 이미징 및 맞춤형 스크립트를 통한 섬모 박동 빈도의 정량화를 설명합니다.
Abstract
섬모 기능 (박동 빈도, 패턴)의 측정은 원발성 섬모 운동 이상증과 같은 호흡기 질환의 진단 도구로 확립되었습니다. 그러나, 이들 기술의 더 넓은 적용은 온도, 습도 및 pH와 같은 환경 인자의 변화에 대한 섬모 기능의 극단적 인 민감성에 의해 제한된다. 낭포 성 섬유증 (CF) 환자의기도에서 점액 축적은 섬모 박동을 방해합니다. 섬모 기능은 CF 막 횡단 전도도 조절기 (CFTR) 채널 활성의 지표로서 1 차기도 세포 모델에서 조사되었습니다. 그러나 동일한 CFTR 돌연변이를 가진 환자의 경우에도 CFTR 조절 약물에 대한 반응으로 섬모 박동 빈도의 상당한 환자 간 변동성이 발견되었습니다. 또한, 기능 장애 CFTR 조절 염화물 분비가 섬모 기능에 미치는 영향은 잘 이해되지 않았습니다. 현재 체외 기도 모델의 샘플 준비, 이미지 획득 및 섬모 박동 주파수 (CBF) 분석을 입증하는 포괄적 인 프로토콜은 없습니다. 환경적으로 통제된 조건에서 수행된 표준화된 배양 조건 및 이미지 획득은 개인 간 및 CFTR 조절 약물에 대한 반응으로 CBF의 일관되고 재현 가능한 정량화를 가능하게 합니다. 이 프로토콜은 세 가지 다른 기도 상피 세포 모델 시스템에서 CBF의 정량화를 설명합니다: 1) 천연 상피 시트, 2) 투과성 지지 삽입물 상에서 이미징된 공기-액체 인터페이스 모델, 및 3) 세포외 기질-포매된 3차원 오가노이드. 후자의 두 가지는 생체 내 폐 생리학을 복제하여 섬모를 뛰고 점액을 생성합니다. 섬모 기능은 환경 제어 챔버에서 고속 비디오 카메라를 사용하여 캡처됩니다. 사용자 정의 스크립트는 CBF 분석에 사용됩니다. CBF 측정을 클리닉으로 번역하는 것은 환자별로 CFTR 조절 약물에 대한 반응을 예측하는 데 중요한 임상 도구로 구상됩니다.
Introduction
섬모 박동 빈도(CBF) 및 패턴의 측정은 원발성 섬모 운동 이상증(PCD)1과 같은 호흡기 질환의 진단 도구로 확립되었습니다. 낭포 성 섬유증 (CF)에서 CF 막 횡단 전도도 조절기 (CFTR) 염화물 채널의 기능 장애는기도 표면 액체의 탈수 및 점액 섬모 클리어런스 손상2을 유발합니다. 섬모 기능은 CFTR 채널 활성의 지표로서 일차 기도 세포 모델에서 시험관내에서 조사되었다3. 그러나, 동일한 CFTR 돌연변이를 가진 환자의 경우에도, CFTR 조절 약물에 대한 반응으로 CBF에 상당한 환자 대 환자 가변성이 존재한다3. 또한, 기능 장애 CFTR 조절 염화물 분비가 섬모 기능에 미치는 영향은 잘 이해되지 않았습니다. 현재 체 외 기도 모델의 샘플 준비, 이미지 획득 및 CBF 분석을 입증하는 포괄적 인 프로토콜은 없습니다.
비강 점막 칫솔질로부터 분리 된 비강 상피 시트는 PCD 진단4을위한 섬 모체 기능의 측정에 직접 사용된다. 그러나, 수득된 비강 상피 시트의 크기 또는 품질에 대한 제어는 없지만, CBF는 단일 세포 또는 세포 시트 및 파쇄되거나 중단되지 않은 상피 시트 섬모 가장자리에서 측정되는지 여부에 따라달라집니다5. 따라서 비강 점막 칫솔질을 수집하는 동안 세포 손상으로 인한 이차성 운동 이상증은 CBF에 영향을 미칠 수 있습니다. 비강 상피 세포의 1 차 세포 배양 및 공기-액체 계면 (ALI) 또는 3 차원 기저막 매트릭스에서 섬모기도 상피 오가노이드로의 분화는 2 차 운동 이상증 4,6,7,8이없는 섬모를 생성합니다. ALI에서 분화된 기도 상피 세포(이하 ALI 모델이라고 함)는 생체 외 코 점막 칫솔질의 섬모 박동 패턴과 빈도를 복제하고6 환자 특이적 결함을 유지하면서 섬모 미세 구조, 박동 패턴 및 박동 빈도를 분석할 수 있는 중요한 2차 진단 보조제로 간주되었습니다.9 . 그러나 이러한 유사층화되고 점액섬모로 분화된 세포 모델을 만드는 데 사용되는 방법론에는 불일치가 존재합니다. 상이한 배양 확장 또는 분화 프로토콜은 뚜렷한 상피 표현형(섬모 또는 분비)10을 유도하고 CBF11에 상당한 차이를 초래할 수 있습니다. CBF 는 비강 상피 브러싱 4,6,12,13,14,15,16,기도 상피 오가노이드14,17,18 및 ALI 모델 3,4,6,13,19,20 에서 정량화되었으며, 21. 그러나 이러한 프로토콜 중에는 큰 변동성이 있으며 종종 많은 매개 변수가 제어되지 않습니다. 예를 들어, 일부 연구에서, CBF는 ALI 모델의 세포가 투과성 지지체 삽입물 3,19,20,21 상에 남아있는 동안 현장에서 이미징되지만, 다른 것들은 투과성 지지체 삽입물로부터 세포를 긁어내고 이들을 배지 4,6,13에 부유시키는 것을 이미지화한다.
또한, 섬모 기능을 측정하는 기술의 광범위한 적용은 환경 요인의 변화에 대한 섬모 기능의 극단적 인 민감성에 의해 제한됩니다. 온도 22, 습도 23,24 및 pH 25,26과 같은 환경 요인은 섬모 기능에 영향을 미치며 CBF를 정확하게 정량화하기 위해 조절되어야 합니다. 다양한 실험실에서 사용되는 다양한 생리적 매개 변수와 CBF에 미치는 영향은 이전에 검토되었습니다27.
CBF 측정에 대한 다양한 이미징 기술 및 접근법이 문헌에보고되어 있습니다. PCD 진단의 경우 비디오 현미경을 사용하여 섬모 기능28,29를 측정합니다. 최근에, 차동 동적 현미경에 기초한 비디오 분석 알고리즘이 기도 상피 세포 ALI 모델 3,30에서 CBF 및 섬모 협응을 정량화하는 데 사용되었다. 이 방법은 영역을 분할하거나 선택할 필요 없이 빠르고 완전히 자동화된 방식으로 기도 상피 세포에서 섬모 박동의 특성을 분석할 수 있습니다. CBF의 이미징 및 정량화를 위한 다양한 방법은 문헌에서 CBF에 보고된 차이점을 추가할 수 있습니다(보충 파일 1).
배양에서 정량화에 이르는 프로토콜은 기존 방법을 간소화하고, 배양 조건의 표준화 및 엄격한 환경 통제 조건에서 수행되는 이미지 획득을 통해 개인 내 및 개인 간에 CBF의 일관되고 재현 가능한 정량화를 가능하게 합니다.
이 프로토콜은 비강 기원의 세 가지 다른 기도 상피 세포 모델 시스템에서 상피 세포 수집, 확장 및 분화 배양 조건, CBF의 정량화에 대한 완전한 설명을 제공합니다: 1) 네이티브 상피 시트, 2) 투과성 지지 삽입물에서 이미징된 ALI 모델 및 3) 세포외 기질(ECM) 내장 3차원 오가노이드(그림 1 ). 비강 하비갑개 칫솔질로부터 수득된 비강 상피 세포는 기관지 칫솔질 수집과 관련된 침습적 절차를 극복하면서 기관지 상피 세포(31)에 대한 효과적인 대용물이기 때문에 기도 상피의 대표자로서 사용된다. 조건부 재프로그래밍 세포(CRC) 방법은 ALI 모델 및 3차원 오가노이드 생성을 위해 일차 기도 상피 세포를 확장하는 데 사용됩니다. 줄기 세포와 유사한 상태로의 기도 상피 세포의 조건부 재프로그래밍은 성장-정지된 섬유아세포 영양세포 시스템 및 Rho-관련 키나아제 (ROCK) 억제제32와의 공동 배양에 의해 유도된다. 중요하게도, CRC 방법은 조직 특이적 분화 잠재력을 유지하면서 기도 상피 세포의 집단 배가를 증가시킵니다(33,34). 모든 기도 상피 세포 모델에서 섬모 기능은 표준화된 이미지 획득 설정을 갖춘 고속 비디오 카메라를 사용하여 온도 제어 챔버에서 캡처됩니다. 맞춤형 스크립트는 CBF의 정량화를 위해 사용됩니다.
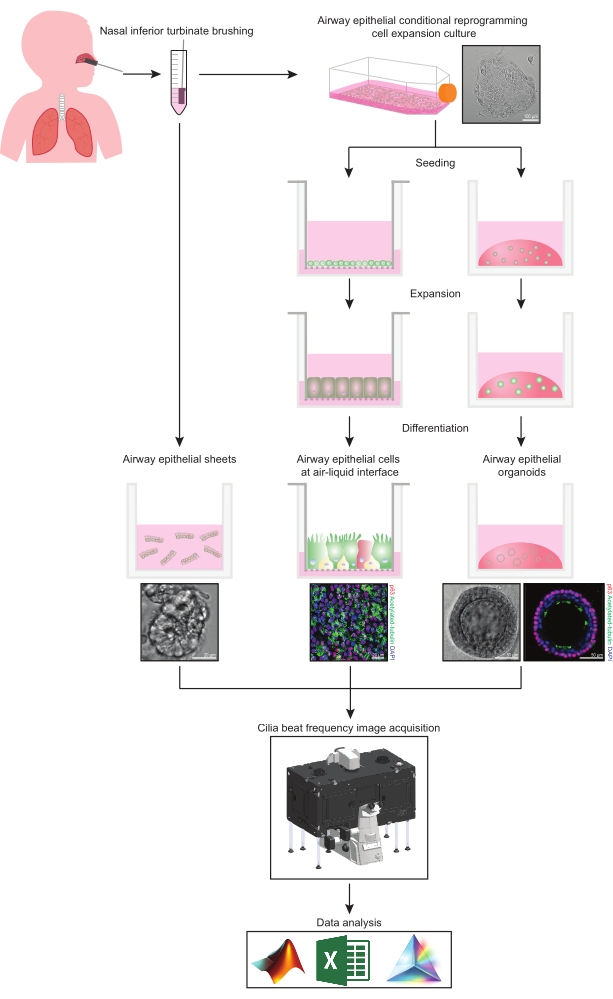
그림 1: 워크플로의 개략도. 참가자의 비강 하비갑개를 닦은 후 기도 상피 세포는 두 가지 방법 중 하나로 활용됩니다. 기도 상피 시트가 분리되고 섬모 박동 빈도가 즉시 이미지화되거나 기도 상피 세포가 조건부 재프로그래밍 세포 방법을 통해 확장됩니다. CRC-확장 기도 상피 세포는 공기-액체 계면 또는 기도 상피 오가노이드 배양에서 기도 상피 세포를 확립하기 위해 분화됩니다. 섬모 박동 주파수의 이미징은 가열 및 습도 환경 챔버와 빠른 프레임 속도(>100Hz) 과학 카메라가 있는 라이브 셀 이미징 현미경을 사용하여 획득됩니다. 데이터 분석은 사용자 지정 스크립트를 사용하여 수행됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
비강 상피 시트에서 CBF의 정량화를 모호하게 할 수있는 여러 요인이 있습니다. 상피 시트는 이 시간 동안 섬모 기능이 가장 안정적이기 때문에 샘플 수집 후 3-9시간 이내에 이미지화되어야 합니다(37). 적혈구와 파편이 적을수록 데이터 수집을 방해하기 때문에 이미징에 가장 적합합니다. 이미징을 위한 ROI를 선택할 때, 이러한 변수가 CBF5에 영향을 미치는 것으?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
연구 참가자와 그 가족의 기여에 감사드립니다. 환자 생체 표본의 조직 및 수집에 대한 시드니 아동 병원 (SCH) 랜드 윅 호흡기 부서의 도움에 감사드립니다 – 존 위저 박사, 이본 벨레시스 박사, 리앤 플러시, 아만다 톰슨, 론다 벨에게 특별한 감사를드립니다. 우리는 UNSW 시드니의 Mark Wainwright Analytical Centre 내의 Katharina Gaus Light Microscopy Facility의 Iveta Slapetova와 Renee Wan의 도움을 인정합니다. 이 작업은 NHMRC(National Health and Medical Research Council) Australia(GNT1188987), CF Foundation Australia 및 Sydney Children’s Hospital Foundation의 지원을 받습니다. 저자는 Luminesce Alliance – 어린이 건강을위한 혁신의 기여와 지원에 대해 인정하고 싶습니다. Luminesce Alliance – 어린이 건강을위한 혁신은 시드니 어린이 병원 네트워크, 어린이 의학 연구소 및 어린이 암 연구소 간의 비영리 협력 합작 투자입니다. 소아과 연구를 조정하고 통합하기 위해 NSW 정부의 지원으로 설립되었습니다. Luminesce Alliance는 University of Sydney 및 University of New South Wales Sydney와도 제휴하고 있습니다. KMA는 호주 정부 연구 교육 프로그램 장학금의 지원을 받습니다. LKF는 시드니 코브 로타리클럽/시드니 아동 병원 재단과 UNSW 대학교 대학원 장학금의 지원을 받는다.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

