جمع وتوسيع وتمايز نماذج الخلايا الظهارية الأنفية البشرية الأولية لتحديد تردد ضربات الأهداب
Summary
يصف هذا البروتوكول جمع الخلايا الظهارية الأنفية وتوسيعها وتمايزها إلى نماذج الخلايا الظهارية لمجرى الهواء العضوي والقياس الكمي لتردد ضربات الأهداب عبر تصوير الخلايا الحية والبرامج النصية المصممة خصيصا.
Abstract
تم إنشاء قياسات وظيفة الأهداب (تردد النبض ، النمط) كأدوات تشخيصية لأمراض الجهاز التنفسي مثل خلل الحركة الهدبي الأولي. ومع ذلك ، فإن التطبيق الأوسع لهذه التقنيات محدود بسبب القابلية الشديدة للوظيفة الهدبية للتغيرات في العوامل البيئية مثل درجة الحرارة والرطوبة ودرجة الحموضة. في مجرى الهواء للمرضى الذين يعانون من التليف الكيسي (CF) ، يعيق تراكم المخاط ضرب الأهداب. تم التحقيق في وظيفة الأهداب في نماذج خلايا مجرى الهواء الأولية كمؤشر لنشاط قناة منظم التوصيل عبر الغشاء CF (CFTR). ومع ذلك ، فقد تم العثور على تباين كبير من مريض إلى آخر في تواتر ضرب الأهداب استجابة للأدوية المعدلة CFTR ، حتى بالنسبة للمرضى الذين يعانون من نفس طفرات CFTR . علاوة على ذلك ، فإن تأثير إفراز الكلوريد المختل وظيفيا الذي ينظمه CFTR على الوظيفة الهدبية غير مفهوم بشكل جيد. لا يوجد حاليا بروتوكول شامل يوضح تحضير عينة من نماذج مجرى الهواء في المختبر ، والحصول على الصور ، وتحليل تردد ضربات الأهداب (CBF). ومن شأن ظروف الاستزراع الموحدة والحصول على الصور التي يتم إجراؤها في حالة خاضعة للرقابة البيئية أن تمكن من إجراء تقدير كمي متسق وقابل للتكرار ل CBF بين الأفراد واستجابة للعقاقير المعدلة CFTR. يصف هذا البروتوكول القياس الكمي ل CBF في ثلاثة أنظمة مختلفة لنماذج الخلايا الظهارية في مجرى الهواء: 1) الصفائح الظهارية الأصلية ، 2) نماذج واجهة الهواء السائل المصورة على إدخالات دعم قابلة للاختراق ، و 3) عضويات ثلاثية الأبعاد مدمجة خارج الخلية. يتكاثر الأخيران في فسيولوجيا الرئة في الجسم الحي ، مع ضرب الأهداب وإنتاج المخاط. يتم التقاط الوظيفة الهدبية باستخدام كاميرا فيديو عالية السرعة في غرفة يتم التحكم فيها بالبيئة. يتم استخدام البرامج النصية المصممة خصيصا لتحليل CBF. من المتصور أن تكون ترجمة قياسات CBF إلى العيادة أداة سريرية مهمة للتنبؤ بالاستجابة للأدوية المعدلة CFTR على أساس كل مريض.
Introduction
تم إنشاء قياسات تردد ضربات الأهداب (CBF) ونمطها كأدوات تشخيصية لأمراض الجهاز التنفسي مثل خلل الحركة الهدبي الأولي (PCD)1. في التليف الكيسي (CF) ، يؤدي خلل في قناة كلوريد منظم التوصيل عبر الغشاء CF (CFTR) إلى جفاف سائل سطح مجرى الهواء وضعف إزالة الغشاء المخاطيالهدبي 2. تم التحقيق في الوظيفة الهدبية في المختبر في نماذج خلايا مجرى الهواء الأولية كمؤشر لنشاط قناة CFTR3. ومع ذلك ، يوجد تباين كبير من مريض إلى آخر في CBF استجابة للأدوية المعدلة CFTR ، حتى بالنسبة للمرضى الذين يعانون من نفس طفرات CFTR 3. علاوة على ذلك ، فإن تأثير إفراز الكلوريد المختل وظيفيا الذي ينظمه CFTR على الوظيفة الهدبية غير مفهوم بشكل جيد. لا يوجد حاليا بروتوكول شامل يوضح تحضير عينة من نماذج مجرى الهواء في المختبر ، والحصول على الصور ، وتحليل CBF.
تستخدم الأوراق الظهارية الأنفية المعزولة من فرش الغشاء المخاطي للأنف مباشرة لقياس الوظيفة الهدبية لتشخيص PCD4. ومع ذلك ، في حين لا توجد سيطرة على حجم أو جودة الأوراق الظهارية الأنفية التي تم الحصول عليها ، يختلف CBF اعتمادا على ما إذا كان يتم قياسه على خلايا مفردة أو صفائح خلية وعلى حواف مهدبة للصفائح الظهارية التي تعطلت أو لم تتعطل5. على هذا النحو ، قد يؤثر خلل الحركة الثانوي الناجم عن تلف الخلايا أثناء جمع تنظيف الغشاء المخاطي للأنف على CBF. تؤدي زراعة الخلايا الأولية للخلايا الظهارية الأنفية وتمايزها في واجهة الهواء السائل (ALI) أو في مصفوفة الغشاء القاعدي ثلاثي الأبعاد إلى عضويات ظهارية مجرى الهواء الهدبية إلى ظهور أهداب خالية من خلل الحركة الثانوي4،6،7،8. تم اعتبار الخلايا الظهارية في مجرى الهواء المتمايزة في ALI (من الآن فصاعدا تسمى نماذج ALI) مساعدة تشخيصية ثانوية مهمة تكرر أنماط النبض الهدبية وتكرار تنظيف الغشاء المخاطي للأنف خارج الجسم الحي 6 وتمكن من تحليل البنية الفائقة الهدبية ونمط النبض وتردد النبض مع الاحتفاظ بالعيوب الخاصة بالمريض9 . ومع ذلك ، توجد تناقضات في المنهجيات المستخدمة لإنشاء نماذج الخلايا المتمايزة المخاطية الكاذبة الهدبية. يمكن أن تؤدي بروتوكولات التوسع أو التمايز المختلفة للثقافة إلى أنماط ظاهرية ظهارية متميزة (مهدبة أو إفرازية)10 وتؤدي إلى اختلافات كبيرة في CBF11. تم قياس CBF في الفرشاة الظهارية الأنفية 4،6،12،13،14،15،16 ، والمواد العضوية الظهارية في مجرى الهواء 14،17،18 ونماذج ALI3،4،6،13،19،20 ، 21. ومع ذلك ، من بين هذه البروتوكولات ، هناك اختلافات كبيرة ، وغالبا ما لا يتم التحكم في العديد من المعلمات. على سبيل المثال ، في بعض الدراسات ، يتم تصوير CBF في الموقع بينما تظل خلايا نموذج ALI على ملحق الدعم القابل للاختراق3،19،20،21 ، بينما يقوم البعض الآخر بكشط الخلايا من إدراج الدعم القابل للاختراق وتصويرها معلقة في الوسائط4،6،13.
علاوة على ذلك ، فإن التطبيق الأوسع للتقنيات التي تقيس الوظيفة الهدبية محدود بسبب القابلية الشديدة للوظيفة الهدبية للتغيرات في العوامل البيئية. تؤثر العوامل البيئية مثل درجة الحرارة22 والرطوبة 23,24 ودرجة الحموضة 25,26 على الوظيفة الهدبية ويجب تنظيمها لتحديد CBF بدقة. تمت مراجعة المعلمات الفسيولوجية المختلفة المستخدمة في المختبرات المختلفة وكيفية تأثيرها على CBF سابقا27.
تم الإبلاغ عن تقنيات ونهج التصوير المختلفة لقياسات CBF في الأدبيات. لتشخيص PCD ، يتم استخدام الفحص المجهري بالفيديو لقياس الوظيفة الهدبية28,29. في الآونة الأخيرة ، تم استخدام خوارزمية تحليل الفيديو القائمة على الفحص المجهري الديناميكي التفاضلي لتحديد كل من تنسيق CBF والأهداب في نماذج ALI للخلايا الظهارية في مجرى الهواء 3,30. تتيح هذه الطريقة توصيف الضرب الهدبي في الخلايا الظهارية في مجرى الهواء بطريقة سريعة ومؤتمتة بالكامل ، دون الحاجة إلى تقسيم أو تحديد المناطق. قد تضيف طرق مختلفة لتصوير وقياس CBF إلى الاختلافات المبلغ عنها في CBF في الأدبيات (الملف التكميلي 1).
ومن شأن بروتوكول من الاستزراع إلى القياس الكمي لتبسيط الأساليب القائمة، وتوحيد ظروف الاستزراع، والحصول على الصور، الذي يتم في ظروف صارمة خاضعة للرقابة البيئية، أن يمكن من إجراء تقدير كمي متسق وقابل للتكرار لنموذج بناء القدرات داخل الأفراد وفيما بينهم.
يوفر هذا البروتوكول وصفا كاملا لمجموعة الخلايا الظهارية ، وظروف ثقافة التمدد والتمايز ، والقياس الكمي ل CBF في ثلاثة أنظمة مختلفة لنموذج الخلايا الظهارية في مجرى الهواء من أصل أنفي: 1) صفائح ظهارية أصلية ، 2) نماذج ALI مصورة على إدخالات دعم قابلة للاختراق و 3) عضويات ثلاثية الأبعاد مدمجة خارج الخلية (ECM) (الشكل 1 ). تستخدم الخلايا الظهارية الأنفية التي تم الحصول عليها من فرش القرينات الأنفية السفلية كممثلين لظهارة مجرى الهواء لأنها بديل فعال للخلايا الظهارية القصبية31 أثناء التغلب على الإجراء الغازي المرتبط بجمع فرش الشعب الهوائية. تستخدم طريقة خلية إعادة البرمجة الشرطية (CRC) لتوسيع الخلايا الظهارية الأولية لمجرى الهواء لإنشاء نماذج ALI والمواد العضوية ثلاثية الأبعاد. تحدث إعادة البرمجة الشرطية للخلايا الظهارية في مجرى الهواء إلى حالة تشبه الخلايا الجذعية عن طريق الزراعة المشتركة مع نظام الخلايا المغذية للخلايا الليفية المحتجزة للنمو ومثبط كيناز (ROCK) المرتبط ب Rho32. الأهم من ذلك ، أن طريقة CRC تزيد من تضاعف عدد السكان في الخلايا الظهارية في مجرى الهواء مع الاحتفاظ بإمكانية التمايز الخاصة بالأنسجة33,34. في جميع نماذج الخلايا الظهارية في مجرى الهواء ، يتم التقاط الوظيفة الهدبية في غرفة يتم التحكم في درجة حرارتها باستخدام كاميرا فيديو عالية السرعة مع إعدادات موحدة للحصول على الصور. يتم استخدام البرامج النصية المصممة خصيصا للقياس الكمي ل CBF.
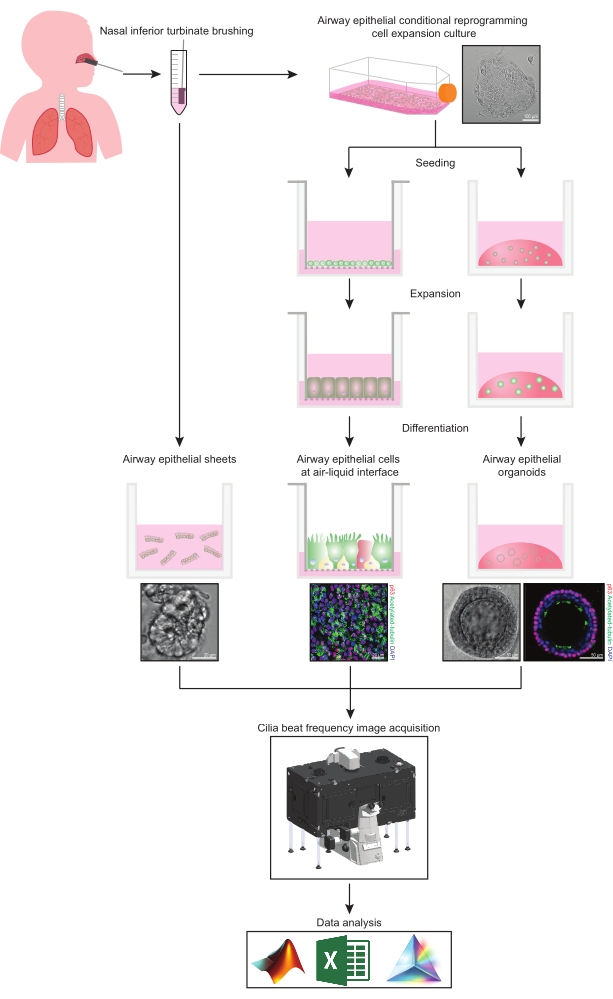
الشكل 1: رسم تخطيطي لسير العمل. بعد تنظيف القرينات الأنفية السفلية للمشاركين ، يتم استخدام الخلايا الظهارية في مجرى الهواء بإحدى طريقتين. إما أن يتم عزل الصفائح الظهارية في مجرى الهواء ، ويتم تصوير تردد نبض الأهداب على الفور ، أو يتم توسيع الخلايا الظهارية في مجرى الهواء عبر طريقة خلية إعادة البرمجة الشرطية. يتم تمييز الخلايا الظهارية لمجرى الهواء الموسع CRC لإنشاء خلايا ظهارية في مجرى الهواء في واجهة الهواء السائل أو الثقافات العضوية الظهارية في مجرى الهواء. يتم الحصول على تصوير تردد النبض الهدبي باستخدام مجهر تصوير الخلايا الحية مع غرفة بيئية للتدفئة والرطوبة وكاميرا علمية بمعدل إطارات سريع (>100 هرتز). يتم إجراء تحليل البيانات باستخدام البرامج النصية المصممة خصيصا. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
Representative Results
Discussion
هناك العديد من العوامل التي يمكن أن تحجب القياس الكمي ل CBF في الأوراق الظهارية الأنفية. يجب تصوير الأوراق الظهارية في غضون 3-9 ساعات من جمع العينات لأن الوظيفة الهدبية تكون أكثر استقرارا خلال هذا الوقت37. تعد خلايا الدم الحمراء والحطام الأقل مثالية للتصوير لأنها تتداخل مع الحصو?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
نشكر المشاركين في الدراسة وعائلاتهم على مساهماتهم. نحن نقدر المساعدة المقدمة من قسم الجهاز التنفسي في راندويك في مستشفيات سيدني للأطفال (SCH) في تنظيم وجمع العينات الحيوية للمرضى – شكر خاص للدكتور جون ويدجر والدكتورة إيفون بيليسيس وليان بلاش وأماندا طومسون وروندا بيل. نعترف بمساعدة إيفيتا سلابيتوفا ورينيه وان من مرفق كاثرينا غاوس للفحص المجهري الضوئي داخل مركز مارك وينرايت التحليلي في جامعة نيو ساوث ويلز في سيدني. يتم دعم هذا العمل من قبل المجلس الوطني للصحة والبحوث الطبية (NHMRC) أستراليا (GNT1188987) ، ومؤسسة CF أستراليا ، ومؤسسة مستشفى سيدني للأطفال. يود المؤلفون أن يعربوا عن تقديرهم لتحالف Luminesce – الابتكار من أجل صحة الأطفال لمساهمته ودعمه. Luminesce Alliance – Innovation for Children’s Health هو مشروع تعاوني مشترك غير هادف للربح بين شبكة مستشفيات الأطفال في سيدني ومعهد البحوث الطبية للأطفال ومعهد سرطان الأطفال. تم تأسيسها بدعم من حكومة نيو ساوث ويلز لتنسيق ودمج أبحاث طب الأطفال. ينتمي Luminesce Alliance أيضا إلى جامعة سيدني وجامعة نيو ساوث ويلز سيدني. يتم دعم KMA من خلال منحة برنامج التدريب البحثي للحكومة الأسترالية. يتم دعم LKF من قبل نادي الروتاري في سيدني كوف / مؤسسة مستشفى سيدني للأطفال ومنح جامعة نيو ساوث ويلز للدراسات العليا.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

