Indsamling, udvidelse og differentiering af primære humane nasale epitelcellemodeller til kvantificering af cilia beatfrekvens
Summary
Denne protokol beskriver nasal epitelcelleindsamling, ekspansion og differentiering til organotypiske luftvejsepitelcellemodeller og kvantificering af cilia-beatfrekvens via levende cellebilleddannelse og specialbyggede scripts.
Abstract
Målinger af ciliafunktion (slagfrekvens, mønster) er blevet etableret som diagnostiske værktøjer til luftvejssygdomme såsom primær ciliær dyskinesi. Den bredere anvendelse af disse teknikker er imidlertid begrænset af den ekstreme modtagelighed af ciliær funktion for ændringer i miljøfaktorer, f.eks. temperatur, fugtighed og pH. I luftvejene hos patienter med cystisk fibrose (CF) forhindrer slimophobning ciliaslag. Cilian-funktion er blevet undersøgt i primære luftvejscellemodeller som en indikator for CF Transmembrane Conductance Regulator (CFTR) kanalaktivitet. Imidlertid er der fundet betydelig patient-til-patient-variation i cilia-slagfrekvens som reaktion på CFTR-modulerende lægemidler, selv for patienter med de samme CFTR-mutationer . Desuden er virkningen af dysfunktionel CFTR-reguleret chloridsekretion på ciliær funktion dårligt forstået. Der er i øjeblikket ingen omfattende protokol, der demonstrerer prøveforberedelse af in vitro luftvejsmodeller, billedoptagelse og analyse af Cilia Beat Frequency (CBF). Standardiserede kulturforhold og billedoptagelse udført i en miljøkontrolleret tilstand ville muliggøre konsekvent, reproducerbar kvantificering af CBF mellem individer og som reaktion på CFTR-modulerende lægemidler. Denne protokol beskriver kvantificeringen af CBF i tre forskellige luftvejsepitelcellemodelsystemer: 1) native epitelark, 2) luft-væske-grænseflademodeller afbildet på permeable støtteindsatser og 3) ekstracellulære matrixindlejrede tredimensionelle organoider. De to sidstnævnte replikerer in vivo lungefysiologi, med slå cilia og produktion af slim. Ciliary-funktionen optages ved hjælp af et højhastighedsvideokamera i et miljøstyret kammer. Specialbyggede scripts bruges til analyse af CBF. Oversættelse af CBF-målinger til klinikken er tænkt som et vigtigt klinisk værktøj til at forudsige respons på CFTR-modulerende lægemidler pr. patient.
Introduction
Målinger af Cilia Beat Frequency (CBF) og mønster er blevet etableret som diagnostiske værktøjer til luftvejssygdomme såsom Primary Ciliary Dyskinesia (PCD)1. I cystisk fibrose (CF) forårsager dysfunktion af CF Transmembrane konduktansregulatoren (CFTR) chloridkanal dehydrering af luftvejsoverfladevæsken og nedsat mucociliær clearance2. Ciliaryfunktion er blevet undersøgt in vitro i primære luftvejscellemodeller som en indikator for CFTR-kanalaktivitet3. Der er imidlertid betydelig variation mellem patienter i CBF som reaktion på CFTR-modulerende lægemidler, selv for patienter med de samme CFTR-mutationer 3. Desuden er virkningen af dysfunktionel CFTR-reguleret chloridsekretion på ciliær funktion dårligt forstået. Der findes i øjeblikket ingen omfattende protokol, der viser prøveforberedelse af in vitro-luftvejsmodeller , billedoptagelse og analyse af CBF.
Næseepitelplader isoleret fra næseslimhindebørstninger anvendes direkte til målinger af ciliær funktion til PCD-diagnose4. Men selvom der ikke er nogen kontrol over størrelsen eller kvaliteten af de opnåede næseepitelark, varierer CBF afhængigt af, om det måles på enkeltceller eller celleark og på epitelark cilierede kanter, der er forstyrret eller uforstyrret5. Som sådan kan sekundære dyskinesier forårsaget af skader på celler under indsamling af næseslimhindebørstninger påvirke CBF. Primær cellekultur af nasale epitelceller og deres differentiering ved Air-Liquid Interface (ALI) eller i tredimensionel kældermembranmatrix i cilierede luftvejsepitelorganoider giver anledning til cilier, der er fri for sekundære dyskinesier 4,6,7,8. Luftvejsepitelceller differentieret ved ALI (fremover kaldet ALI-modeller) er blevet betragtet som et vigtigt sekundært diagnostisk hjælpemiddel, der replikerer ciliary beat-mønstre og hyppighed af ex vivo nasal slimhindebørstning6 og muliggør analyse af ciliær ultrastruktur, taktmønster og slagfrekvens, samtidig med at patientspecifikke defekter bevares9 . Alligevel findes der uoverensstemmelser i de metoder, der bruges til at skabe disse pseudostratificerede, mucociliære differentierede cellemodeller. Forskellige kulturudvidelses- eller differentieringsprotokoller kan inducere forskellige epitelfænotyper (cilierede eller sekretoriske)10 og resultere i signifikante forskelle i CBF11. CBF er blevet kvantificeret i næseepitelbørster 4,6,12,13,14,15,16, luftvejsepitelorganoider 14,17,18 og ALI modeller 3,4,6,13,19,20, 21. Men blandt disse protokoller er der store variationer, og ofte er der mange parametre, der ikke kontrolleres for. For eksempel er CBF i nogle undersøgelser afbildet in situ, mens cellerne i ALI-modellen forbliver på den permeable støtteindsats 3,19,20,21, mens andre skraber cellerne fra den permeable støtteindsats og afbilder dem suspenderet i medier 4,6,13.
Desuden er den bredere anvendelse af teknikker, der måler ciliær funktion, begrænset af ciliaryfunktionens ekstreme modtagelighed for ændringer i miljøfaktorer. Miljøfaktorer som temperatur22, fugtighed 23,24 og pH 25,26 påvirker ciliaryfunktionen og skal reguleres for at kvantificere CBF nøjagtigt. De forskellige fysiologiske parametre, der anvendes på tværs af forskellige laboratorier, og hvordan de påvirker CBF, er blevet gennemgået tidligere27.
Forskellige billeddannelsesteknologier og tilgange til CBF-målinger er rapporteret i litteraturen. Til PCD-diagnostik bruges videomikroskopi til at måle ciliær funktion28,29. For nylig blev en videoanalysealgoritme baseret på differentiel dynamisk mikroskopi brugt til at kvantificere både CBF- og cilia-koordinering i luftvejsepitelcelle ALI-modeller 3,30. Denne metode muliggør karakterisering af ciliary beating i luftvejsepitelceller på en hurtig og fuldautomatisk måde uden behov for at segmentere eller vælge regioner. Forskellige metoder til billeddannelse og kvantificering af CBF kan øge de forskelle, der er rapporteret i CBF i litteraturen (supplerende fil 1).
En protokol fra kultur til kvantificering for at strømline eksisterende metoder, standardisering af kulturforhold og billedoptagelse, udført under strenge miljøkontrollerede forhold, ville muliggøre konsekvent, reproducerbar kvantificering af CBF inden for og mellem individer.
Denne protokol giver en komplet beskrivelse af samlingen af epitelceller, ekspansions- og differentieringskulturbetingelser og kvantificering af CBF i tre forskellige luftvejsepitelcellemodelsystemer af nasal oprindelse: 1) native epitelark, 2) ALI-modeller afbildet på permeable støtteindsatser og 3) Extracellular Matrix (ECM) -indlejrede tredimensionelle organoider (figur 1 ). Nasale epitelceller opnået fra nasal inferior turbinat børstninger anvendes som repræsentanter for luftvejsepitellet, da de er en effektiv surrogat for bronchiale epitelceller31, mens de overvinder den invasive procedure forbundet med indsamling af bronchiale børstninger. CRC-metoden (Conditional Reprogramming Cell) bruges til at udvide primære luftvejsepitelceller til oprettelse af ALI-modeller og tredimensionelle organoider. Betinget omprogrammering af luftvejsepitelceller til en stamcellelignende tilstand induceres ved samkultur med væksthæmmet fibroblastfødecellesystem og Rho-associeret kinase (ROCK) hæmmer32. Det er vigtigt, at CRC-metoden øger populationsfordoblingen i luftvejsepitelceller, samtidig med at deres vævsspecifikke differentieringspotentiale bevares33,34. I alle luftvejsepitelcellemodeller fanges ciliaryfunktionen i et temperaturstyret kammer ved hjælp af et højhastighedsvideokamera med standardiserede billedoptagelsesindstillinger. Specialbyggede scripts anvendes til kvantificering af CBF.
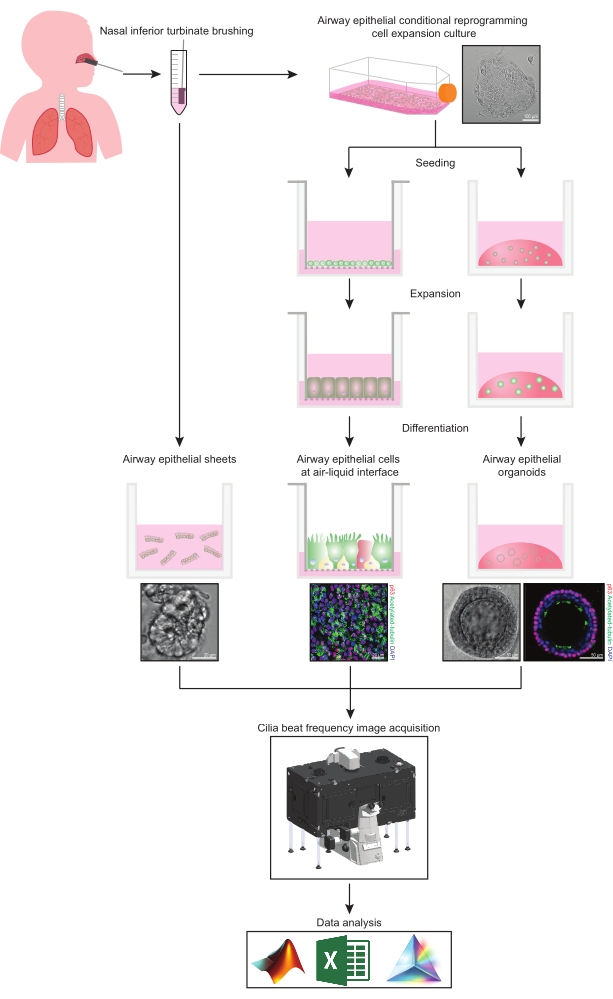
Figur 1: Skematisk for arbejdsgang. Efter børstning af deltagernes nasale ringere turbinat, anvendes luftvejsepitelceller på en af to måder. Enten isoleres luftvejsepitelark, og cilia-beatfrekvensen afbildes straks, eller luftvejsepitelceller udvides via den betingede omprogrammeringscellemetode. CRC-ekspanderede luftvejsepitelceller differentieres for at etablere luftvejsepitelceller ved en luft-væske-grænseflade eller luftvejsepitelorganoidkulturer. Billeddannelse af ciliary beatfrekvens erhverves ved hjælp af et levende cellebilledmikroskop med et opvarmnings- og fugtighedsmiljøkammer og et videnskabeligt kamera med hurtig billedhastighed (>100Hz). Dataanalyse udføres ved hjælp af specialbyggede scripts. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Der er flere faktorer, der kan skjule kvantificeringen af CBF i næseepitelark. Epitelark skal afbildes inden for 3-9 timer efter prøveindsamling, da ciliaryfunktionen er mest stabil i løbet af denne tid37. Mindre røde blodlegemer og snavs er mest optimale til billeddannelse, da disse forstyrrer dataindsamlingen. Når du vælger et investeringsafkast til billeddannelse, er det vigtigt at vælge et epitelark, der ikke er blevet beskadiget eller forstyrret under indsamlingen af prøven, og ikke e…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi takker undersøgelsesdeltagerne og deres familier for deres bidrag. Vi sætter pris på hjælpen fra Sydney Children’s Hospitals (SCH) Randwick respiratoriske afdeling i organisationen og indsamlingen af patientbiospecimens – særlig tak til Dr. John Widger, Dr. Yvonne Belessis, Leanne Plush, Amanda Thompson og Rhonda Bell. Vi anerkender hjælpen fra Iveta Slapetova og Renee Whan fra Katharina Gaus Light Microscopy Facility inden for Mark Wainwright Analytical Center ved UNSW Sydney. Dette arbejde støttes af National Health and Medical Research Council (NHMRC) Australia (GNT1188987), CF Foundation Australia og Sydney Children’s Hospital Foundation. Forfatterne vil gerne anerkende Luminesce Alliance – Innovation for Children’s Health for dets bidrag og støtte. Luminesce Alliance – Innovation for Children’s Health er et non-profit kooperativt joint venture mellem Sydney Children’s Hospitals Network, Children’s Medical Research Institute og Children’s Cancer Institute. Det er blevet oprettet med støtte fra NSW-regeringen for at koordinere og integrere pædiatrisk forskning. Luminesce Alliance er også tilknyttet University of Sydney og University of New South Wales Sydney. KMA støttes af et australsk regerings forskningsuddannelsesprogramstipendium. LKF er støttet af Rotary Club of Sydney Cove / Sydney Children’s Hospital Foundation og UNSW University postgraduate award stipendier.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

