Verzameling, uitbreiding en differentiatie van primaire menselijke nasale epitheelcelmodellen voor kwantificering van Cilia Beat Frequency
Summary
Dit protocol beschrijft nasale epitheelcelverzameling, uitbreiding en differentiatie naar organotypische luchtwegepitheelcelmodellen en kwantificering van de trilharenslagfrequentie via live-cell imaging en op maat gemaakte scripts.
Abstract
Metingen van de trilhaarfunctie (slagfrequentie, patroon) zijn vastgesteld als diagnostische hulpmiddelen voor aandoeningen van de luchtwegen, zoals primaire ciliaire dyskinesie. De bredere toepassing van deze technieken wordt echter beperkt door de extreme gevoeligheid van de ciliaire functie voor veranderingen in omgevingsfactoren, zoals temperatuur, vochtigheid en pH. In de luchtwegen van patiënten met Cystic Fibrosis (CF) belemmert slijmaccumulatie het kloppen van trilharen. De Cilia-functie is onderzocht in primaire luchtwegcelmodellen als een indicator van CF Transmembrane conductance Regulator (CFTR) kanaalactiviteit. Er is echter een aanzienlijke variabiliteit van patiënt tot patiënt in de frequentie van trilharen gevonden als reactie op CFTR-modulerende geneesmiddelen, zelfs voor patiënten met dezelfde CFTR-mutaties . Bovendien is de impact van disfunctionele CFTR-gereguleerde chloridesecretie op de ciliaire functie slecht begrepen. Er is momenteel geen uitgebreid protocol dat de monstervoorbereiding van in vitro luchtwegmodellen, beeldacquisitie en analyse van Cilia Beat Frequency (CBF) demonstreert. Gestandaardiseerde kweekomstandigheden en beeldacquisitie uitgevoerd in een milieugecontroleerde toestand zouden een consistente, reproduceerbare kwantificering van CBF tussen individuen en in reactie op CFTR-modulerende geneesmiddelen mogelijk maken. Dit protocol beschrijft de kwantificering van CBF in drie verschillende luchtwegepitheelcelmodelsystemen: 1) native epithelial sheets, 2) lucht-vloeistof interfacemodellen afgebeeld op permeabele steuninzetstukken, en 3) extracellulaire matrix-ingebedde driedimensionale organoïden. De laatste twee repliceren in vivo longfysiologie, met kloppende trilharen en productie van slijm. De ciliaire functie wordt vastgelegd met behulp van een hogesnelheidsvideocamera in een omgevingsgestuurde kamer. Voor de analyse van CBF worden op maat gemaakte scripts gebruikt. Vertaling van CBF-metingen naar de kliniek is bedoeld als een belangrijk klinisch hulpmiddel voor het voorspellen van de respons op CFTR-modulerende geneesmiddelen per patiënt.
Introduction
Metingen van Cilia Beat Frequency (CBF) en patroon zijn vastgesteld als diagnostische hulpmiddelen voor respiratoire aandoeningen zoals primaire ciliaire dyskinesie (PCD)1. Bij Cystic Fibrosis (CF) veroorzaakt disfunctie van het CF Transmembraangeleidingsregulator (CFTR) chloridekanaal uitdroging van de luchtwegoppervlakvloeistof en verminderde mucociliaire klaring2. De ciliaire functie is in vitro onderzocht in primaire luchtwegcelmodellen als indicator voor CFTR-kanaalactiviteit3. Er bestaat echter een aanzienlijke variabiliteit van patiënt tot patiënt in CBF als reactie op CFTR-modulerende geneesmiddelen, zelfs voor patiënten met dezelfde CFTR-mutaties 3. Bovendien is de impact van disfunctionele CFTR-gereguleerde chloridesecretie op de ciliaire functie slecht begrepen. Er is momenteel geen uitgebreid protocol dat de monstervoorbereiding van in vitro luchtwegmodellen, beeldacquisitie en analyse van CBF aantoont.
Nasale epitheliale platen geïsoleerd van nasale mucosale borstelingen worden direct gebruikt voor metingen van de ciliaire functie voor PCD-diagnose4. Hoewel er geen controle is over de grootte of kwaliteit van de verkregen nasale epitheliale vellen, varieert CBF afhankelijk van of het wordt gemeten op enkele cellen of celbladen en op epitheelplaat trilhaarranden die verstoord of ongestoord zijn5. Als zodanig kan secundaire dyskinesieën veroorzaakt door schade aan cellen tijdens het verzamelen van neusslijmvliesborstels CBF beïnvloeden. Primaire celkweek van nasale epitheelcellen en hun differentiatie bij Air-Liquid Interface (ALI) of in driedimensionale keldermembraanmatrix in trilhaarepepitheelorganoïden geven aanleiding tot trilhaartjes die vrij zijn van secundaire dyskinesieën 4,6,7,8. Luchtwegepitheelcellen gedifferentieerd bij ALI (voortaan ALI-modellen genoemd) worden beschouwd als een belangrijk secundair diagnostisch hulpmiddel dat de ciliaire slagpatronen en frequentie van ex vivo neusslijmvliesborstelsrepliceert 6 en analyse van ciliaire ultrastructuur, beatpatroon en slagfrequentie mogelijk maakt met behoud van patiëntspecifieke defecten9 . Toch bestaan er discrepanties in de methodologieën die worden gebruikt om deze pseudostratified, mucociliair gedifferentieerde celmodellen te maken. Verschillende kweekuitbreidings- of differentiatieprotocollen kunnen verschillende epitheliale fenotypen (trilhaar of secretoir)10 induceren en resulteren in significante verschillen in CBF11. CBF is gekwantificeerd in nasale epitheliale borstels 4,6,12,13,14,15,16, luchtwegepitheel organoïden 14,17,18 en ALI modellen 3,4,6,13,19,20, 21. Toch zijn er onder deze protocollen grote variabiliteiten en vaak worden veel parameters niet gecontroleerd. In sommige studies wordt CBF bijvoorbeeld in situ afgebeeld terwijl de cellen van het ALI-model op de permeabele steuninzet 3,19,20,21 blijven, terwijl anderen de cellen van de permeabele steuninzet schrapen en ze in media 4,6,13 ophangen.
Bovendien wordt de bredere toepassing van technieken die de ciliaire functie meten beperkt door de extreme gevoeligheid van de ciliaire functie voor veranderingen in omgevingsfactoren. Omgevingsfactoren zoals temperatuur22,vochtigheid 23,24 en pH25,26 beïnvloeden de ciliaire functie en moeten worden gereguleerd om CBF nauwkeurig te kwantificeren. De verschillende fysiologische parameters die in verschillende laboratoria worden gebruikt en hoe ze CBF beïnvloeden, zijn eerder beoordeeld27.
Verschillende beeldvormingstechnologieën en benaderingen van CBF-metingen worden gerapporteerd in de literatuur. Voor PCD-diagnostiek wordt videomicroscopie gebruikt om ciliaire functie28,29 te meten. Onlangs werd een video-analysealgoritme op basis van differentiële dynamische microscopie gebruikt om zowel CBF- als cilia-coördinatie in luchtwegepitheelcel ALI-modellen 3,30 te kwantificeren. Deze methode maakt de karakterisering van ciliaire kloppen in luchtwegepitheelcellen op een snelle en volledig geautomatiseerde manier mogelijk, zonder de noodzaak om regio’s te segmenteren of te selecteren. Verschillende methoden voor beeldvorming en kwantificering van CBF kunnen bijdragen aan de verschillen die in cbf in de literatuur worden gerapporteerd (aanvullend dossier 1).
Een protocol van cultuur tot kwantificering om bestaande methoden, standaardisatie van cultuuromstandigheden en beeldacquisitie te stroomlijnen, uitgevoerd in strikte milieugecontroleerde omstandigheden, zou een consistente, reproduceerbare kwantificering van CBF binnen en tussen individuen mogelijk maken.
Dit protocol biedt een volledige beschrijving van de verzameling epitheelcellen, expansie- en differentiatiecultuuromstandigheden en kwantificering van CBF in drie verschillende luchtwegepitheelcelmodelsystemen van nasale oorsprong: 1) inheemse epitheelbladen, 2) ALI-modellen afgebeeld op permeabele steuninzetstukken en 3) Extracellulaire Matrix (ECM)-ingebedde driedimensionale organoïden (figuur 1) ). Nasale epitheelcellen verkregen uit nasale inferieure turbinaatborstels worden gebruikt als vertegenwoordigers van het luchtwegepitheel, omdat ze een effectief surrogaat zijn voor bronchiale epitheelcellen31 terwijl ze de invasieve procedure overwinnen die gepaard gaat met het verzamelen van bronchiale borstels. De Conditional Reprogramming Cell (CRC) methode wordt gebruikt om primaire luchtwegepitheelcellen uit te breiden voor het maken van ALI-modellen en driedimensionale organoïden. Voorwaardelijke herprogrammering van luchtwegepitheelcellen tot een stamcelachtige toestand wordt geïnduceerd door cocultuur met groei-gestopt fibroblast feedercelsysteem en Rho-associated kinase (ROCK) -remmer32. Belangrijk is dat de CRC-methode de bevolking verdubbelt in luchtwegepitheelcellen met behoud van hun weefselspecifieke differentiatiepotentieel33,34. In alle luchtwegepitheelcelmodellen wordt de ciliaire functie vastgelegd in een temperatuurgecontroleerde kamer met behulp van een hogesnelheidsvideocamera met gestandaardiseerde beeldacquisitie-instellingen. Op maat gemaakte scripts worden gebruikt voor de kwantificering van CBF.
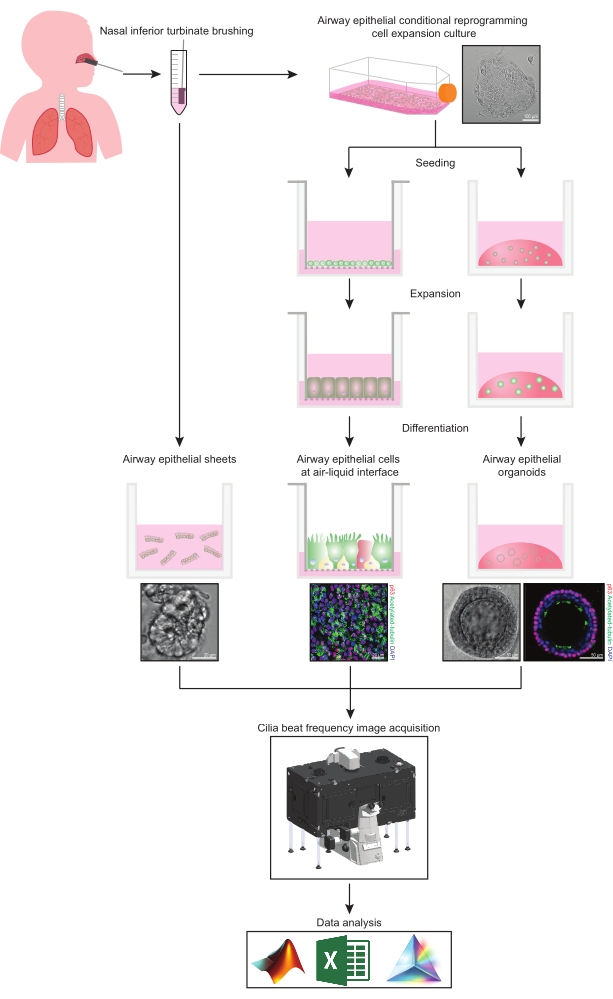
Figuur 1: Schema van de workflow. Na het borstelen van het nasale inferieure turbinaat van de deelnemers, worden luchtwegepitheelcellen op twee manieren gebruikt. Ofwel worden luchtwegepitheelbladen geïsoleerd en de trilhaartjes worden onmiddellijk in beeld gebracht, ofwel worden luchtwegepitheelcellen uitgebreid via de voorwaardelijke herprogrammeringscelmethode. CRC-geëxpandeerde luchtwegepitheelcellen worden gedifferentieerd om luchtwegepitheelcellen vast te stellen op een lucht-vloeistof interface of luchtepitheel organoïde culturen. Beeldvorming van de ciliaire beatfrequentie wordt verkregen met behulp van een live-cell imaging microscoop met een verwarmings- en vochtigheidsomgevingskamer en een wetenschappelijke camera met snelle framesnelheid (>100Hz). Gegevensanalyse wordt uitgevoerd met behulp van op maat gemaakte scripts. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Er zijn meerdere factoren die de kwantificering van CBF in nasale epitheliale vellen kunnen verdoezelen. Epitheliale vellen moeten binnen 3-9 uur na het verzamelen van monsters worden afgebeeld, omdat de ciliaire functie gedurende deze tijd het meest stabiel is37. Minder rode bloedcellen en puin zijn het meest optimaal voor beeldvorming, omdat deze interfereren met data-acquisitie. Bij het selecteren van een ROI voor beeldvorming is het belangrijk om een epithelial sheet te selecteren waarvan is a…
Divulgations
The authors have nothing to disclose.
Acknowledgements
We bedanken de deelnemers aan het onderzoek en hun families voor hun bijdragen. We waarderen de hulp van sydney children’s hospitals (SCH) Randwick respiratoire afdeling bij de organisatie en verzameling van patiënt biospecimens – speciale dank aan Dr. John Widger, Dr. Yvonne Belessis, Leanne Plush, Amanda Thompson en Rhonda Bell. We erkennen de hulp van Iveta Slapetova en Renee Whan van de Katharina Gaus Light Microscopy Facility binnen het Mark Wainwright Analytical Centre in UNSW Sydney. Dit werk wordt ondersteund door de National Health and Medical Research Council (NHMRC) Australia (GNT1188987), CF Foundation Australia en Sydney Children’s Hospital Foundation. De auteurs willen Luminesce Alliance – Innovation for Children’s Health bedanken voor haar bijdrage en ondersteuning. Luminesce Alliance – Innovation for Children’s Health is een non-profit samenwerkingsverbanden tussen het Sydney Children’s Hospitals Network, het Children’s Medical Research Institute en het Children’s Cancer Institute. Het is opgericht met de steun van de NSW-regering om pediatrisch onderzoek te coördineren en te integreren. Luminesce Alliance is ook verbonden aan de Universiteit van Sydney en de Universiteit van New South Wales Sydney. KMA wordt ondersteund door een Australian Government Research Training Program Scholarship. LKF wordt ondersteund door de Rotary Club of Sydney Cove / Sydney Children’s Hospital Foundation en UNSW University postdoctorale beurzen.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

