Sammlung, Expansion und Differenzierung primärer humaner Nasensepithelzellmodelle zur Quantifizierung der Zilienschlagfrequenz
Summary
Dieses Protokoll beschreibt die Entnahme, Expansion und Differenzierung nasaler Epithelzellen zu organotypischen Atemwegsepithelzellmodellen und die Quantifizierung der Zilienschlagfrequenz mittels Live-Cell-Bildgebung und maßgeschneiderten Skripten.
Abstract
Messungen der Zilienfunktion (Schlagfrequenz, Muster) haben sich als diagnostische Instrumente für Atemwegserkrankungen wie primäre Ziliardyskinesie etabliert. Die breitere Anwendung dieser Techniken ist jedoch durch die extreme Anfälligkeit der Ziliarfunktion gegenüber Änderungen der Umweltfaktoren wie Temperatur, Feuchtigkeit und pH-Wert begrenzt. In den Atemwegen von Patienten mit Mukoviszidose (CF) behindert die Schleimansammlung das Schlagen von Zilien. Die Zilienfunktion wurde in primären Atemwegszellmodellen als Indikator für die Kanalaktivität des CF Transmembrane Conductance Regulator (CFTR) untersucht. Es wurde jedoch eine beträchtliche Variabilität der Zilienschlagfrequenz als Reaktion auf CFTR-modulierende Medikamente festgestellt, selbst bei Patienten mit den gleichen CFTR-Mutationen . Darüber hinaus ist der Einfluss einer dysfunktionalen CFTR-regulierten Chloridsekretion auf die Ziliarfunktion kaum verstanden. Derzeit gibt es kein umfassendes Protokoll, das die Probenvorbereitung von In-vitro-Atemwegsmodellen, die Bildaufnahme und die Analyse der Zilienschlagfrequenz (CBF) demonstriert. Standardisierte Kulturbedingungen und Bildaufnahmen, die unter einem umweltkontrollierten Zustand durchgeführt werden, würden eine konsistente, reproduzierbare Quantifizierung von CBF zwischen Individuen und als Reaktion auf CFTR-modulierende Medikamente ermöglichen. Dieses Protokoll beschreibt die Quantifizierung von CBF in drei verschiedenen Atemwegsepithelzellmodellsystemen: 1) native Epithelschichten, 2) Luft-Flüssigkeits-Grenzflächenmodelle, die auf permeablen Stützeinsätzen abgebildet sind, und 3) extrazelluläre, in Matrix eingebettete dreidimensionale Organoide. Die beiden letzteren replizieren in vivo die Lungenphysiologie, mit schlagenden Zilien und Schleimproduktion. Die Ziliarfunktion wird mit einer Hochgeschwindigkeits-Videokamera in einer umgebungskontrollierten Kammer erfasst. Für die Analyse von CBF werden benutzerdefinierte Skripte verwendet. Die Übertragung von CBF-Messungen in die Klinik soll ein wichtiges klinisches Instrument zur Vorhersage des Ansprechens auf CFTR-modulierende Medikamente pro Patient sein.
Introduction
Messungen der Zilienschlagfrequenz (CBF) und des Fasermusters haben sich als diagnostische Instrumente für Atemwegserkrankungen wie die primäre Ziliardyskinesie (PCD)1 etabliert. Bei Mukoviszidose (CF) führt eine Dysfunktion des CF-Transmembran-Leitfähigkeitsreglers (CFTR) zu einer Dehydratisierung der Atemwegsoberflächenflüssigkeit und einer gestörten mukoziliären Clearance2. Die Ziliarfunktion wurde in vitro in primären Atemwegszellmodellen als Indikator für die CFTR-Kanalaktivitätuntersucht 3. Allerdings besteht bei CBF eine beträchtliche Variabilität von Patient zu Patient als Reaktion auf CFTR-modulierende Medikamente, selbst bei Patienten mit den gleichen CFTR-Mutationen 3. Darüber hinaus ist der Einfluss einer dysfunktionalen CFTR-regulierten Chloridsekretion auf die Ziliarfunktion kaum verstanden. Derzeit gibt es kein umfassendes Protokoll, das die Probenvorbereitung von In-vitro-Atemwegsmodellen, die Bildaufnahme und die Analyse von CBF demonstriert.
Nasenepithelblätter, die aus Nasenschleimhautbürsten isoliert wurden, werden direkt für Messungen der Ziliarfunktion für die PKD-Diagnoseverwendet 4. Obwohl es keine Kontrolle über die Größe oder Qualität der erhaltenen Nasensepithelblätter gibt, variiert CBF je nachdem, ob es an einzelnen Zellen oder Zellblättern und an epithelialen Blattflanelländern gemessen wird, die gestört oder ungestört sind5. Daher können sekundäre Dyskinesien, die durch Zellschäden während der Entnahme von Nasenschleimhautbürsten verursacht werden, die CBF beeinflussen. Die primäre Zellkultur von Nasensepithelzellen und ihre Differenzierung an der Luft-Flüssigkeits-Grenzfläche (ALI) oder in dreidimensionaler Basalmembranmatrix in Flimmereitelepithelorganoide führen zu Zilien, die frei von sekundären Dyskinesiensind 4,6,7,8. Atemwegepithelzellen, die bei ALI differenziert wurden (im Folgenden als ALI-Modelle bezeichnet), gelten als wichtiges sekundäres diagnostisches Hilfsmittel, das die Ziliarschlagmuster und die Häufigkeit von Ex-vivo-Nasenschleimhautbürsten repliziert6 und die Analyse der Ziliarultrastruktur, des Schlagmusters und der Schlagfrequenz unter Beibehaltung patientenspezifischer Defekte ermöglicht 9 . Es gibt jedoch Diskrepanzen in den Methoden, die zur Erstellung dieser pseudogeschichteten, mukoziliären differenzierten Zellmodelle verwendet werden. Unterschiedliche Kulturexpansions- oder Differenzierungsprotokolle könnten unterschiedliche epitheliale Phänotypen (flimmerig oder sekretorisch)10 induzieren und zu signifikanten Unterschieden in CBF11 führen. CBF wurde quantifiziert in Nasepithelbürsten 4,6,12,13,14,15,16, Atemwegsepithelorganoiden 14,17,18 und ALI-Modellen 3,4,6,13,19,20, 21. Unter diesen Protokollen gibt es jedoch große Variabilitäten, und oft werden viele Parameter nicht kontrolliert. Zum Beispiel wird in einigen Studien CBF in situ abgebildet, während die Zellen des ALI-Modells auf dem durchlässigen Stützeinsatz 3,19,20,21 verbleiben, wieder andere kratzen die Zellen aus dem durchlässigen Stützeinsatz und bilden sie in den Medien 4,6,13 ab.
Darüber hinaus ist die breitere Anwendung von Techniken zur Messung der Ziliarfunktion durch die extreme Anfälligkeit der Ziliarfunktion gegenüber Veränderungen der Umweltfaktoren begrenzt. Umweltfaktoren wie Temperatur 22, Luftfeuchtigkeit23,24 und pH25,26 beeinflussen die Ziliarfunktion und müssen reguliert werden, um CBF genau zu quantifizieren. Die verschiedenen physiologischen Parameter, die in verschiedenen Laboratorien verwendet werden, und wie sie die CBF beeinflussen, wurden bereitsüberprüft 27.
Verschiedene Bildgebungstechnologien und Ansätze zur CBF-Messung werden in der Literatur beschrieben. Für die PCD-Diagnostik wird die Videomikroskopie zur Messung der Ziliarfunktion28,29 eingesetzt. Vor kurzem wurde ein Videoanalysealgorithmus, der auf differentieller dynamischer Mikroskopie basiert, verwendet, um sowohl die CBF- als auch die Zilienkoordination in den ALI-Modellen für Atemwegepithelzellenzu quantifizieren 3,30. Diese Methode ermöglicht die Charakterisierung von Ziliarschlägen in Atemwegsepithelzellen schnell und vollautomatisch, ohne dass Regionen segmentiert oder ausgewählt werden müssen. Verschiedene Methoden zur Bildgebung und Quantifizierung von CBF können zu den Unterschieden beitragen, die in der Literatur in CBF berichtet werden (Supplementary File 1).
Ein Protokoll von der Kultur bis zur Quantifizierung zur Rationalisierung bestehender Methoden, zur Standardisierung der Kulturbedingungen und zur Bildaufnahme, die unter streng umweltkontrollierten Bedingungen durchgeführt werden, würde eine konsistente, reproduzierbare Quantifizierung von CBF innerhalb und zwischen Individuen ermöglichen.
Dieses Protokoll bietet eine vollständige Beschreibung der Sammlung von Epithelzellen, der Expansions- und Differenzierungskulturbedingungen und der Quantifizierung von CBF in drei verschiedenen Atemwegepithelzellmodellsystemen nasalen Ursprungs: 1) native Epithelblätter, 2) ALI-Modelle, die auf permeablen Stützeinsätzen abgebildet wurden, und 3) extrazelluläre Matrix (ECM)-eingebettete dreidimensionale Organoide (Abbildung 1 ). Nasenepithelzellen, die aus Nasenbürsten der unteren Nasenmuscheln gewonnen werden, werden als Vertreter des Atemwegsepithels verwendet, da sie ein wirksamer Ersatz für Bronchialepithelzellen31 sind, während sie das invasive Verfahren überwinden, das mit dem Sammeln von Bronchialbürsten verbunden ist. Die Conditional Reprogramming Cell (CRC) Methode wird verwendet, um primäre Atemwegsepithelzellen für die Erstellung von ALI-Modellen und dreidimensionalen Organoiden zu erweitern. Die bedingte Reprogrammierung von Atemwegepithelzellen in einen stammzellähnlichen Zustand wird durch Kokultur mit wachstumshemmendem Fibroblasten-Feederzellsystem und Rho-assoziierter Kinase (ROCK)-Inhibitor32 induziert. Wichtig ist, dass die CRC-Methode die Verdopplung der Population in Atemwegepithelzellen erhöht und gleichzeitig ihr gewebespezifisches Differenzierungspotenzial beibehält33,34. In allen Epithelzellmodellen der Atemwege wird die Ziliarfunktion in einer temperaturgesteuerten Kammer mit einer Hochgeschwindigkeits-Videokamera mit standardisierten Bildaufnahmeeinstellungen erfasst. Für die Quantifizierung von CBF werden maßgeschneiderte Skripte verwendet.
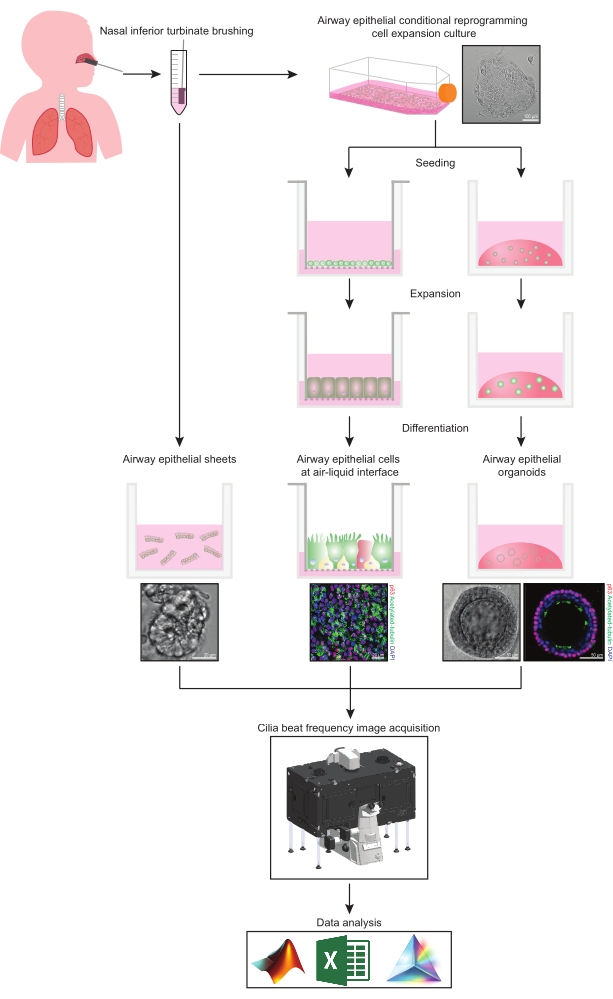
Abbildung 1: Schematische Darstellung des Workflows. Nach dem Bürsten des Nasenmuschels werden die Atemwegsepithelzellen auf zwei Arten verwendet. Entweder werden Atemwegsepithelschichten isoliert und die Zilienschlagfrequenz wird sofort abgebildet, oder Atemwegsepithelzellen werden über die bedingte Reprogrammierungszellmethode erweitert. CRC-expandierte Atemwegsepithelzellen werden differenziert, um Atemwegepithelzellen an einer Luft-Flüssigkeits-Grenzfläche oder Atemwegepithel-Organoidkulturen zu etablieren. Die Bildgebung der Ziliarschlagfrequenz wird mit einem Lebendzell-Bildgebungsmikroskop mit einer Heiz- und Feuchtigkeits-Umgebungskammer und einer wissenschaftlichen Kamera mit schneller Bildrate (>100 Hz) aufgenommen. Die Datenanalyse wird mit benutzerdefinierten Skripten durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Es gibt mehrere Faktoren, die die Quantifizierung von CBF in Nasepithelblättern verschleiern könnten. Epithelblätter sollten innerhalb von 3-9 Stunden nach der Probenentnahme abgebildet werden, da die Ziliarfunktion während dieser Zeit am stabilsten ist37. Weniger rote Blutkörperchen und Ablagerungen sind am besten für die Bildgebung geeignet, da diese die Datenerfassung stören. Bei der Auswahl eines ROI für die Bildgebung ist es wichtig, eine Epithelschicht auszuwählen, deren Kante währ…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Wir danken den Studienteilnehmern und ihren Familien für ihre Beiträge. Wir schätzen die Unterstützung der Randwick Atemwegsabteilung des Sydney Children’s Hospitals (SCH) bei der Organisation und Sammlung von Patientenbioproben – besonderer Dank gilt Dr. John Widger, Dr. Yvonne Belessis, Leanne Plüsch, Amanda Thompson und Rhonda Bell. Wir danken Iveta Slapetova und Renee Whan von der Katharina Gaus Light Microscopy Facility innerhalb des Mark Wainwright Analytical Centre an der UNSW Sydney für ihre Unterstützung. Diese Arbeit wird vom National Health and Medical Research Council (NHMRC) Australia (GNT1188987), der CF Foundation Australia und der Sydney Children’s Hospital Foundation unterstützt. Die Autoren möchten Luminesce Alliance – Innovation for Children’s Health für ihren Beitrag und ihre Unterstützung danken. Luminesce Alliance – Innovation for Children’s Health ist ein gemeinnütziges Kooperationsunternehmen zwischen dem Sydney Children’s Hospitals Network, dem Children’s Medical Research Institute und dem Children’s Cancer Institute. Es wurde mit Unterstützung der Regierung von NSW gegründet, um die pädiatrische Forschung zu koordinieren und zu integrieren. Luminesce Alliance ist auch mit der University of Sydney und der University of New South Wales Sydney verbunden. KMA wird durch ein Stipendium des Australian Government Research Training Program unterstützt. LKF wird vom Rotary Club Sydney Cove/Sydney Children’s Hospital Foundation und Postgraduate Award Stipendien der UNSW University unterstützt.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

