Innsamling, utvidelse og differensiering av primære humane neseepitelcellemodeller for kvantifisering av cilia beat frekvens
Summary
Denne protokollen beskriver nasal epitelcelleinnsamling, utvidelse og differensiering til organotypiske luftveisepitelcellemodeller og kvantifisering av cilia beat-frekvens via live-celleavbildning og spesialbygde skript.
Abstract
Målinger av flimmerhårfunksjon (slagfrekvens, mønster) er etablert som diagnostiske verktøy for luftveissykdommer som primær ciliær dyskinesi. Imidlertid er den bredere anvendelsen av disse teknikkene begrenset av den ekstreme følsomheten til ciliærfunksjonen for endringer i miljøfaktorer, for eksempel temperatur, fuktighet og pH. I luftveiene hos pasienter med cystisk fibrose (CF) hindrer slimakkumulering cilia-juling. Flimmerfunksjonen har blitt undersøkt i primære luftveiscellemodeller som en indikator på CF Transmembrane conductance Regulator (CFTR) kanalaktivitet. Imidlertid er det funnet betydelig pasient-til-pasient-variasjon i cilia-slagfrekvens som respons på CFTR-modulerende legemidler, selv for pasienter med de samme CFTR-mutasjonene . Videre er virkningen av dysfunksjonell CFTR-regulert kloridsekresjon på ciliær funksjon dårlig forstått. Det er for tiden ingen omfattende protokoll som demonstrerer prøvepreparering av in vitro luftveismodeller, bildeinnsamling og analyse av Cilia Beat Frequency (CBF). Standardiserte kulturforhold og bildeoppkjøp utført i en miljøkontrollert tilstand vil muliggjøre konsistent, reproduserbar kvantifisering av CBF mellom individer og som svar på CFTR-modulerende legemidler. Denne protokollen beskriver kvantifiseringen av CBF i tre forskjellige luftveisepitelcellemodellsystemer: 1) innfødte epitelark, 2) luft-væske-grensesnittmodeller avbildet på permeable støtteinnlegg, og 3) ekstracellulære matrise-innebygde tredimensjonale organoider. De to sistnevnte replikerer in vivo lungefysiologi, med slagcilia og produksjon av slim. Ciliary-funksjonen er fanget ved hjelp av et høyhastighets videokamera i et miljøstyrt kammer. Spesialbygde skript brukes til analyse av CBF. Oversettelse av CBF-målinger til klinikken er tenkt å være et viktig klinisk verktøy for å forutsi respons på CFTR-modulerende legemidler per pasient.
Introduction
Målinger av Cilia Beat Frequency (CBF) og mønster er etablert som diagnostiske verktøy for luftveissykdommer som primær ciliær dyskinesi (PCD)1. Ved cystisk fibrose (CF) forårsaker dysfunksjon av CF Transmembrane conductance Regulator (CFTR)-kloridkanalen dehydrering av væsken på luftveisoverflaten og nedsatt slimclearance2. Ciliærfunksjonen er undersøkt in vitro i primære luftveiscellemodeller som en indikator på CFTR-kanalaktivitet3. Imidlertid eksisterer det betydelig pasient-til-pasient-variasjon i CBF som respons på CFTR-modulerende legemidler, selv for pasienter med de samme CFTR-mutasjonene 3. Videre er virkningen av dysfunksjonell CFTR-regulert kloridsekresjon på ciliær funksjon dårlig forstått. Det er for tiden ingen omfattende protokoll som demonstrerer prøvepreparering av in vitro luftveismodeller, bildeinnsamling og analyse av CBF.
Neseepitelark isolert fra neseslimhinnebørsting brukes direkte til målinger av ciliær funksjon for PCD-diagnose4. Likevel, mens det ikke er kontroll over størrelsen eller kvaliteten på neseepitelarkene som er oppnådd, varierer CBF avhengig av om det måles på enkeltceller eller celleark og på epitelark cilierte kanter som er forstyrret eller uforstyrret5. Som sådan kan sekundære dyskinesier forårsaket av skade på celler under samlingen av neseslimhinnebørster påvirke CBF. Primær cellekultur av neseepitelceller og deres differensiering ved luft-væskegrensesnitt (ALI) eller i tredimensjonal kjellermembranmatrise i cilierte luftveisepitelorganoider gir opphav til cilia som er fri for sekundære dyskinesier 4,6,7,8. Luftveisepitelceller differensiert ved ALI (heretter kalt ALI-modeller) har blitt ansett som et viktig sekundært diagnostisk hjelpemiddel som replikerer ciliary beat-mønstrene og frekvensen av ex vivo nasal mucosal brushings6 og muliggjør analyse av ciliær ultrastruktur, beatmønster og beatfrekvens samtidig som pasientspesifikke defekter opprettholdes9 . Likevel eksisterer det uoverensstemmelser i metodene som brukes til å lage disse pseudostratifiserte, mucociliary differensierte cellemodellene. Ulike kulturutvidelses- eller differensieringsprotokoller kan indusere distinkte epitelfenotyper (ciliert eller sekretorisk)10 og resultere i signifikante forskjeller i CBF11. CBF har blitt kvantifisert i neseepitelbørster 4,6,12,13,14,15,16, luftveisepitelorganoider 14,17,18 og ALI-modeller 3,4,6,13,19,20, 21. Likevel, blant disse protokollene, er det store variasjoner, og ofte er mange parametere ikke kontrollert for. For eksempel, i noen studier, er CBF avbildet in situ mens cellene i ALI-modellen forblir på den permeable støtteinnsatsen 3,19,20,21, mens andre skraper cellene fra den permeable støtteinnsatsen og avbilder dem suspendert i media 4,6,13.
Videre er den bredere anvendelsen av teknikker som måler ciliær funksjon begrenset av den ekstreme følsomheten til ciliær funksjon for endringer i miljøfaktorer. Miljøfaktorer som temperatur22, fuktighet 23,24 og pH 25,26 påvirker ciliærfunksjonen og må reguleres for å kvantifisere CBF nøyaktig. De ulike fysiologiske parametrene som brukes på tvers av ulike laboratorier og hvordan de påvirker CBF har blitt gjennomgått tidligere27.
Ulike bildeteknologier og tilnærminger til CBF-målinger er rapportert i litteraturen. For PCD-diagnostikk brukes videomikroskopi til å måle ciliær funksjon28,29. Nylig ble en videoanalysealgoritme basert på differensiell dynamisk mikroskopi brukt til å kvantifisere både CBF og cilia-koordinasjon i luftveisepitelcelle ALI-modeller 3,30. Denne metoden gjør det mulig å karakterisere ciliær juling i luftveisepitelceller på en rask og helautomatisk måte, uten behov for å segmentere eller velge regioner. Ulike metoder for avbildning og kvantifisering av CBF kan bidra til forskjeller rapportert i CBF i litteraturen (tilleggsfil 1).
En protokoll fra kultur til kvantifisering for å effektivisere eksisterende metoder, standardisering av kulturforhold og bildeoppkjøp, utført under strenge miljøkontrollerte forhold, vil muliggjøre konsistent, reproduserbar kvantifisering av CBF innenfor og mellom individer.
Denne protokollen gir en fullstendig beskrivelse av samlingen av epitelceller, ekspansjons- og differensieringskulturforhold og kvantifisering av CBF i tre forskjellige luftveisepitelcellemodellsystemer av nasal opprinnelse: 1) innfødte epitelark, 2) ALI-modeller avbildet på permeable støtteinnlegg og 3) Ekstracellulær matrise (ECM)-innebygde tredimensjonale organoider (figur 1 ). Neseepitelceller oppnådd fra nasal dårligere turbinatbørster brukes som representanter for luftveisepitelet siden de er et effektivt surrogat for bronkialepitelceller31 mens de overvinner den invasive prosedyren forbundet med å samle bronkial børster. Metoden Conditional Reprogramming Cell (CRC) brukes til å utvide primære luftveisepitelceller for opprettelse av ALI-modeller og tredimensjonale organoider. Betinget omprogrammering av luftveisepitelceller til stamcellelignende tilstand induseres av samkultur med vekstarrestert fibroblastmatercellesystem og Rho-assosiert kinase (ROCK) hemmer32. Det er viktig at CRC-metoden øker populasjonsdoblingen i luftveisepitelceller samtidig som de beholder sitt vevsspesifikke differensieringspotensial33,34. I alle luftveisepitelcellemodeller fanges ciliary-funksjonen i et temperaturkontrollert kammer ved hjelp av et høyhastighets videokamera med standardiserte bildeinnsamlingsinnstillinger. Spesialbygde skript brukes til kvantifisering av CBF.
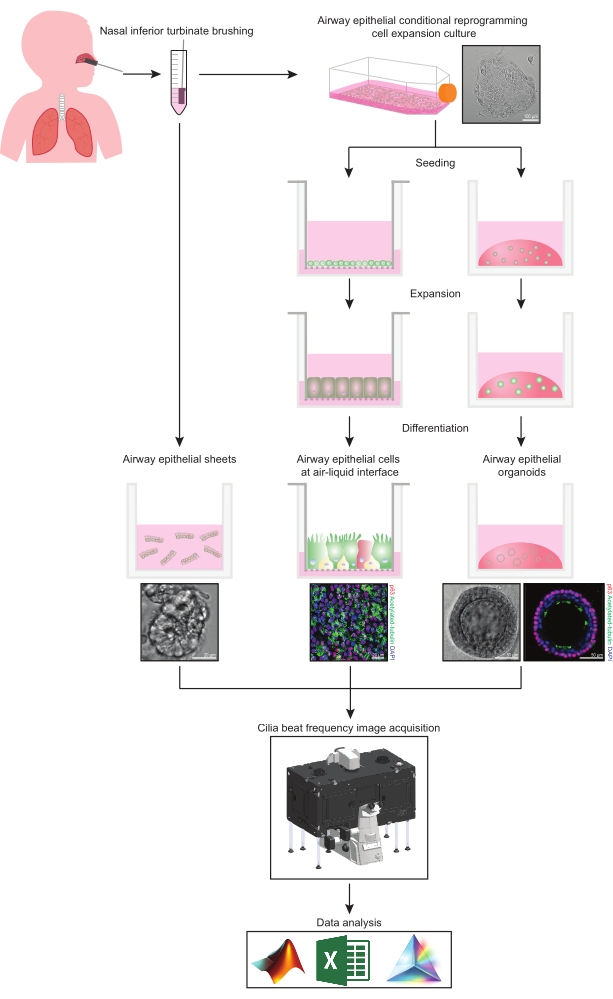
Figur 1: Skjematisk arbeidsflyt. Etter børsting av deltakernes nasale nedre turbinat, brukes luftveisepitelceller på en av to måter. Enten isoleres luftveisepitelark, og cilia beat-frekvensen avbildes umiddelbart, eller luftveienes epitelceller utvides via den betingede omprogrammeringscellemetoden. CRC-ekspanderte luftveisepitelceller differensieres for å etablere luftveisepitelceller ved et luft-væskegrensesnitt eller luftveisepitelorganoidkulturer. Avbildning av ciliær beatfrekvens oppnås ved hjelp av et levende celleavbildningsmikroskop med et varme- og fuktighetsmiljøkammer og et raskt bildefrekvens (>100Hz) vitenskapelig kamera. Dataanalyse utføres ved hjelp av spesialbygde skript. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Det er flere faktorer som kan skjule kvantifiseringen av CBF i neseepitelark. Epitelark bør avbildes innen 3-9 timer etter prøvetaking siden ciliærfunksjonen er mest stabil i løpet av denne tiden37. Mindre røde blodlegemer og rusk er mest optimale for avbildning siden disse forstyrrer datainnsamlingen. Når du velger en ROI for avbildning, er det viktig å velge et epitelark som kanten ikke har blitt skadet eller forstyrret under innsamlingen av prøven, og ikke en eneste ufestet epitelcelle,…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi takker studiedeltakerne og deres familier for deres bidrag. Vi setter pris på hjelpen fra Sydney Children’s Hospitals (SCH) Randwick respiratorisk avdeling i organisering og innsamling av pasientbiospecimens – spesiell takk til Dr. John Widger, Dr. Yvonne Belessis, Leanne Plush, Amanda Thompson og Rhonda Bell. Vi anerkjenner assistansen fra Iveta Slapetova og Renee Whan fra Katharina Gaus Light Microscopy Facility i Wainwright Analytical Centre ved UNSW Sydney. Dette arbeidet støttes av National Health and Medical Research Council (NHMRC) Australia (GNT1188987), CF Foundation Australia og Sydney Children’s Hospital Foundation. Forfatterne ønsker å anerkjenne Luminesce Alliance – Innovation for Children’s Health for sitt bidrag og støtte. Luminesce Alliance – Innovation for Children’s Health er et non-profit samarbeidsprosjekt mellom Sydney Children’s Hospitals Network, Children’s Medical Research Institute og Children’s Cancer Institute. Det er etablert med støtte fra NSW-regjeringen for å koordinere og integrere pediatrisk forskning. Luminesce Alliance er også tilknyttet University of Sydney og University of New South Wales Sydney. KMA støttes av et australsk regjeringsforskningsprogramstipend. LKF støttes av Rotary Club of Sydney Cove / Sydney Children’s Hospital Foundation og UNSW University postgraduate award stipend.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

