Coleta, Expansão e Diferenciação de Modelos Primários de Células Epiteliais Nasais Humanas para Quantificação da Frequência de Batimento de Cílios
Summary
Este protocolo descreve a coleta, expansão e diferenciação de células epiteliais nasais para modelos de células epiteliais organotípicas das vias aéreas e quantificação da frequência de batimentos de cílios por meio de imagens de células vivas e scripts personalizados.
Abstract
Medidas da função dos cílios (frequência de batimento, padrão) foram estabelecidas como ferramentas diagnósticas para doenças respiratórias, como discinesia ciliar primária. No entanto, a aplicação mais ampla dessas técnicas é limitada pela extrema suscetibilidade da função ciliar a mudanças em fatores ambientais, por exemplo, temperatura, umidade e pH. Nas vias aéreas de pacientes com Fibrose Cística (FC), o acúmulo de muco impede o batimento dos cílios. A função dos cílios tem sido investigada em modelos celulares primários das vias aéreas como um indicador da atividade do canal CF Transmembrane conductance Regulator (CFTR). No entanto, uma considerável variabilidade de paciente para paciente na frequência de batimento de cílios foi encontrada em resposta a drogas moduladoras de CFTR, mesmo para pacientes com as mesmas mutações de CFTR . Além disso, o impacto da secreção disfuncional de cloreto regulado por CFTR na função ciliar é pouco compreendido. Atualmente, não existe um protocolo abrangente que demonstre a preparação de amostras de modelos de vias aéreas in vitro , a aquisição de imagens e a análise da frequência de batimento ciliar (CBF). Condições de cultura padronizadas e aquisição de imagens realizadas em uma condição ambientalmente controlada permitiriam quantificação consistente e reprodutível do FSC entre indivíduos e em resposta a drogas moduladoras de CFTR. Este protocolo descreve a quantificação do CBF em três diferentes sistemas de modelos de células epiteliais das vias aéreas: 1) folhas epiteliais nativas, 2) modelos de interface ar-líquido fotografados em pastilhas de suporte permeáveis e 3) organoides tridimensionais embutidos em matriz extracelular. Os dois últimos replicam a fisiologia pulmonar de vivo, com batimento de cílios e produção de muco. A função ciliar é capturada usando uma câmera de vídeo de alta velocidade em uma câmara controlada pelo ambiente. Scripts personalizados são usados para a análise do CBF. A tradução das medidas do CBF para a clínica é considerada uma importante ferramenta clínica para prever a resposta a medicamentos moduladores de CFTR por paciente.
Introduction
Medidas de frequência e padrão de batimento ciliar (CBF) têm sido estabelecidas como ferramentas diagnósticas para doenças respiratórias, como a discinesia ciliar primária (PCD)1. Na Fibrose Cística (FC), a disfunção do canal de cloreto do Regulador de Condutância Transmembrana Transmembrana da FC (CFTR) causa desidratação do líquido superficial das vias aéreas e comprometimento do clearance mucociliar2. A função ciliar tem sido investigada in vitro em modelos primários de células das vias aéreas como um indicador da atividade do canal CFTR3. No entanto, existe uma considerável variabilidade paciente-a-paciente no FSC em resposta a drogas moduladoras de CFTR, mesmo para pacientes com as mesmas mutações do CFTR 3. Além disso, o impacto da secreção disfuncional de cloreto regulado por CFTR na função ciliar é pouco compreendido. Atualmente, não há um protocolo abrangente que demonstre a preparação de amostras de modelos de vias aéreas in vitro , aquisição de imagens e análise de CBF.
Folhas epiteliais nasais isoladas de escovações da mucosa nasal são diretamente utilizadas para medidas da função ciliar para o diagnóstico de PCD4. No entanto, embora não haja controle sobre o tamanho ou a qualidade das folhas epiteliais nasais obtidas, o FSC varia dependendo se é medido em células únicas ou folhas celulares e em bordas ciliadas de folha epitelial que são interrompidas ou ininterruptas5. Dessa forma, discinesias secundárias causadas por danos às células durante a coleta de escovações da mucosa nasal podem influenciar o FSC. A cultura celular primária de células epiteliais nasais e sua diferenciação na Interface Ar-Líquido (LPA) ou na matriz tridimensional da membrana basal em organoides epiteliais das vias aéreas ciliadas dão origem a cílios livres de discinesias secundárias 4,6,7,8. As células epiteliais das vias aéreas diferenciadas na LPA (doravante denominadas modelos de LPA) têm sido consideradas um importante auxiliar diagnóstico secundário que replica os padrões de batimentos ciliares e a frequência de escovações ex vivo da mucosa nasal6 e permite a análise da ultraestrutura ciliar, padrão de batimento e frequência de batimentos, mantendo defeitos específicos do paciente9 . No entanto, existem discrepâncias nas metodologias usadas para criar esses modelos de células pseudoestratificadas e mucociliares diferenciadas. Diferentes protocolos de expansão ou diferenciação da cultura podem induzir fenótipos epiteliais distintos (ciliados ou secretores)10 e resultar em diferenças significativas no CBF11. O CBF foi quantificado em escovações epiteliais nasais 4,6,12,13,14,15,16, organoides epiteliais das vias aéreas 14,17,18 e modelos LPA 3,4,6,13,19,20, 21. No entanto, entre esses protocolos, existem grandes variabilidades e, muitas vezes, muitos parâmetros não são controlados. Por exemplo, em alguns estudos, o CBF é fotografado in situ enquanto as células do modelo LPA permanecem na inserção de suporte permeável 3,19,20,21, outras ainda raspam as células da inserção de suporte permeável e as fotografam suspensas em meio 4,6,13.
Além disso, a aplicação mais ampla de técnicas que medem a função ciliar é limitada pela extrema suscetibilidade da função ciliar a mudanças em fatores ambientais. Fatores ambientais como temperatura22, umidade 23,24 e pH25,26 influenciam a função ciliar e devem ser regulados para quantificar o FSC com precisão. Os diversos parâmetros fisiológicos utilizados em diferentes laboratórios e como eles influenciam o FSC já foram revisados anteriormente27.
Várias tecnologias de imagem e abordagens para medidas de CBF são relatadas na literatura. Para o diagnóstico de PCD, a videomicroscopia é utilizada para medir a função ciliar28,29. Recentemente, um algoritmo de videoanálise baseado em microscopia dinâmica diferencial foi utilizado para quantificar a coordenação do FSC e dos cílios em modelos de LPA de células epiteliais das vias aéreas 3,30. Este método permite a caracterização do batimento ciliar em células epiteliais das vias aéreas de forma rápida e totalmente automatizada, sem a necessidade de segmentar ou selecionar regiões. Vários métodos de imagem e quantificação do FSC podem se somar às diferenças relatadas no FSC na literatura (Arquivo Suplementar 1).
Um protocolo da cultura à quantificação para agilizar os métodos existentes, a padronização das condições de cultura e a aquisição de imagens, realizadas em condições rigorosas e ambientalmente controladas, permitiriam a quantificação consistente e reprodutível do CBF dentro e entre os indivíduos.
Este protocolo fornece uma descrição completa da coleção de células epiteliais, condições de cultura de expansão e diferenciação e quantificação do FSC em três diferentes sistemas de modelo de células epiteliais das vias aéreas de origem nasal: 1) folhas epiteliais nativas, 2) modelos de LPA fotografados em pastilhas de suporte permeável e 3) organoides tridimensionais embutidos na Matriz Extracelular (ECM) (Figura 1 ). As células epiteliais nasais obtidas a partir de escovações nasais de cornetos inferiores são utilizadas como representantes do epitélio das vias aéreas, uma vez que são um substituto eficaz para as células epiteliais brônquicas31, superando o procedimento invasivo associado à coleta de escovações brônquicas. O método Conditional Reprogramming Cell (CRC) é usado para expandir células epiteliais primárias das vias aéreas para a criação de modelos de LPA e organoides tridimensionais. A reprogramação condicional de células epiteliais das vias aéreas para um estado semelhante a células-tronco é induzida pela cocultura com o sistema de células alimentadoras de fibroblastos preso ao crescimento e inibidor da quinase associada a Rho (ROCK)32. É importante ressaltar que o método do CCR aumenta a duplicação populacional das células epiteliais das vias aéreas, mantendo seu potencial de diferenciação tecidual específico33,34. Em todos os modelos de células epiteliais das vias aéreas, a função ciliar é capturada em uma câmara de temperatura controlada usando uma câmera de vídeo de alta velocidade com configurações padronizadas de aquisição de imagem. Scripts personalizados são empregados para a quantificação do CBF.
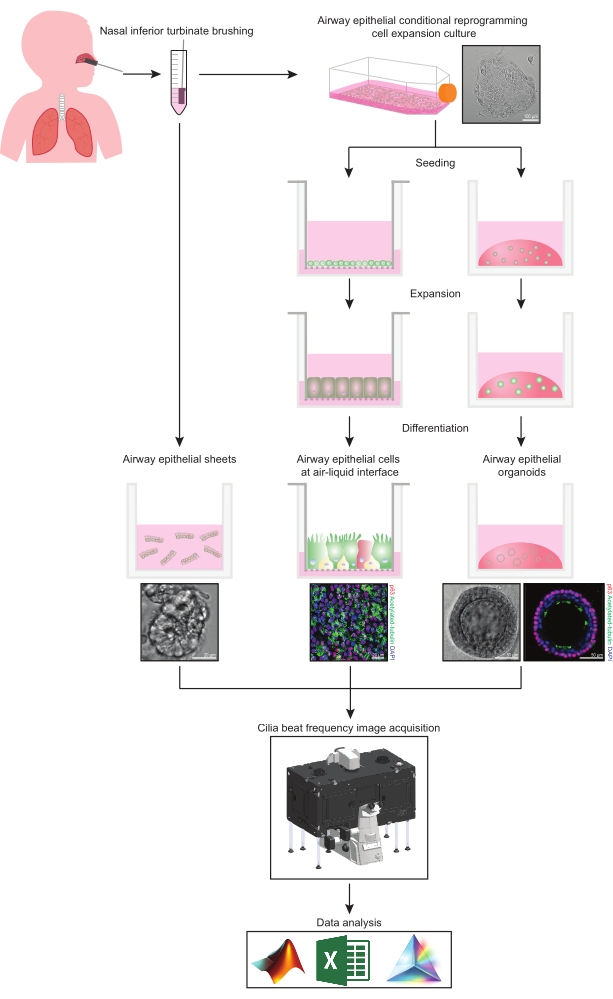
Figura 1: Esquema do fluxo de trabalho. Após a escovação do corneto nasal inferior dos participantes, as células epiteliais das vias aéreas são utilizadas de duas maneiras. Ou as folhas epiteliais das vias aéreas são isoladas e a frequência de batimento dos cílios é visualizada imediatamente, ou as células epiteliais das vias aéreas são expandidas através do método de células de reprogramação condicional. As células epiteliais das vias aéreas expandidas por CCR são diferenciadas para estabelecer células epiteliais das vias aéreas em uma interface ar-líquido ou culturas organoides epiteliais das vias aéreas. A imagem da frequência de batimentos ciliares é adquirida usando um microscópio de imagem de células vivas com uma câmara ambiental de aquecimento e umidade e uma câmera científica de taxa de quadros rápida (>100Hz). A análise de dados é realizada usando scripts personalizados. Por favor, clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Existem múltiplos fatores que podem obscurecer a quantificação do FSC nas folhas epiteliais nasais. As folhas epiteliais devem ser fotografadas dentro de 3-9 horas após a coleta da amostra, uma vez que a função ciliar é mais estável durante esse período37. Menos glóbulos vermelhos e detritos são mais ideais para imagens, uma vez que interferem na aquisição de dados. Ao selecionar um ROI para exames de imagem, é importante selecionar uma folha epitelial que não tenha sido danificada …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Agradecemos aos participantes do estudo e suas famílias por suas contribuições. Agradecemos a assistência do departamento respiratório de Randwick do Sydney Children’s Hospitals (SCH) na organização e coleta de bioespécimes de pacientes – agradecimentos especiais ao Dr. John Widger, Dr. Yvonne Belessis, Leanne Plush, Amanda Thompson e Rhonda Bell. Reconhecemos a assistência de Iveta Slapetova e Renee Whan da Instalação de Microscopia de Luz Katharina Gaus dentro do Centro Analítico Mark Wainwright da UNSW Sydney. Este trabalho é apoiado pelo Conselho Nacional de Saúde e Pesquisa Médica (NHMRC) Austrália (GNT1188987), CF Foundation Austrália e Sydney Children’s Hospital Foundation. Os autores agradecem à Luminesce Alliance – Innovation for Children’s Health por sua contribuição e apoio. A Luminesce Alliance – Innovation for Children’s Health é uma joint venture cooperativa sem fins lucrativos entre a Sydney Children’s Hospitals Network, o Children’s Medical Research Institute e o Children’s Cancer Institute. Foi estabelecido com o apoio do governo de NSW para coordenar e integrar a pesquisa pediátrica. A Luminesce Alliance também é afiliada à Universidade de Sydney e à Universidade de Nova Gales do Sul de Sydney. A KMA é apoiada por uma bolsa de estudos do Programa de Treinamento em Pesquisa do Governo Australiano. A LKF é apoiada pelo Rotary Club de Sydney Cove/Sydney Children’s Hospital Foundation e pelas bolsas de pós-graduação da UNSW University.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

