Primer İnsan Nazal Epitel Hücre Modellerinin Silia Beat Sıklığının Ölçülmesi İçin Toplanması, Genleştirilmesi ve Farklılaştırılması
Summary
Bu protokol, nazal epitel hücresi toplanmasını, genişlemesini ve organotipik hava yolu epitel hücre modellerine farklılaşmasını ve canlı hücre görüntüleme ve özel yapım senaryolar yoluyla kirpik vuruş sıklığının nicelleştirilmesini açıklar.
Abstract
Kirpik fonksiyonunun ölçümleri (atım sıklığı, patern) primer siliyer diskinezi gibi solunum yolu hastalıkları için tanı araçları olarak belirlenmiştir. Bununla birlikte, bu tekniklerin daha geniş bir şekilde uygulanması, siliyer fonksiyonun sıcaklık, nem ve pH gibi çevresel faktörlerdeki değişikliklere aşırı duyarlılığı ile sınırlıdır. Kistik Fibrozisli (KF) hastaların hava yolunda, mukus birikimi kirpiklerin dövülmesini engeller. Primer hava yolu hücre modellerinde CF Transmembran iletkenlik Regülatörü (CFTR) kanal aktivitesinin bir göstergesi olarak silia fonksiyonu araştırılmıştır. Bununla birlikte, aynı CFTR mutasyonlarına sahip hastalar için bile, CFTR modüle edici ilaçlara yanıt olarak, kirpik atma sıklığında hastadan hastaya önemli değişkenlik bulunmuştur. Ayrıca, işlevsiz CFTR regüle klorür sekresyonunun siliyer fonksiyon üzerindeki etkisi tam olarak anlaşılamamıştır. Şu anda in vitro hava yolu modellerinin numune hazırlanmasını, görüntü alımını ve Cilia Beat Frekansı’nın (CBF) analizini gösteren kapsamlı bir protokol yoktur. Standartlaştırılmış kültür koşulları ve çevre kontrollü bir durumda gerçekleştirilen görüntü elde etme, bireyler arasında ve CFTR modüle edici ilaçlara yanıt olarak CBF’nin tutarlı, tekrarlanabilir bir şekilde ölçülmesini sağlayacaktır. Bu protokol, CBF’nin üç farklı hava yolu epitel hücre modeli sisteminde nicelleştirilmesini açıklar: 1) doğal epitel tabakaları, 2) geçirgen destek uçlarında görüntülenen hava-sıvı arayüz modelleri ve 3) hücre dışı matrise gömülü üç boyutlu organoidler. Son ikisi, kirpiklerin dövülmesi ve mukus üretimi ile in vivo akciğer fizyolojisini çoğaltır. Siliyer fonksiyonu, ortam kontrollü bir odada yüksek hızlı bir video kamera kullanılarak yakalanır. CBF’nin analizi için özel olarak oluşturulmuş komut dosyaları kullanılır. CBF ölçümlerinin kliniğe çevrilmesinin, hasta bazında CFTR modüle edici ilaçlara yanıtı tahmin etmek için önemli bir klinik araç olması öngörülmektedir.
Introduction
Silia Beat Sıklığı (CBF) ve paterninin ölçümleri, Primer Siliyer Diskinezi (PCD)1 gibi solunum yolu hastalıkları için tanı araçları olarak belirlenmiştir. Kistik Fibrozis’te (KF), KF Transmembran İletkenlik Regülatörü (CFTR) klorür kanalının işlev bozukluğu, hava yolu yüzey sıvısının dehidrasyonuna ve mukosiliyer klirensin bozulmasına neden olur2. Siliyer fonksiyon, CFTR kanal aktivitesinin bir göstergesi olarak primer hava yolu hücre modellerinde in vitro olarak araştırılmıştır3. Bununla birlikte, CBF’de, aynı CFTR mutasyonlarına sahip hastalar için bile, CFTR modüle edici ilaçlara yanıt olarak önemli ölçüde hastadan hastaya değişkenlik vardır3. Ayrıca, işlevsiz CFTR regüle klorür sekresyonunun siliyer fonksiyon üzerindeki etkisi tam olarak anlaşılamamıştır. Şu anda in vitro hava yolu modellerinin numune hazırlanmasını, görüntü alımını ve CBF’nin analizini gösteren kapsamlı bir protokol yoktur.
Nazal mukozal fırçalamalardan izole edilen nazal epitel tabakaları, PCD tanısı için siliyer fonksiyon ölçümlerinde doğrudan kullanılır4. Bununla birlikte, elde edilen nazal epitel tabakalarının boyutu veya kalitesi üzerinde bir kontrol bulunmamakla birlikte, CBF, tek hücreler veya hücre tabakaları üzerinde ve bozulmuş veya bozulmamış epitel tabakası siliye kenarlarında ölçülüp ölçülmediğine bağlı olarak değişir5. Bu nedenle, burun mukozal fırçalamalarının toplanması sırasında hücrelere verilen hasarın neden olduğu ikincil diskineziler CBF’yi etkileyebilir. Nazal epitel hücrelerinin primer hücre kültürü ve Hava-Sıvı Arayüzünde (ALI) veya üç boyutlu bazal membran matriksinde siliyer hava yolu epitel organoidlerine farklılaşması, sekonder diskinezilerden arındırılmış kirpiklere yol açar 4,6,7,8. ALI’da farklılaşan hava yolu epitel hücreleri (bundan böyle ALI modelleri olarak adlandırılacaktır), siliyer atım paternlerini ve ex vivo nazal mukozal fırçalamaların sıklığını kopyalayan önemli bir ikincil tanı yardımcısı olarak kabul edilmiştir6 ve hastaya özgü kusurları korurken siliyer ultrayapı, vuruş paterni ve vuruş sıklığının analizini mümkün kılmaktadır9 . Bununla birlikte, bu psödostratifiye, mukosiliyer farklılaşmış hücre modellerini oluşturmak için kullanılan metodolojilerde tutarsızlıklar mevcuttur. Farklı kültür genişlemesi veya farklılaşma protokolleri, farklı epitel fenotiplerini (siliye veya sekretuar)10 indükleyebilir ve CBF11’de önemli farklılıklara neden olabilir. CBF, nazal epitel fırçalamalarında 4,6,12,13,14,15,16, hava yolu epitel organoidlerinde 14,17,18 ve ALI modellerinde 3,4,6,13,19,20, 21. Yine de, bu protokoller arasında büyük değişkenlikler vardır ve çoğu zaman birçok parametre kontrol edilmez. Örneğin, bazı çalışmalarda, ALI modelinin hücreleri geçirgen destek eki 3,19,20,21’de kalırken, CBF in situ olarak görüntülenirken, diğerleri hücreleri geçirgen destek ekinden kazır ve 4,6,13 numaralı medyada asılı olarak görüntüler.
Ayrıca, siliyer fonksiyonu ölçen tekniklerin daha geniş bir şekilde uygulanması, siliyer fonksiyonun çevresel faktörlerdeki değişikliklere aşırı duyarlılığı ile sınırlıdır. Sıcaklık 22, nem 23,24 ve pH 25,26 gibi çevresel faktörler siliyer fonksiyonu etkiler ve CBF’yi doğru bir şekilde ölçmek için düzenlenmelidir. Farklı laboratuvarlarda kullanılan çeşitli fizyolojik parametreler ve CBF’yi nasıl etkiledikleri daha önce gözden geçirilmiştir27.
Literatürde çeşitli görüntüleme teknolojileri ve CBF ölçümlerine yaklaşımlar bildirilmiştir. PCD teşhisi için, siliyer fonksiyon 28,29’u ölçmek için video mikroskopi kullanılır. Son zamanlarda, hava yolu epitel hücresi ALI modellerinde hem CBF hem de kirpik koordinasyonunu ölçmek için diferansiyel dinamik mikroskopiye dayalı bir video analiz algoritması kullanılmıştır 3,30. Bu yöntem, hava yolu epitel hücrelerinde siliyer atımın, bölgeleri segmentlere ayırmaya veya seçmeye gerek kalmadan hızlı ve tam otomatik bir şekilde karakterizasyonunu sağlar. CBF’nin görüntülenmesi ve nicelleştirilmesi için çeşitli yöntemler literatürde CBF’de bildirilen farklılıklara katkıda bulunabilir (Ek Dosya 1).
Mevcut yöntemleri düzene sokmak için kültürden nicelemeye, kültür koşullarının standardizasyonuna ve sıkı çevre kontrollü koşullarda gerçekleştirilen görüntü elde etmeye yönelik bir protokol, CBF’nin bireyler içinde ve arasında tutarlı, tekrarlanabilir bir şekilde nicelleştirilmesini sağlayacaktır.
Bu protokol, epitel hücrelerinin toplanmasının, genleşme ve farklılaşma kültürü koşullarının ve CBF’nin nazal kökenli üç farklı hava yolu epitel hücre modeli sisteminde nicelleştirilmesinin tam bir tanımını sağlar: 1) doğal epitel tabakaları, 2) geçirgen destek ekleri üzerinde görüntülenen ALI modelleri ve 3) Hücre Dışı Matriks (ECM) gömülü üç boyutlu organoidler (Şekil 1 ). Nazal inferior konka fırçalamalarından elde edilen nazal epitel hücreleri, bronşiyal epitel hücreleri için etkili bir vekil oldukları için hava yolu epitelinin temsilcileri olarak kullanılırlar31 bronşiyal fırçalamaların toplanmasıyla ilişkili invaziv prosedürün üstesinden gelirler. Koşullu Yeniden Programlama Hücresi (CRC) yöntemi, ALI modellerinin ve üç boyutlu organoidlerin oluşturulması için birincil hava yolu epitel hücrelerini genişletmek için kullanılır. Hava yolu epitel hücrelerinin kök hücre benzeri bir duruma koşullu olarak yeniden programlanması, büyüme durdurucu fibroblast besleyici hücre sistemi ve Rho ile ilişkili kinaz (ROCK) inhibitörü32 ile ortak kültür tarafından indüklenir. Önemli olarak, CRC yöntemi, hava yolu epitel hücrelerinde popülasyonun iki katına çıkmasını artırırken, dokuya özgü farklılaşma potansiyelini korur33,34. Tüm hava yolu epitel hücresi modellerinde, siliyer fonksiyon, standartlaştırılmış görüntü yakalama ayarlarına sahip yüksek hızlı bir video kamera kullanılarak sıcaklık kontrollü bir odada yakalanır. CBF’nin nicelleştirilmesi için özel olarak oluşturulmuş komut dosyaları kullanılır.
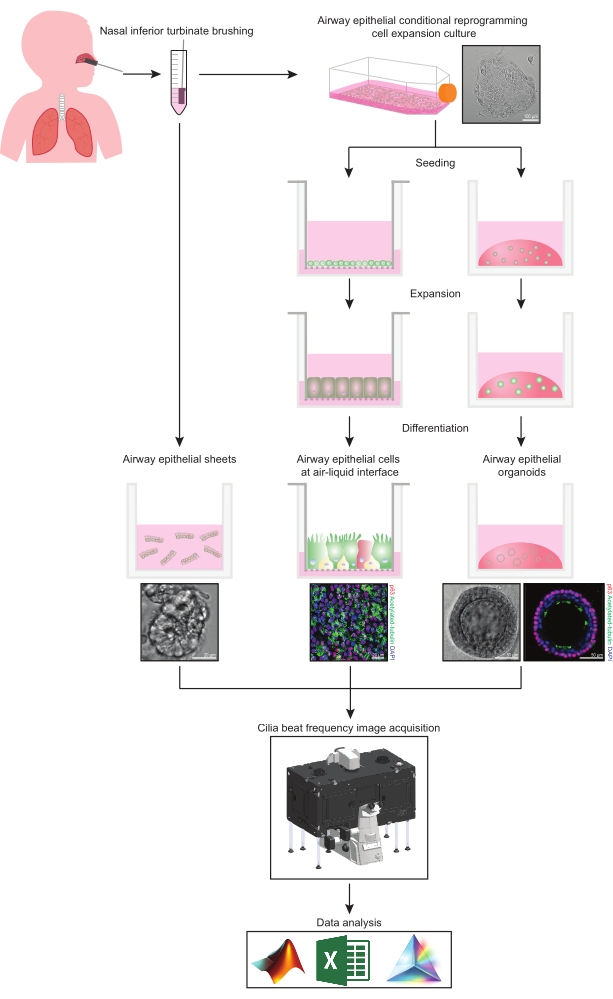
Şekil 1: İş akışının şeması. Katılımcıların nazal inferior konkasını fırçaladıktan sonra, hava yolu epitel hücreleri iki yoldan biriyle kullanılır. Ya hava yolu epitel tabakaları izole edilir ve kirpik vuruş frekansı hemen görüntülenir ya da hava yolu epitel hücreleri koşullu yeniden programlama hücre yöntemi ile genişletilir. CRC-genleşmiş hava yolu epitel hücreleri, bir hava-sıvı arayüzünde veya hava yolu epitel organoid kültürlerinde hava yolu epitel hücreleri oluşturmak için farklılaşır. Siliyer atış frekansının görüntülenmesi, ısıtma ve nem çevre odasına ve hızlı kare hızına (>100Hz) sahip bir bilimsel kameraya sahip canlı hücre görüntüleme mikroskobu kullanılarak elde edilir. Veri analizi, özel olarak oluşturulmuş komut dosyaları kullanılarak gerçekleştirilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Nazal epitel tabakalarında CBF’nin miktarını gizleyebilecek birçok faktör vardır. Epitel tabakaları numune toplandıktan sonraki 3-9 saat içinde görüntülenmelidir, çünkü siliyer fonksiyon bu süre zarfında en stabildir37. Daha az kırmızı kan hücresi ve döküntü, görüntüleme için en uygun olanıdır, çünkü bunlar veri toplamaya müdahale eder. Görüntüleme için bir ROI seçerken, numunenin toplanması sırasında kenarın hasar görmediği veya bozulmadığı ve tek b…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Araştırmaya katılanlara ve ailelerine katkılarından dolayı teşekkür ederiz. Sydney Çocuk Hastaneleri (SCH) Randwick solunum departmanının hasta biyoörneklerinin organizasyonu ve toplanmasındaki yardımını takdir ediyoruz – Dr. John Widger, Dr. Yvonne Belessis, Leanne Plush, Amanda Thompson ve Rhonda Bell’e özel teşekkürler. UNSW Sidney’deki Mark Wainwright Analitik Merkezi’ndeki Katharina Gaus Işık Mikroskobu Tesisi’nden Iveta Slapetova ve Renee Whan’ın yardımlarını kabul ediyoruz. Bu çalışma Ulusal Sağlık ve Tıbbi Araştırma Konseyi (NHMRC) Avustralya (GNT1188987), CF Vakfı Avustralya ve Sidney Çocuk Hastanesi Vakfı tarafından desteklenmektedir. Yazarlar, Luminesce Alliance – Çocuk Sağlığı için İnovasyon’a katkısı ve desteği için teşekkür eder. Luminesce Alliance – Innovation for Children’s Health, Sydney Çocuk Hastaneleri Ağı, Çocuk Tıbbi Araştırma Enstitüsü ve Çocuk Kanseri Enstitüsü arasında kar amacı gütmeyen bir işbirliği ortak girişimidir. Pediatrik araştırmaları koordine etmek ve entegre etmek için NSW Hükümeti’nin desteğiyle kurulmuştur. Luminesce Alliance ayrıca Sydney Üniversitesi ve New South Wales Sydney Üniversitesi’ne de bağlıdır. KMA, Avustralya Hükümeti Araştırma Eğitim Programı Bursu ile desteklenmektedir. LKF, Sydney Cove Rotary Kulübü/Sydney Çocuk Hastanesi Vakfı ve UNSW Üniversitesi lisansüstü ödül bursları tarafından desteklenmektedir.
Materials
| Adenine | Sigma-Aldrich | A2786 | 10 mg/mL |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634-010 | |
| Alanyl-glutamine | Sigma-Aldrich | G8541 | 200 mM |
| Andor Zyla 4.2 sCMOS | Oxford Instruments | Fast frame rate (>100 Hz) scientific camera | |
| Bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Ceftazidime hydrate | Sigma-Aldrich | A6987 | 50 mg/mL |
| Cell Culture Microscope | Olympus | CKX53 | |
| CFI S Plan Fluor ELWD 20XC | Nikon Instruments Inc. | MRH08230 | Long working distance objective lens. NA0.45 WD 8.2-6.9 |
| Cholera toxin | Sigma-Aldrich | C8052-1MG | 200 µg/mL |
| Corning Gel Strainer 40 UM | Sigma-Aldrich | CLS431750 | Pore size 40 μm |
| Corning Matrigel Matrix (Phenol red-free) | Corning | 356231 | Extracellular matrix (ECM) |
| Corning bottle-top vacuum filter system | Sigma-Aldrich | CLS431098 | |
| Corning CoolCell LX Cell Freezing Container | Sigma-Aldrich | CLS432002 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3470 | Permeable support inserts. 6.5 mm Transwell with 0.4 μm pore polyester membrane insert. |
| Countess Cell Counting Chamber Slides | Thermo Fisher Scientific | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | Automated cell counter |
| Cytology brushes | McFarlane Medical | 33009 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM/F12-Ham | Thermo Fisher Scientific | 11330032 | |
| DMEM-High Glucose | Thermo Fisher Scientific | 11965-092 | |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Eclipse Ti2-E | Nikon | Live-cell imaging microscope. | |
| Fetal Bovine Serum, certified, heat inactivated, United States | Thermo Fisher Scientific | 10082147 | |
| Fungizone (Amphotericin B) | Thermo Fisher Scientific | 15290018 | 250 µg/mL |
| Gentamicin solution | Sigma-Aldrich | G1397 | 50 mg/mL |
| Graphpad Prism | Graphpad | Scientific analysis software | |
| Greiner Cryo.s vials | Sigma-Aldrich | V3135 | Cryogenic vials |
| HEPES solution | Sigma-Aldrich | H0887 | 1 M |
| HI-FBS | Thermo Fisher Scientific | 10082-147 | |
| Hydrocortisone | Sigma-Aldrich | H0888 | 3.6 mg/mL |
| Incubator NL Ti2 BLACK 2000 | PeCon | Microscope environmental chamber. Allows warm air incubation and local CO2 and O2 gassing | |
| Insulin | Sigma-Aldrich | I2643 | 2 mg/mL |
| Lab Armor 74220 706 Waterless Bead Bath 6L | John Morris Group | 74220 706 | Bead bath |
| Lab Armor Beads | Thermo Fisher Scientific | A1254302 | Thermal beads |
| MATLAB | MathWorks | Computing software | |
| Microsoft Excel | Microscoft | Spreadsheet software | |
| NIH/3T3 | American Type Culture Collection | CRL-1658 | Irradiated NIH-3T3 mouse embryonic feeder cells |
| NIS-Elements AR | Nikon Instruments Inc. | Image acquisition software | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | 10,000 units penicillin and 10 mg streptomycin/mL |
| Dulbecco′s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| PneumaCult Airway Organoid Kit | StemCell Technologies | 5060 | Airway Organoid Kit |
| PneumaCult-ALI Medium | StemCell Technologies | 5001 | |
| PneumaCult-Ex Plus Medium | StemCell Technologies | 5040 | |
| PureCol-S | Advanced BioMatrix | 5015 | Type I Collagen solution |
| ReagentPack Subculture Reagents | Lonza | CC-5034 | |
| rhEGF (Epidermal Growth Factor, human) | Sigma-Aldrich | E9644 | 25 µg/mL |
| Y-27632 2HCl (ROCK inhibitor) | Selleckchem | S1049 | 10 mM |
| Tobramycin | Sigma-Aldrich | T4014 | 100 mg/mL |
| Trypan blue solution | Sigma-Aldrich | T8154 | 0.4% |
| UNO Stage Top Incubator | Okolab | Microscope incubator. Allows temperature, humidity and CO2 conditioning |
References
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. European Respiratory Journal. 34 (6), 1264-1276 (2009).
- Cutting, G. R. Cystic fibrosis genetics: from molecular understanding to clinical application. Nature Reviews Genetics. 16 (1), 45-56 (2015).
- Chioccioli, M., Feriani, L., Kotar, J., Bratcher, P. E., Cicuta, P. Phenotyping ciliary dynamics and coordination in response to CFTR-modulators in Cystic Fibrosis respiratory epithelial cells. Nature Communications. 10 (1), 1763 (2019).
- Hirst, R. A., Rutman, A., Williams, G., O’Callaghan, C. Ciliated air-liquid cultures as an aid to diagnostic testing of primary ciliary dyskinesia. Chest. 138 (6), 1441-1447 (2010).
- Thomas, B., Rutman, A., O’Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Coles, J. L., et al. A revised protocol for culture of airway epithelial cells as a diagnostic tool for primary ciliary dyskinesia. Journal of Clinical Medicine. 9 (11), (2020).
- Pifferi, M., et al. Simplified cell culture method for the diagnosis of atypical primary ciliary dyskinesia. Thorax. 64 (12), 1077-1081 (2009).
- Pifferi, M., et al. Rapid diagnosis of primary ciliary dyskinesia: cell culture and soft computing analysis. European Respiratory Journal. 41 (4), 960-965 (2013).
- Lee, D. D. H., et al. Higher throughput drug screening for rare respiratory diseases: Readthrough therapy in primary ciliary dyskinesia. European Respiratory Journal. 58 (4), 2000455 (2021).
- Saint-Criq, V., et al. Choice of differentiation media significantly impacts cell lineage and response to CFTR modulators in fully differentiated primary cultures of cystic fibrosis human airway epithelial cells. Cells. 9 (9), (2020).
- Awatade, N. T., et al. Significant functional differences in differentiated Conditionally Reprogrammed (CRC)- and Feeder-free Dual SMAD inhibited-expanded human nasal epithelial cells. Journal of Cystic Fibrosis. 20 (2), 364-371 (2021).
- Dabrowski, M., Bukowy-Bieryllo, Z., Jackson, C. L., Zietkiewicz, E. Properties of non-aminoglycoside compounds used to stimulate translational readthrough of PTC mutations in primary ciliary dyskinesia. International Journal of Molecular Sciences. 22 (9), (2021).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PloS One. 9 (2), 89675 (2014).
- Marthin, J. K., Stevens, E. M., Larsen, L. A., Christensen, S. T., Nielsen, K. G. Patient-specific three-dimensional explant spheroids derived from human nasal airway epithelium: a simple methodological approach for ex vivo studies of primary ciliary dyskinesia. Cilia. 6, 3 (2017).
- Chilvers, M. A., O’Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Chilvers, M. A., Rutman, A., O’Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Castillon, N., et al. Polarized expression of cystic fibrosis transmembrane conductance regulator and associated epithelial proteins during the regeneration of human airway surface epithelium in three-dimensional culture. Laboratory Investigation. 82 (8), 989-998 (2002).
- Jorissen, M., Bessems, A. Normal ciliary beat frequency after ciliogenesis in nasal epithelial cells cultured sequentially as monolayer and in suspension. Acta Oto-Laryngologica. 115 (1), 66-70 (1995).
- Conger, B. T., et al. Comparison of cystic fibrosis transmembrane conductance regulator (CFTR) and ciliary beat frequency activation by the CFTR Modulators Genistein, VRT-532, and UCCF-152 in primary sinonasal epithelial cultures. JAMA Otolaryngology-Head & Neck Surgery. 139 (8), 822-827 (2013).
- Pique, N., De Servi, B. Rhinosectan((R)) spray (containing xyloglucan) on the ciliary function of the nasal respiratory epithelium; results of an in vitro study. Allergy, Asthma & Clinical Immunology. 14, 41 (2018).
- Chen, Q., et al. Host antiviral response suppresses ciliogenesis and motile ciliary functions in the nasal epithelium. Frontiers in Cell and Developmental Biology. 8, 581340 (2020).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Ballenger, J. J., Orr, M. F. Quantitative measurement of human ciliary activity. Annals of Otology, Rhinology and Laryngology. 72, 31-39 (1963).
- Mercke, U. The influence of varying air humidity on mucociliary activity. Acta Oto-Laryngologica. 79 (1-2), 133-139 (1975).
- Sutto, Z., Conner, G. E., Salathe, M. Regulation of human airway ciliary beat frequency by intracellular pH. Journal of Physiology. 560, 519-532 (2004).
- Salathe, M. Regulation of mammalian ciliary beating. Annual Review of Physiology. 69, 401-422 (2007).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of ciliary beat pattern in three different beating planes in healthy subjects. Chest. 151 (5), 993-1001 (2017).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Feriani, L., et al. Assessing the collective dynamics of motile cilia in cultures of human airway cells by multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Brewington, J. J., et al. Brushed nasal epithelial cells are a surrogate for bronchial epithelial CFTR studies. JCI Insight. 3 (13), (2018).
- Liu, X., et al. ROCK inhibitor and feeder cells induce the conditional reprogramming of epithelial cells. The American Journal of Pathology. 180 (2), 599-607 (2012).
- Suprynowicz, F. A., et al. Conditionally reprogrammed cells represent a stem-like state of adult epithelial cells. Proceedings of the National Academy of Sciences of the United States of America. 109 (49), 20035-20040 (2012).
- Martinovich, K. M., et al. Conditionally reprogrammed primary airway epithelial cells maintain morphology, lineage and disease specific functional characteristics. Scientific Reports. 7 (1), 17971 (2017).
- Wong, J. Y., Rutman, A., O’Callaghan, C. Recovery of the ciliated epithelium following acute bronchiolitis in infancy. Thorax. 60 (7), 582-587 (2005).
- Gentzsch, M., et al. Pharmacological rescue of conditionally reprogrammed cystic fibrosis bronchial epithelial cells. American Journal of Respiratory Cell and Molecular Biology. 56 (5), 568-574 (2017).
- Sommer, J. U., Gross, S., Hormann, K., Stuck, B. A. Time-dependent changes in nasal ciliary beat frequency. European Archives of Oto-Rhino-Laryngology. 267 (9), 1383-1387 (2010).
- Ratjen, F., et al. Cystic fibrosis. Nature Reviews Disease Primers. 1, 15010 (2015).
- Delmotte, P., Sanderson, M. J. Ciliary beat frequency is maintained at a maximal rate in the small airways of mouse lung slices. American Journal of Respiratory Cell and Molecular Biology. 35 (1), 110-117 (2006).
- Smith, C. M., et al. Cooling of cilia allows functional analysis of the beat pattern for diagnostic testing. Chest. 140 (1), 186-190 (2011).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).

