استخدام محلل التدفق الأيضي للخلايا في الوقت الفعلي لمراقبة الطاقة الحيوية لمنطقة العظام
Summary
يقيس فحص التدفق الأيضي للخلايا في الوقت الفعلي معدل استهلاك الأكسجين ومعدل التحمض خارج الخلية ، والذي يتوافق مع إنتاج الميتوكوندريا والأدينوسين ثلاثي الفوسفات المحلل للسكر ، باستخدام أجهزة استشعار الأس الهيدروجيني والأكسجين. تشرح المخطوطة طريقة لفهم حالة الطاقة للخلايا العظمية وتوصيف وتفسير حالة الطاقة الحيوية الخلوية.
Abstract
يعد تكوين العظام بواسطة الأرومات العظمية عملية أساسية لاكتساب العظام بشكل صحيح ودوران العظام للحفاظ على توازن الهيكل العظمي ، وفي النهاية ، منع الكسر. من أجل تحسين ذروة كتلة العظام ومكافحة الأمراض العضلية الهيكلية المختلفة (أي هشاشة العظام بعد انقطاع الطمث ، وفقدان الشهية العصبي ، وداء السكري من النوع 1 و 2) ، بذلت جهود لا تصدق في مجال بيولوجيا العظام لتوصيف الخلايا العظمية بشكل كامل طوال عملية التمايز الخاصة بها. بالنظر إلى الدور الأساسي للخلايا العظمية الناضجة في إفراز بروتينات المصفوفة وحويصلات التمعدن ، فقد لوحظ أن هذه العمليات تأخذ كمية لا تصدق من الطاقة الخلوية ، أو الأدينوسين ثلاثي الفوسفات (ATP). غالبا ما يشار إلى الحالة العامة للطاقة الخلوية باسم الطاقة الحيوية الخلوية ، وتتضمن سلسلة من التفاعلات الأيضية التي تستشعر توافر الركيزة لاشتقاق ATP لتلبية الاحتياجات الخلوية. لذلك ، فإن الطريقة الحالية تفصل عملية عزل الخلايا اللحمية الأولية لنخاع العظم الفئراني (BMSCs) ومراقبة حالتها الحيوية باستخدام محلل التدفق الأيضي للخلايا في الوقت الفعلي في مراحل مختلفة من تمايز الخلايا العظمية. الأهم من ذلك ، أظهرت هذه البيانات أن ملف التعريف الأيضي يتغير بشكل كبير خلال تمايز الخلايا العظمية. وبالتالي ، فإن استخدام هذا النوع من الخلايا ذات الصلة من الناحية الفسيولوجية مطلوب لتقدير كامل لكيفية تنظيم حالة الطاقة الحيوية للخلية للوظيفة العامة.
Introduction
ويرافق تكوين العظام بواسطة الأرومة العظمية تدمير منسق أو ارتشاف العظام بواسطة الخلايا الآكلة للعظام. التوازن بين تكوين العظام العظمية الأرومية وارتشاف الخلايا العظمية هو عملية مقترنة تصف دوران العظام أو إعادة تشكيلها ، وهو أمر ضروري لتوازن الهيكل العظمي. يؤدي خلل العظام إلى ضعف تكوين العظام ويؤدي إلى أمراض مختلفة ، بما في ذلك هشاشة العظام1،2،3. يؤدي التمايز خارج الجسم الحي / في المختبر للخلايا الجذعية اللحمية لنخاع العظم (BMSCs) إلى سلائف الخلايا العظمية العظمية والأرومات العظمية الناضجة إلى تكوين وترسب مصفوفة العظام المعدنية في وعاء الاستزراع بمرور الوقت4،5،6. يتطلب تكوين العظام هذا بواسطة الأرومة العظمية كمية كبيرة من الطاقة الخلوية. على وجه التحديد ، ثبت أن تخليق الكولاجين وإفرازه يعتمدان بشكل كبير على ATP الخلوي: نسب ADP ، ومن المفترض أن يتطلب الاتجار بالحويصلات المعدنية وإفرازهاATP إضافيا 7,8,9,10,11. وقد أثبت العديد من الباحثين أن عملية تكوين الخلايا الأرومية العظمية ووظيفة الأرومة العظمية تتطلب إمدادات كافية من الطاقة لتلبية الطلب الأيضي لتشكيل العظام12،13،14،15،16. لذلك ، فإن الهدف من هذه الطريقة هو توصيف حالة الطاقة الحيوية للخلايا اللحمية الأولية الفئرانية طوال تمايز الخلايا العظمية باستخدام محلل التدفق الأيضي للخلية في الوقت الفعلي. تساعد هذه التقنيات في تطوير فهم أفضل لتوازن الهيكل العظمي ، مما قد يؤدي في النهاية إلى تطوير خيارات علاجية جديدة قادرة على تحسين اضطرابات الهيكل العظمي.
يمكن استخدام محلل التدفق الأيضي للخلايا في الوقت الفعلي لقياس معدل استهلاك الأكسجين (OCR) ومعدل التحمض خارج الخلية (ECAR) للخلايا العظمية الحية ، والتي تتوافق مع إنتاج الميتوكوندريا و ATP المحللة للسكر ، على التوالي. من الأمور الأساسية لهذه المنهجية حقيقة أن أيون H+ واحد لكل لاكتات يتم إطلاقه أثناء تحلل السكر في تحويل الجلوكوز إلى لاكتات ، مما يغير درجة الحموضة في الوسائط المنعكسة في قيم ECAR. على العكس من ذلك ، خلال دورة TCA (حمض ثلاثي الكربوكسيليك) ، تنتج الفسفرة التأكسدية عبر الميتوكوندريا ثاني أكسيد الكربون2 عن طريق استخدام أو استهلاك الأكسجين ، وبالتالي فإن مراقبة OCR تعكس عملية التمثيل الغذائي هذه. يقيس المحلل كلا من OCR و ECAR في البيئة الدقيقة خارج الخلية في وقت واحد وفي الوقت الفعلي ، مما يسمح بإمكانات هائلة عند دراسة الطاقة الحيوية الخلوية 6,17. بالإضافة إلى ذلك ، فإن إجراء هذه الفحوصات بسيط نسبيا ويمكن تخصيصه بسهولة اعتمادا على الهدف التجريبي. تم استخدام تقنيات مماثلة لزيادة فهم التنظيم الأيضي للخلايا التائية للجهاز المناعي18,19 ، وبدء السرطان ، والتقدم 20 ، إلى جانب أنواع متعددة من الخلايا الأخرى التي تساهم في متلازمات التمثيل الغذائي21,22.
تشمل مزايا محلل التدفق الأيضي في الوقت الفعلي على التقنيات البديلة (1) القدرة على قياس الطاقة الحيوية الخلوية للخلايا الحية في الوقت الفعلي ، (2) القدرة على إجراء الفحص مع عدد صغير نسبيا من الخلايا (يتطلب ما يصل إلى 5000 خلية) ، (3) منافذ الحقن لمعالجة العلاجات المتعددة بالتوازي في نظام 96 بئرا عالي الإنتاجية ، (4) استخدام جهاز تصوير الخلايا الآلي الخالي من الملصقات المشعة للتطبيع18 ، 23,24. تهدف الطرق التالية إلى توفير وصف معمم ولكن مفصل لمراقبة الطاقة الحيوية الخلوية في BMSCs الفئران طوال تمايز الخلايا العظمية باستخدام المحلل. وسوف تشمل الفحوص التي تجرى بشكل روتيني. ومع ذلك ، كما هو الحال مع العديد من التقنيات والأساليب ، من المشجع للغاية أن تحدد المختبرات الفردية تفاصيل محددة لتجاربها.
اختيار المقايسة وأنواع مختلفة من المقايسات المتاحة: تتوفر مجموعة واسعة من مجموعات المقايسة والكواشف لدراسة الطاقة الحيوية للخلايا مع ضمان موثوقية واتساق النتائج التجريبية. بالإضافة إلى ذلك ، يوفر برنامج سطح المكتب أيضا قوالب فحص يمكن تخصيصها بسهولة. يمكن تعريف الفحص بناء على احتياجات المستخدم لقياس معلمات التمثيل الغذائي المختلفة. يمكن تعديل هذه الفحوصات بطرق مختلفة بناء على الهدف التجريبي و / أو السؤال العلمي. على سبيل المثال ، مع أربعة منافذ حقن ، يمكن حقن مركبات متعددة في وسائط الفحص لتحليل الاستجابة الخلوية الخاصة بكل مسار استقلابي.
اختبار النمط الظاهري لطاقة الخلية: يقيس هذا الفحص النمط الظاهري الأيضي للخلايا الحية وإمكانات التمثيل الغذائي. يوصى أيضا بإجراء هذا الفحص كخطوة أولى للحصول على فكرة عامة عن التمثيل الغذائي الخاص بالمسار. يتم حقن خليط من أوليغوميسين A-مثبط من سينثاز ATP وسيانيد الكربونيل 4-(ثلاثي فلوروميثوكسي) فينيل هيدرازون (FCCP) – وهو عامل فك ارتباط الميتوكوندريا لفهم إمكانات طاقة الخلية. حقن oligomycin A يمنع تخليق ATP ، مما يؤدي إلى زيادة في معدل تحلل السكر (ECAR) لتمكين الخلايا من تلبية احتياجاتها من الطاقة ؛ من ناحية أخرى ، يؤدي حقن FCCP إلى ارتفاع OCR بسبب إزالة استقطاب غشاء الميتوكوندريا. في الأساس ، يصور هذا الفحص التنفس الأيضي الأساسي ، وبعد الحقن المزدوج أو الدفع أو الإجهاد ، الاستجابة الأيضية. بناء على هذه المعلمات ، يقوم البرنامج بعد ذلك برسم OCR و ECAR للخلايا عن طريق تصنيف الخلايا على أنها حالة هوائية أو هادئة أو تحلل السكر أو نشطة بمرور الوقت25,26.
ATP في الوقت الحقيقي معدل الإنتاج: هذا يقيس إنتاج ATP الخلوي في وقت واحد من تحلل السكر والتنفس الميتوكوندريا. يقيس هذا الفحص كميا التحولات الأيضية من مساري الطاقة ويوفر بيانات عن معدلات إنتاج ATP للميتوكوندريا وتحلل السكر بمرور الوقت. يحصل الفحص على بيانات OCR و ECAR القاعدية متبوعة بحساب معدل إنتاج ATP الميتوكوندريا من خلال حقن oligomycin A ومعدل إنتاج ATP المحلل للسكر من خلال حقن خليط rotenone + antimycin A (التثبيط الكلي لوظيفة الميتوكوندريا) ، مما يؤدي إلى تحمض الميتوكوندريا17,27.
اختبار إجهاد الميتوكوندريا الخلوية (أو اختبار إجهاد ميتو الخلوي): هذا يقيس وظيفة الميتوكوندريا من خلال التنفس المرتبط ب ATP ، ويحدد كمية الطاقة الحيوية الخلوية ، ويحدد خلل الميتوكوندريا ، ويقيس استجابة الخلايا للإجهاد. يمكن الحصول على معلمات مختلفة ، بما في ذلك القدرة التنفسية القاعدية والاحتياطية ، والتنفس المرتبط ب ATP ، والتنفس الأقصى ، واستهلاك الأكسجين غير الميتوكوندريا ، في فحص واحد. يتضمن هذا الفحص حقن متسلسلة من oligomycin A ، FCCP (عامل فك ارتباط الميتوكوندريا) ، وهو مزيج من مثبطات الروتينون / antimycin A لتحليل تأثير هذه بكفاءة على وظيفة الميتوكوندريا28.
اختبار مرونة ميتو للوقود المرن: هذا يقيس معدل التنفس الميتوكوندريا عن طريق أكسدة وقود الميتوكوندريا الرئيسي الثلاثة من خلال وجود وغياب مثبطاتها. يساعد التثبيط المتسلسل للجلوكوز والجلوتامين والأحماض الدهنية في قياس اعتماد الخلايا وقدرتها ومرونتها واعتماد الخلايا في مسارات خلوية مختلفة لتلبية الطلب على الطاقة. عندما لا تستطيع الميتوكوندريا تلبية متطلبات المسار المسدود للاهتمام عن طريق أكسدة أنواع الوقود الأخرى ، تدخل الخلايا في حالة تبعية. يتم حساب قدرة الخلايا عن طريق تثبيط المسارين البديلين الآخرين متبوعا بتثبيط مسار الاهتمام. تساعد مرونة الخلايا في فهم قدرة الميتوكوندريا على تعويض وتلبية احتياجات الوقود للمسار المثبط. يتم حسابه عن طريق طرح تبعية الخلايا من قدرة الخلايا. يتم استخدام ثلاثة مثبطات مختلفة بشكل مستقل أو كمزيج من اثنين لحساب معلمات الفحص بشكل فعال. 2-سيانو-3-(1-فينيل-1H-إندول-3-يل)-2-حمض البروبينويك (UK5099) يمنع أكسدة الجلوكوز عن طريق منع الناقل البيروفات في تحلل السكر. Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl) (BPTES) يمنع كبريتيد الإيثيل مسار أكسدة الجلوتامين ، ويمنع etomoxir أكسدة الأحماض الدهنية طويلة السلسلة29.
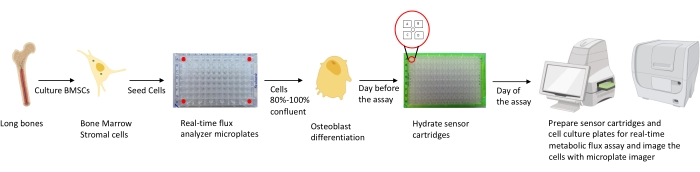
الشكل 1: التمثيل التخطيطي لمنهجية زراعة وإعداد الخلايا العظمية للتحليل. يتم عزل المورين BMSCs من العظام الطويلة ، وزرعها ، وزرعها في صفائح 96 بئرا بكثافة 25000 خلية / بئر. يبدأ زراعة هذه الخلايا في وسائط Osteoblast المحددة عندما تصل إلى 80٪ -100٪ من الالتقاء لبدء تمايزها. يتم إجراء الفحوصات في مراحل مختلفة من التمايز. يتم ترطيب ألواح الخرطوشة قبل يوم واحد من الفحص. في يوم الفحص ، يتم حقن مثبطات مختلفة في منافذ خراطيش المستشعر بناء على متطلبات الفحص ، ويضاف مخزن مؤقت للمعايرة إلى لوحة المعايرة المكونة من 96 بئرا. بعد المعايرة ، يتم إجراء اختبار التدفق الأيضي للخلية في الوقت الفعلي ، يليه تصوير الصفيحة الدقيقة لزراعة الخلايا باستخدام جهاز تصوير الصفائح الدقيقة لتطبيع بيانات محلل التدفق الأيضي للخلية في الوقت الفعلي مع عدد الخلايا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
يمكن استخدام محلل التدفق الأيضي للخلايا في الوقت الفعلي لاستكشاف الطاقة الخلوية في ظل ظروف مختلفة. يوضح البروتوكول العزل الفعال ل BMSCs ، وزراعة الخلايا في لوحات زراعة الخلايا المناسبة ، وتمايزها إلى الخلايا العظمية الناضجة ، والتي يمكن استخدامها لمختلف الفحوصات باستخدام محلل التدفق خارج …
Divulgations
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من قبل المعهد الوطني للصحة (NIH) والمعهد الوطني لالتهاب المفاصل والأمراض العضلية الهيكلية والجلدية (NIAMS) منحة AR072123 والمعهد الوطني للشيخوخة (NIA) منحة AG069795 (إلى ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

