リアルタイム細胞代謝フラックス分析装置を使用して骨芽細胞生体エネルギーをモニタリング
Summary
リアルタイム細胞代謝フラックスアッセイは、pHおよび酸素センサを使用して、ミトコンドリアおよび解糖系アデノシン三リン酸産生に対応する酸素消費速度および細胞外酸性化速度を測定する。原稿では、骨芽細胞のエネルギー状態と細胞の生体エネルギー状態の特徴付けと解釈を理解するための方法を説明しています。
Abstract
骨芽細胞による骨形成は、骨格の恒常性を維持し、最終的には骨折を防ぐために、適切な骨獲得と骨代謝回転に不可欠なプロセスです。ピーク骨量を最適化し、様々な筋骨格疾患(すなわち、閉経後骨粗鬆症、神経性食欲不振、1型および2型真性糖尿病)と戦うために、骨生物学の分野では、骨芽細胞の分化プロセス全体にわたって完全に特徴付けるための信じられないほどの努力がなされてきた。マトリックスタンパク質および石灰化小胞を分泌する成熟骨芽細胞の主な役割を考えると、これらのプロセスは信じられないほどの量の細胞エネルギー、またはアデノシン三リン酸(ATP)を必要とすることが注目されている。全体的な細胞エネルギー状態は、しばしば細胞生体エネルギー学と呼ばれ、細胞のニーズを満たすためにATPを導出するための基質の利用可能性を感知する一連の代謝反応を含む。したがって、現在の方法は、初代マウス骨髄間質細胞(BMSC)を単離し、骨芽細胞分化の様々な段階でリアルタイム細胞代謝フラックス分析装置を使用してそれらの生体エネルギー状態を監視するプロセスを詳述する。重要なことに、これらのデータは、代謝プロファイルが骨芽細胞分化を通して劇的に変化することを実証した。したがって、この生理学的に関連する細胞型を使用することは、細胞の生体エネルギー状態が全体的な機能を調節する方法を十分に理解するために必要である。
Introduction
骨芽細胞による骨の形成は、破骨細胞による骨の協調的な破壊または再吸収を伴う。骨芽球性骨形成と破骨細胞再吸収との間のバランスは、骨格恒常性維持に不可欠な骨代謝回転またはリモデリングを記述する結合プロセスである。骨芽細胞機能障害は、骨形成の障害をもたらし、骨粗鬆症を含む様々な疾患をもたらす1,2,3。骨髄間質幹細胞(BMSC)から骨芽細胞前駆体および成熟骨芽細胞へのエクスビボ/インビトロ分化は、経時的に培養容器内の石灰化骨マトリックスの形成および沈着をもたらす4,5,6。骨芽細胞によるこの骨形成は、かなりの量の細胞エネルギーを必要とする。具体的には、コラーゲン合成および分泌は、細胞ATP:ADP比に大きく依存することが示されており、おそらく、石灰化小胞の輸送および分泌は、追加のATP7、8、9、10、11を必要とする。多くの研究者は、骨芽細胞形成および骨芽細胞機能のプロセスが、骨形成の代謝需要を満たすために十分なエネルギー供給を必要とすることを実証している12,13,14,15,16。したがって、この方法の目標は、リアルタイム細胞代謝フラックス分析装置を用いて骨芽細胞分化全体を通して初代マウス間質細胞の生体エネルギー状態を特徴付けることである。これらの技術は、骨格恒常性の理解を深めるのに役立ち、最終的には骨格障害を改善することができる新規な治療選択肢の開発につながる可能性がある。
リアルタイム細胞代謝フラックス分析装置は、それぞれミトコンドリアおよび解糖系ATP産生に対応する生骨芽細胞の酸素消費速度(OCR)および細胞外酸性化速度(ECAR)を測定するために使用することができる。この方法論の基本的なことは、グルコースから乳酸への変換において解糖系中に乳酸塩あたり1つのH+イオンが放出され、ECAR値に反映された媒体pHを変化させるという事実である。逆に、TCA(トリカルボン酸)サイクルの間、ミトコンドリアを介した酸化的リン酸化は、酸素を利用または消費することによってCO2を生成するため、OCRのモニタリングはこの代謝プロセスを反映している。このアナライザは、細胞外微小環境におけるOCRとECARの両方を同時にリアルタイムで測定するため、細胞の生体エネルギーを研究する際に大きな可能性を秘めています6,17。さらに、これらのアッセイの実行は比較的簡単で、実験目標に応じて簡単にカスタマイズできます。同様の技術が、免疫系18、19、癌開始、および進行20のT細胞代謝調節を、メタボリックシンドローム21、22に寄与する複数の他の細胞型とともにさらに理解するために採用されている。
代替技術に対するリアルタイム代謝フラックス分析装置の利点には、(1)生細胞の細胞生体エネルギーをリアルタイムで測定する能力、(2)比較的少数の細胞でアッセイを行う能力(5,000細胞という低い細胞が必要)、(3)ハイスループット96ウェルシステムで複数の治療を並行して操作する注入ポート、(4)正規化のための放射性ラベルフリー自動細胞イメージャの使用18、23,24。以下の方法は、分析装置を用いた骨芽細胞分化全体を通してマウスBMSCにおける細胞生体エネルギー学のモニタリングに関する一般化されたが詳細な説明を提供することを目的としている。これには、日常的に行われるアッセイが含まれます。ただし、多くの手法や方法と同様に、個々のラボが実験の具体的な詳細を決定することを強くお勧めします。
アッセイの選択と利用可能なさまざまな種類のアッセイ:実験結果の信頼性と一貫性を確保しながら、細胞の生体エネルギー学を研究するために、多種多様なアッセイキットと試薬が利用可能です。さらに、デスクトップソフトウェアは、簡単にカスタマイズできるアッセイテンプレートも提供します。アッセイは、異なる代謝パラメータを測定するユーザのニーズに基づいて定義することができる。これらのアッセイは、実験目標および/または科学的質問に基づいて様々な方法で修正することができる。例えば、4つの注入ポートを用いて、複数の化合物をアッセイ培地に注入して、各代謝経路に特異的な細胞応答を分析することができる。
細胞エネルギー表現型試験:このアッセイは、生細胞の代謝表現型および代謝能を測定する。このアッセイは、経路特異的代謝の一般化されたアイデアを得るための第一歩としても推奨されます。ATP合成酵素の阻害剤であるオリゴマイシンA-と、ミトコンドリア脱共役剤であるカルボニルシアン化物4-(トリフルオロメトキシ)フェニルヒドラゾン(FCCP)-の混合物を注入し、細胞エネルギーポテンシャルを理解する。オリゴマイシンAの注射は、ATPの合成を阻害し、細胞がエネルギー需要を満たすことを可能にする解糖系(ECAR)の割合を増加させる。一方、FCCPの注射は、ミトコンドリア膜の脱分極のためにより高いOCRをもたらす。本質的に、このアッセイは、基礎代謝呼吸、および二重注射、プッシュ、またはストレスに続く代謝応答を描写する。これらのパラメータに基づいて、ソフトウェアは、細胞を経時的に好気的、静止状態、解糖系、またはエネルギー状態として分類することによって、細胞のOCRおよびECARをプロットする25,26。
ATPリアルタイム生産速度アッセイ: これは、解糖系およびミトコンドリア呼吸からの細胞ATP産生を同時に測定する。このアッセイは、2つのエネルギー経路からの代謝シフトを定量的に測定し、経時的なミトコンドリアおよび解糖系ATP産生速度に関するデータを提供する。アッセイは、基礎OCRおよびECARデータを取得し、続いて、オリゴマイシンAの注射によるミトコンドリアATP産生速度およびロテノン+アンチマイシンA混合物の注射による解糖系ATP産生速度(ミトコンドリア機能の総阻害)を計算し、ミトコンドリア酸性化をもたらす17、27。
細胞ミトコンドリアストレス試験(または細胞ミトストレス試験):これは、ATP結合呼吸を介してミトコンドリア機能を測定し、細胞の生体エネルギー学を定量化し、ミトコンドリア機能不全を同定し、ストレスに対する細胞の応答を測定する。基礎呼吸能力および予備呼吸能力、ATP結合呼吸、最大呼吸、および非ミトコンドリア酸素消費を含む様々なパラメータを、1つのアッセイで得ることができる。このアッセイは、オリゴマイシンA、FCCP(ミトコンドリア脱共役剤)、ロテノン/アンチマイシンA阻害剤の混合物の逐次注射を含み、ミトコンドリア機能に対するこれらの影響を効率的に分析する28。
柔軟性水戸燃料フレックステスト: これは、それらの阻害剤の有無による3つの主要なミトコンドリア燃料の酸化によるミトコンドリア呼吸数を測定する。グルコース、グルタミン、および脂肪酸の逐次阻害は、エネルギー需要を満たすために、細胞の依存性、容量、および柔軟性、ならびに様々な細胞経路における細胞の依存性を測定するのに役立つ。ミトコンドリアが他の燃料を酸化することによって目的の経路の遮断された要求を満たすことができないとき、細胞は依存状態に入る。細胞の容量は、他の2つの代替経路の阻害とそれに続く目的の経路の阻害によって計算される。細胞の柔軟性は、ミトコンドリアが阻害された経路の燃料ニーズを補償し、満たす能力を理解するのに役立ちます。これは、細胞の容量から細胞の依存性を差し引くことによって計算されます。3つの異なる阻害剤を独立して、または2つの混合物として使用して、アッセイパラメータを効果的に計算する。2-シアノ-3-(1-フェニル-1H-インドール-3-イル)-2-プロペン酸(UK5099)は、解糖系中のピルビン酸担体を遮断することによってグルコースの酸化を阻害する。ビス−2−(5−フェニルアセトアミド−1,3,4−チアジアゾール−2−イル)(BPTES)エチルスルフィドはグルタミン酸化経路を阻害し、エトモキシルは長鎖脂肪酸の酸化を阻害する29。
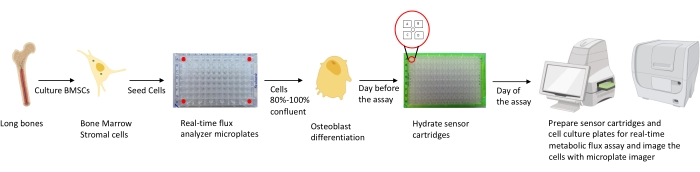
図1:分析のために骨芽細胞を培養および調製するための方法論の概略図。 マウスBMSCは長骨から単離され、培養され、25,000細胞/ウェル密度で96ウェルプレートに播種される。これらの細胞を骨芽細胞特異的培地中で培養することは、それらが80%〜100%コンフルエントに達したときに開始され、それらの分化を開始する。アッセイは、分化の異なる段階で行われる。カートリッジプレートをアッセイの1日前に水和させる。アッセイ当日、アッセイ要件に基づいて異なる阻害剤をセンサーカートリッジのポートに注入し、校正バッファーを96ウェル校正プレートに添加します。較正後、リアルタイム細胞代謝フラックスアッセイが行われ、続いてマイクロプレートイメージャを用いて細胞培養マイクロプレートを画像化することにより、リアルタイム細胞代謝フラックス分析計データを細胞数で正規化する。 この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
リアルタイムの細胞代謝フラックス分析装置は、さまざまな条件下で細胞エネルギーを探索するために使用できます。このプロトコルは、BMSCの効率的な単離、適切な細胞培養プレートでの細胞の培養、および成熟骨芽細胞への分化を示しており、細胞外フラックス分析装置を使用したさまざまなアッセイに使用できます。さらに、センサーカートリッジの水和、注入ポートの装填、アッセイ…
Divulgations
The authors have nothing to disclose.
Acknowledgements
この研究は、国立衛生研究所(NIH)国立関節炎・筋骨格・皮膚疾患研究所(NIAMS)グラントAR072123および国立加齢研究所(NIA)グラントAG069795(ERRへ)の支援を受けた。
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

