Använda realtidscellmetabolisk flödesanalysator för att övervaka osteoblastbioenergetik
Summary
Realtidscellmetabolisk flödesanalys mäter syreförbrukningshastigheten och extracellulär försurningshastighet, vilket motsvarar mitokondriell och glykolytisk adenosintrifosfatproduktion, med hjälp av pH- och syresensorer. Manuskriptet förklarar en metod för att förstå osteoblasternas energistatus och karakteriseringen och tolkningen av den cellulära bioenergetiska statusen.
Abstract
Benbildning av osteoblaster är en viktig process för korrekt benförvärv och benomsättning för att upprätthålla skeletthomeostas och i slutändan förhindra fraktur. I intresse för att både optimera toppbenmassan och bekämpa olika muskuloskeletala sjukdomar (dvs. postmenopausal osteoporos, anorexia nervosa, typ 1 och 2 diabetes mellitus) har otroliga ansträngningar gjorts inom benbiologi för att fullt ut karakterisera osteoblaster under hela deras differentieringsprocess. Med tanke på den primära rollen hos mogna osteoblaster för att utsöndra matrisproteiner och mineraliseringsblåsor har det noterats att dessa processer tar en otrolig mängd cellulär energi eller adenosintrifosfat (ATP). Den övergripande cellulära energistatusen kallas ofta cellulär bioenergetik, och den innehåller en serie metaboliska reaktioner som känner av substrattillgänglighet för att härleda ATP för att möta cellulära behov. Därför beskriver den nuvarande metoden processen att isolera primära, murina benmärgsstromalceller (BMSC) och övervaka deras bioenergetiska status med hjälp av realtidscellmetabolisk flödesanalysator i olika stadier i osteoblastdifferentiering. Viktigt är att dessa data har visat att den metaboliska profilen förändras dramatiskt under osteoblastdifferentiering. Således krävs användning av denna fysiologiskt relevanta celltyp för att fullt ut uppskatta hur en cells bioenergetiska status kan reglera den övergripande funktionen.
Introduction
Benbildningen av osteoblasten åtföljs av samordnad förstörelse eller resorption av ben genom osteoklaster. Balansen mellan osteoblastisk benbildning och osteoklastresorption är en kopplad process som beskriver benomsättning eller ombyggnad, vilket är viktigt för skeletthomeostas. Osteoblastdysfunktion leder till nedsatt benbildning och resulterar i olika sjukdomar, inklusive osteoporos 1,2,3. Ex vivo/in vitro-differentiering av benmärgsstromala stamceller (BMSC) till osteoblastprekursorer och mogna osteoblaster resulterar i bildandet och avsättningen av den mineraliserade benmatrisen i odlingskärlet över tid 4,5,6. Denna benbildning av osteoblasten kräver en betydande mängd cellulär energi. Specifikt har kollagensyntes och utsöndring visat sig vara starkt beroende av cellulär ATP: ADP-förhållanden, och förmodligen kräver mineraliserad vesikolhandel och utsöndring ytterligare ATP 7,8,9,10,11. Många forskare har visat att processen med osteoblastogenes och osteoblastfunktion kräver en tillräcklig energiförsörjning för att möta den metaboliska efterfrågan på benbildning 12,13,14,15,16. Därför är målet med denna metod att karakterisera den bioenergetiska statusen för primära, murina stromala celler under osteoblastdifferentiering med användning av realtidscellmetabolisk flödesanalysator. Dessa tekniker hjälper till att utveckla en bättre förståelse för skeletthomeostas, vilket i slutändan kan leda till utvecklingen av nya terapeutiska alternativ som kan förbättra skelettsjukdomar.
Realtidscellmetabolisk flödesanalysator kan användas för att mäta syreförbrukningshastigheten (OCR) och extracellulär försurningshastighet (ECAR) för levande osteoblaster, vilket motsvarar mitokondriell respektive glykolytisk ATP-produktion. Grundläggande för denna metod är det faktum att en H + -jon per laktat frigörs under glykolys vid omvandling av glukos till laktat, vilket förändrar medias pH som återspeglas i ECAR-värdena. Omvänt, under TCA-cykeln (trikarboxylsyra), producerar oxidativ fosforylering via mitokondrierna CO2 genom att använda eller konsumera syre, och därför är övervakning av OCR reflekterande av denna metaboliska process. Analysatorn mäter både OCR och ECAR i den extracellulära mikromiljön samtidigt och i realtid, vilket möjliggör enorm potential när man studerar cellulär bioenergetik 6,17. Dessutom är det relativt enkelt att utföra dessa analyser och lätt anpassningsbart beroende på det experimentella målet. Liknande tekniker har använts för att ytterligare förstå T-cellsmetabolisk reglering av immunsystemet18,19, cancerinitiering och progression20, tillsammans med flera andra celltyper som bidrar till metaboliska syndrom21,22.
Fördelarna med metabolisk flödesanalysator i realtid jämfört med alternativa tekniker inkluderar (1) förmågan att mäta cellulär bioenergetik hos levande celler i realtid, (2) förmåga att utföra analys med ett relativt litet antal celler (kräver så lågt som 5 000 celler), (3) injektionsportar för att parallellt manipulera flera behandlingar i ett 96-brunnssystem med hög genomströmning, (4) användning av radioaktiv etikettfri automatiserad cellbildare för normalisering18, 23,24. Följande metoder syftar till att ge en generaliserad men detaljerad beskrivning av övervakning av cellulär bioenergetik i murina BMSC under osteoblastdifferentiering med hjälp av analysatorn. Det kommer att innehålla rutinmässigt utförda analyser; Men som med många tekniker och metoder uppmuntras det starkt att enskilda laboratorier bestämmer specifika detaljer för sina experiment.
Urval av analyser och olika typer av analyser tillgängliga: Ett brett utbud av analyssatser och reagenser finns tillgängliga för att studera cellernas bioenergetik samtidigt som tillförlitligheten och konsistensen av de experimentella resultaten säkerställs. Dessutom erbjuder skrivbordsprogramvaran också analysmallar som enkelt kan anpassas. Analysen kan definieras utifrån användarens behov av att mäta olika metaboliska parametrar. Dessa analyser kan modifieras på olika sätt baserat på det experimentella målet och / eller den vetenskapliga frågan. Till exempel, med fyra injektionsportar, kan flera föreningar injiceras i analysmediet för att analysera det cellulära svaret som är specifikt för varje metabolisk väg.
Cellenergi fenotyp test: Denna analys mäter de levande cellernas metaboliska fenotyp och metaboliska potential. Denna analys rekommenderas också som det första steget för att få en generaliserad uppfattning om vägspecifik metabolism. En blandning av oligomycin A-en-hämmare av ATP-syntas och karbonylcyanid 4-(trifluormetoxi) fenylhydrazon (FCCP) – ett mitokondriellt frikopplingsmedel injiceras för att förstå cellenergipotentialen. Injektionen av oligomycin A hämmar syntesen av ATP, vilket resulterar i en ökning av glykolyshastigheten (ECAR) för att göra det möjligt för cellerna att uppfylla sina energibehov; å andra sidan resulterar injektionen av FCCP i högre OCR på grund av depolarisering av mitokondriellt membran. I huvudsak visar denna analys basal metabolisk andning, och efter de dubbla injektionerna, tryck eller påfrestningar, det metaboliska svaret. Baserat på dessa parametrar plottar programvaran sedan OCR och ECAR av cellerna genom att klassificera cellerna som aeroba, vilande, glykolytiska eller energiska tillstånd över tiden25,26.
ATP-analys av produktionshastighet i realtid: Detta mäter den cellulära ATP-produktionen samtidigt från glykolys och mitokondriell andning. Denna analys mäter kvantitativt de metaboliska förändringarna från de två energivägarna och ger data om mitokondriella och glykolytiska ATP-produktionshastigheter över tiden. Analysen erhåller basala OCR- och ECAR-data följt av beräkning av mitokondriell ATP-produktionshastighet genom injektion av oligomycin A och glykolytisk ATP-produktionshastighet genom injektion av rotenon + antimycin A-blandning (total hämning av mitokondriell funktion), vilket resulterar i mitokondriell försurning17,27.
Stresstest för cellmitokondrier (eller stresstest för cellmito): Detta mäter mitokondriell funktion genom ATP-kopplad andning, kvantifierar cellulär bioenergetik, identifierar mitokondriell dysfunktion och mäter cellernas svar på stress. Olika parametrar, inklusive basal och reserv andningskapacitet, ATP-kopplad andning, maximal andning och icke-mitokondriell syreförbrukning, kan erhållas i en analys. Denna analys innefattar sekventiella injektioner av oligomycin A, FCCP (mitokondriellt frikopplingsmedel), en blandning av rotenon/antimycin A-hämmare för att effektivt analysera effekten av dessa på mitokondriell funktion28.
Flexibilitet mito bränsle flex test: Detta mäter mitokondriell andningshastighet genom oxidation av de tre primära mitokondriella bränslena genom närvaron och frånvaron av deras hämmare. Den sekventiella hämningen av glukos, glutamin och fettsyror hjälper till att mäta cellernas beroende, kapacitet och flexibilitet och cellernas beroende i olika cellulära vägar för att möta energibehovet. När mitokondrierna inte kan uppfylla kraven från den blockerade vägen av intresse genom att oxidera andra bränslen, går cellerna in i ett beroendetillstånd. Cellernas kapacitet beräknas genom hämning av de andra två alternativa vägarna följt av hämning av den intressanta vägen. Cellernas flexibilitet hjälper till att förstå mitokondriernas förmåga att kompensera och möta bränslebehoven hos den hämmade vägen. Det beräknas genom att subtrahera cellernas beroende från cellernas kapacitet. Tre olika hämmare används oberoende eller som en blandning av två för att effektivt beräkna analysparametrarna. 2-cyano-3-(1-fenyl-1H-indol-3-yl)-2-propensyra (UK5099) hämmar oxidationen av glukos genom att blockera pyruvatbäraren vid glykolys. Bis-2-(5-fenylacetamido-1,3,4-tiadiazol-2-yl) (BPTES) etylsulfid hämmar glutaminoxidationsvägen och etomoxir hämmar oxidationen av långkedjiga fettsyror29.
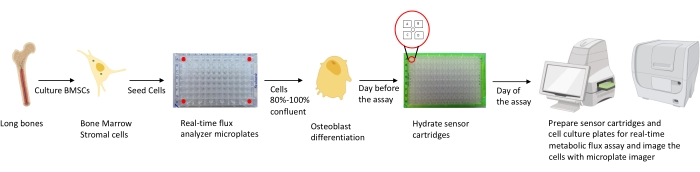
Figur 1: Schematisk representation av metoden för odling och beredning av osteoblaster för analys. Murina BMSC isoleras från långa ben, odlas och frös i 96-brunnsplattor vid 25 000 celler / brunnsdensitet. Odling av dessa celler i osteoblastspecifika medier startas när de når 80% -100% sammanflöde för att starta sin differentiering. Analyserna utförs i olika stadier av differentiering. Patronplattorna hydreras en dag före analysen. På analysdagen injiceras olika hämmare i portarna på sensorpatronerna baserat på analyskraven, och en kalibreringsbuffert läggs till 96-brunnskalibreringsplattan. Efter kalibrering utförs realtidscellens metaboliska flödesanalys, följt av avbildning av cellodlingsmikroplattan med hjälp av mikroplattbildaren för att normalisera realtidsdata för cellmetaboliska flödesanalysatorer med cellantal. Klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
Realtidscellens metaboliska flödesanalysator kan användas för att utforska cellulär energi under olika förhållanden. Protokollet illustrerar effektiv isolering av BMSC, odlingsceller i lämpliga cellodlingsplattor och deras differentiering till mogna osteoblaster, som kan användas för olika analyser med hjälp av den extracellulära flödesanalysatorn. Vidare förklaras de kritiska stegen i realtid cellmetabolisk flödesanalys, inklusive hydrering av sensorpatroner, laddning av injektionsportarna, utförande av a…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av National Institute of Health (NIH) National Institute of Arthritis and Musculoskeletal and Skin Diseases (NIAMS) Grant AR072123 och National Institute on Aging (NIA) Grant AG069795 (till ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

