Ölçeklenebilir İzolasyon ve Escherichia coli ve Diğer Bakterilerden Hücre Dışı Veziküllerin Saflaştırılması
Summary
Bakteriler, biyoaktif biyolojik moleküller taşıyan nanometre boyutunda hücre dışı veziküller (EV’ler) salgılarlar. EV araştırması, biyogenezlerini, mikrop-mikrop ve konakçı-mikrop etkileşimlerindeki rollerini ve bunların potansiyel terapötik uygulamalarını anlamaya odaklanmaktadır. EV araştırmalarının standardizasyonunu kolaylaştırmak için EV’lerin çeşitli bakterilerden ölçeklenebilir izolasyonu için bir iş akışı sunulmaktadır.
Abstract
Çeşitli bakteri türleri, lipitler, proteinler, nükleik asitler, glikanlar ve ebeveyn hücrelerden türetilen diğer moleküllerden oluşan ~ 20-300 nm hücre dışı veziküller (EV’ler) salgılar. EV’ler, türler arası ve türler arası iletişim vektörleri olarak işlev görürken, aynı zamanda enfeksiyon ve kolonizasyon bağlamında bakteri ve konakçı organizmalar arasındaki etkileşime katkıda bulunur. Sağlık ve hastalıkta EV’lere atfedilen çok sayıda fonksiyon göz önüne alındığında, EV’leri in vitro ve in vivo çalışmalar için izole etmeye yönelik artan bir ilgi vardır. EV’lerin fiziksel özelliklere, yani boyuta göre ayrılmasının, veziküllerin çeşitli bakteri kültürlerinden izolasyonunu kolaylaştıracağı varsayılmıştır.
İzolasyon iş akışı, EV’lerin bakteri kültürlerinden izolasyonu için santrifüjleme, filtreleme, ultrafiltrasyon ve boyut dışlama kromatografisinden (SEC) oluşur. Ölçeklenebilirliği artırmak için pompa tahrikli teğetsel akış filtrasyonu (TFF) adımı dahil edildi ve malzemenin litre başlangıç hücresi kültüründen izole edilmesini sağladı. Escherichia coli , EV ile ilişkili nanolusiferaz ve EV ile ilişkili olmayan mCherry’yi muhabir proteinler olarak ifade eden bir model sistem olarak kullanılmıştır. Nanolusiferaz, N-terminusunu sitolisin A ile kaynaştırarak EV’lere hedeflendi. İlişkili sitolisin A – nanoLuc ile ilişkili 20-100 nm EV’ler içeren erken kromatografi fraksiyonları, serbest proteinleri içeren daha sonraki fraksiyonlardan farklıydı. EV ile ilişkili nanolusiferazın varlığı, immünogold etiketleme ve transmisyon elektron mikroskobu ile doğrulandı. Bu EV izolasyon iş akışı, diğer insan bağırsağı ile ilişkili gram-negatif ve gram-pozitif bakteri türlerine uygulanabilir. Sonuç olarak, santrifüjleme, filtrasyon, ultrafiltrasyon / TFF ve SEC’nin birleştirilmesi, EV’lerin çeşitli bakteri türlerinden ölçeklenebilir izolasyonunu sağlar. Standartlaştırılmış bir izolasyon iş akışının kullanılması, türler arasında mikrobiyal EV’lerin karşılaştırmalı çalışmalarını kolaylaştıracaktır.
Introduction
Hücre dışı veziküller (EV’ler), hem prokaryotik hem de ökaryotik hücreler tarafından salgılanan lipitler, proteinler, glikanlar ve nükleik asitlerden oluşan nanometre boyutunda, lipozom benzeri yapılardır1. EV’lerin gram-negatif bakterilerden salınımını görselleştiren ilk çalışmalardan bu yana, bakteriyel EV’lere (çapı 20-300 nm) atfedilen biyolojik fonksiyonların sayısı son yıllarda sürekli artmaktadır. İşlevleri arasında antibiyotik direncinin aktarılması3, biyofilm oluşumu4, çekirdek algılama5 ve toksin dağıtımı6 bulunur. Bakteriyel EV’lerin terapötik olarak kullanılmasına, özellikle aşıbilimi 7 ve kanser tedavisi8’de artan bir ilgi vardır.
EV araştırmalarına artan ilgiye rağmen, izolasyon yöntemleriyle ilgili hala teknik zorluklar var. Spesifik olarak, tekrarlanabilir, ölçeklenebilir ve çeşitli EV üreten organizmalarla uyumlu izolasyon yöntemlerine ihtiyaç vardır. EV izolasyonu ve araştırma yöntemlerini planlamak ve raporlamak için birleşik bir ilkeler kümesi oluşturmak için, Uluslararası Hücre Dışı Veziküller Derneği, MISEV pozisyon makalesi9’u yayınlar ve günceller. Ayrıca, EV-TRACK konsorsiyumu, şeffaflığı artırmak için yayınlanan makalelerde kullanılan EV izolasyonu için ayrıntılı metodolojileri raporlamak için açık bir platform sağlar10.
Bu protokolde, EV’lerin memeli hücre kültüründen izolasyonu için kullanılan önceki metodolojiler, EV’lerin bakteriyel hücre kültüründen izole edilmesini sağlamak için 11,12 uyarlanmıştır. Ölçeklenebilir olabilen çeşitli mikroplardan EV izolasyonunu sağlayan ve EV saflığını ve verimini dengeleyen yöntemler kullanmaya çalıştık (MISEV pozisyon kağıdı9’da tartışıldığı gibi). Santrifüjleme ve filtreleme yoluyla bakteri hücrelerini ve kalıntıları temizledikten sonra, kültür ortamı ya santrifüj cihazı ultrafiltrasyonu (~ 100 mL’ye kadar bir hacim için) veya pompa tahrikli TFF (daha büyük hacimler için) ile konsantre edilir. EV’ler daha sonra küçük EV’lerin saflaştırılması için optimize edilmiş sütunlar kullanılarak SEC tarafından izole edilir.
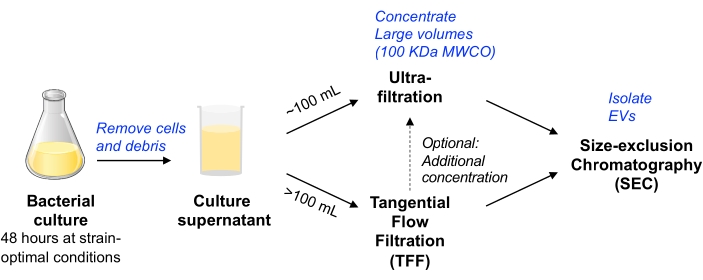
Şekil 1: Bakteriyel EV izolasyonu iş akışı şemasına genel bakış. Kısaltmalar: EV = hücre dışı vezikül; TFF = teğetsel akış filtrasyonu; SEC = boyut dışlama kromatografisi; MWCO = moleküler ağırlık kesme. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Escherichiacoli’nin bir fare-kommensal suşu (yani, E. coli MP113) model bir organizma olarak kullanılmış ve daha önce bildirildiği gibi sitolisin A’ya füzyon yoluyla EV-ilişkili nanolusiferazı eksprese etmek için modifiye edilmiştir14. Burada kullanılan yöntemler, en az birkaç litreye kadar bakteri kültürünü işleyebilir ve EV ile ilişkili olmayan proteinleri etkili bir şekilde ayırabilir. Son olarak, bu yöntem diğer gram-pozitif ve gram-negatif bakteri türleri için de kullanılabilir. Bildirilen deneylerin ilgili tüm verileri EV-TRACK bilgi tabanına (EV-TRACK ID: EV210211)10 sunulmuştur.
Protocol
Representative Results
Discussion
Yukarıdaki protokolde, ölçeklenebilir ve EV’leri çeşitli gram-negatif / pozitif ve aerobik / anaerobik bakterilerden güvenilir bir şekilde izole eden bir yöntem açıklanmaktadır. Prosedür boyunca birkaç potansiyel durma noktasına sahiptir, ancak EV’leri şartlandırılmış bakteri kültürü ortamından izole etmek için 48 saatten daha uzun sürmekten kaçınmak daha iyidir.
İlk olarak, şartlandırılmış bakteri kültürü ortamı oluşturmak için bakteri kültürlemesinden…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Yukarıda açıklanan araştırma NIH TL1 TR002549-03 eğitim desteği ile desteklenmiştir. Dr. John C. Tilton ve Zachary Troyer’e (Case Western Reserve University) partikül boyutu analizörü cihazına erişimi kolaylaştırdıkları için teşekkür ederiz; Lew Brown (Spectradyne), partikül boyutu dağılım verilerinin analizinde teknik yardım için; Cornell Üniversitesi’nden Dr. David Putnam, pClyA-GFP plazmid14’ü sağladığı için; ve bize E. coli MP113’ü sağladığı için Pennsylvania Üniversitesi’nden Dr. Mark Goulian.
Materials
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6×500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE |
One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
References
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).

