İnsan Monosit Kaynaklı Makrofajlarda İnflamatuar Kaspazların İndüklenen Yakınlığının Görselleştirilmesi
Summary
Bu protokol, insan kan örneklerinden monosit türevi makrofajlar (MDM) elde etmek için iş akışını, enflamatuar kaspaz Bimoleküler Floresan Kompleman (BiFC) muhabirlerini hücre canlılığı ve davranışından ödün vermeden insan MDM’sine verimli bir şekilde tanıtmak için basit bir yöntemi ve canlı hücrelerde enflamatuar kaspaz aktivasyonunu ölçmek için görüntüleme tabanlı bir yaklaşımı açıklamaktadır.
Abstract
İnflamatuar kaspazlar kaspaz-1, -4, -5, -11 ve -12’yi içerir ve başlatıcı kaspazların alt grubuna aittir. Kaspaz-1, enflamatuar sinyalizasyonun doğru düzenlenmesini sağlamak için gereklidir ve enflamatuarlara işe alımı takiben yakınlık kaynaklı dimerizasyon ile aktive edilir. Kaspaz-1, monositik hücre soyunda bol miktarda bulunur ve pro-inflamatuar sitokinlerin interlökin (IL)-1β ve IL-18’in aktif salgılanan moleküllere olgunlaşmasını indükler. Diğer inflamatuar kaspazlar, kaspaz-4 ve -5 (ve bunların murin homolog kaspaz-11), pirotozu indükleyerek IL-1β salınımını teşvik eder. Kaspaz Bimoleküler Floresan Komplesyonu (BiFC), kaspaz aktivasyonunun bir okuması olarak inflamatuar kaspaz kaynaklı yakınlığı ölçmek için kullanılan bir araçtır. Enflamatuara bağlanan bölgeyi içeren kaspaz-1, -4 veya -5 prodomain, kaspazlar indüklenen yakınlığa maruz kaldığında floresan Venüs kompleksini reforme etmekle ilişkili sarı floresan protein Venüs’ün (Venüs-N [VN] veya Venüs-C [VC]) floresan olmayan parçalarına kaynaştırılır. Bu protokol, bu muhabirlerin nükleofeksiyon kullanarak birincil insan monosit kaynaklı makrofajlara (MDM) nasıl tanıtılacağını, inflamatuar kaspaz aktivasyonunu indüklemek için hücrelerin nasıl tedavi edileceğini ve floresan ve konfokal mikroskopi kullanarak kaspaz aktivasyonunun nasıl ölçüleceğini açıklamaktadır. Bu yaklaşımın avantajı, canlı hücrelerdeki inflamatuar kaspaz aktivasyon kompleksinin bileşenlerini, gereksinimlerini ve lokalizasyonunu tanımlamak için kullanılabilmesidir. Bununla birlikte, hücre canlılığından ve davranışından ödün vermemek için dikkatli kontrollerin göz önünde bulundurulması gerekir. Bu teknik, enflamatuar düzeyde dinamik kaspaz etkileşimlerinin analizi ve canlı MDM ve insan kan örneklerinden türetilen monositlerdeki inflamatuar sinyal kaskadlarının sorgulanması için güçlü bir araçtır.
Introduction
Kaspazlar, başlatıcı kaspazlar ve cellat kaspazlar olarak gruplandırılabilen bir sistein aspartat proteazlar ailesidir. Cellater kaspazlar kaspaz-3, -6 ve -7’den oluşur. Doğal olarak hücrelerde dimerler olarak bulunurlar ve apoptoz1’i yürütmek için başlatıcı kaspazlar tarafından bölünürler. Başlatıcı kaspazlar insan kaspazı-1, -2, -4, -5, -8, -9, -10 ve -12’yi içerir. Yakınlığa bağlı dimerizasyon ile aktive olan ve otoproteolitik bölünme 2,3 ile stabilize edilen inaktif zimojenler (pro-kaspazlar) olarak bulunurlar. İnflamatuar kaspazlar, başlatıcı kaspaz2’nin bir alt kümesidir ve insanlarda kaspaz-1, -4, -5 ve -12’yi ve fare 4,5’te kaspaz-1, -11 ve -12’yi kapsar. Apoptotik bir rolden ziyade, inflamasyonda merkezi bir rol oynarlar. Patojenik istilacılara yanıt olarak salınan ilk sitokinler olan pro-interlökin (IL)-1β ve pro-IL-18 6,7’nin proteolitik işlenmesine ve salgılanmasına aracılık ederler 8,9. Caspase-1, aktivasyon platformuna işe alındıktan sonra etkinleştirilir; inflamatuar olarak adlandırılan büyük bir moleküler ağırlıklı protein kompleksi (Şekil 1A)10. Kaspaz-4, -5 ve -11’in dimerizasyonu, kanonik olmayan bir enflamatuar yol11,12 aracılığıyla bu platformlardan bağımsız olarak gerçekleşir.
Kanonik enflamatuarlar, bir enflamatuar sensör proteini, adaptör protein ASC (CARD içeren apoptozla ilişkili leke benzeri protein) ve efektör protein kaspaz-110’dan oluşan sitozolik multimerik protein kompleksleridir. En iyi çalışılmış kanonik enflamatuarlar, bir pirin alanı (NLRP), NLRP1 ve NLRP3 içeren NOD benzeri reseptör ailesi, bir CARD (NLRC), NLRC4 içeren NLR ailesi ve melanom 2’de (AIM2) bulunmayanlardır. Her biri bir pirin etki alanı, bir CARD veya her iki etki alanı içerir. CARD etki alanı, CARD içeren kaspazlar ve bunların yukarı akış aktivatörleri arasındaki etkileşime aracılık eder. Bu nedenle, bir N-terminal pirin alanı (PYD) ve bir C-terminal CARD motifi 13,14’ten oluşan iskele molekülü ASC, NLRP1 10, NLRP315 ve AIM216 enflamatuarlarına kaspaz-1’in alınması için gereklidir.
Her enflamatuar, farklı pro-inflamatuar uyaranları tanıyan benzersiz sensör proteininden sonra adlandırılır (Şekil 1B). Bu yolun aktivatörlerine kanonik uyaranlar denir. Enflamatuarlar, mikrobiyal bileşenler ve doku stresi için sensörler görevi görür ve enflamatuar kaspazların aktivasyonu yoluyla sağlam bir enflamatuar yanıtı tetiklemek için bir araya gelir17. Enflamatuar düzenek, ana substratları pro-IL-1β ve pro-IL-18’in olgunlaşmasına ve salgılanmasına aracılık etmek için kaspaz-1 aktivasyonunu başlatır. Bu işlem iki adımlı bir mekanizma ile gerçekleşir. İlk olarak, bir astarlama uyaranı, NF-κB yolunun aktivasyonu yoluyla bazı enflamatuar proteinlerin ve pro-IL-1β’nin ekspresyonunu düzenler. İkincisi, hücre içi (kanonik) bir uyaran, enflamatuar montaja ve prokaspaz-1 6,7’nin işe alınmasına neden olur.
Kaspaz-4 ve kaspaz-5, murin kaspaz-11 11’in insan ortologlarıdır. Gram-negatif bakterilerin dış zarında bulunan bir molekül olan hücre içi lipopolisakkarit (LPS) 18,19,20 ve kırmızı kan hücresi hemolizi 21’in bir ürünü olan hücre dışı heme ile enflamatuardan bağımsız bir şekilde aktive edilirler. LPS’nin doğrudan bu proteinlerin CARD motifine bağlandığı ve oligomerizasyonlarını indüklediği öne sürülmüştür20. Kaspaz-4 veya kaspaz-5’in aktivasyonu, gözenek oluşturan protein gasdermin D’nin (GSDMD) bölünmesi yoluyla piroptoz adı verilen enflamatuar bir hücre ölümü formunu indükleyerek IL-1β salınımını teşvik eder18,19. Ek olarak, kaspaz-4 ve GSDMD aracılı piroptotik ölümden kaynaklanan potasyum iyonlarının efflüksü, NLRP3 enflamatuarının aktivasyonunu ve ardından kaspaz-122,23’ün aktivasyonunu indükler. Bu nedenle, kaspaz-4, -5 ve -11, spesifik uyaranlar 11,24’e yanıt olarak piroptoz ve kaspaz-1 aktivasyonunu indükleyebilen LPS için hücre içi sensörler olarak kabul edilir.
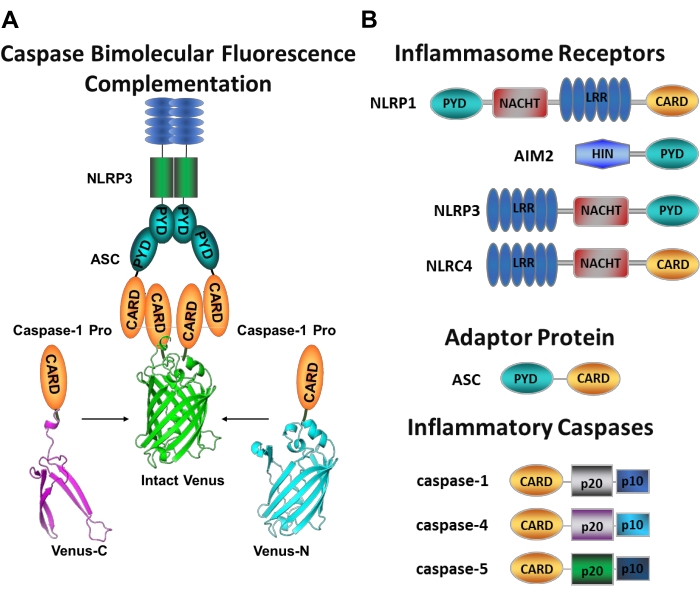
Şekil 1: İnflamatuar kaspazlar ve kaspaz-bimoleküler floresan kompleman (BiFC) testi. (A) Venüs’ün floresan olmayan her bir parçasına (Venüs-C veya Venüs-N) bağlı iki kaspaz-1 prodomaininin (C1-pro) NLRP3 aktivasyon platformuna alındığı ve Venüs’ü refere ve floresan yapmaya zorlayan kaspaz-BiFC sistemini gösteren diyagram. Bu kompleks mikroskop altında yeşil bir nokta olarak görünür ve başlatıcı kaspaz aktivasyonunda ilk adım olan inflamatuar kaspaz kaynaklı yakınlık için bir okuma görevi görür. (B) Enflamatuar bileşenlerin ve inflamatuar kaspazların etki alanı organizasyonunu gösteren şematik. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Spesifik başlatıcı kaspaz aktivasyonunu ölçmek zordur ve görüntüleme yaklaşımlarıyla bunu yapmak için çok fazla yöntem yoktur. Kaspaz Bimoleküler Floresan Komplemanı (BiFC), doğrudan canlı hücrelerde inflamatuar kaspaz aktivasyonunu görselleştirmek için kullanılabilir (Şekil 1A)25. Bu teknik yakın zamanda insan monosit türevi makrofajlarda (MDM) kullanılmak üzere uyarlanmıştır (MDM)21. Kaspaz BiFC, dimerizasyonu kolaylaştırmak için inflamatuar kaspaz aktivasyonundaki ilk adımı, indüklenmiş yakınlığı ölçer. Fotolanabilir sarı floresan protein Venüs’ün (Venüs-C [VC]) ve Venüs-N [VN]) floresan olmayan fragmanlarına kaynaşmış CARD içeren kaspaz prodomainini kodlayan plazmidlerin ekspresyonu kullanılır. İki kaspaz prodomaini aktivasyon platformlarına alındığında veya indüklenmiş yakınlığa maruz kaldığında, Venüs’ün iki yarısı yakına getirilir ve refold ve floresan yapmaya zorlanır (bkz. Şekil 1A, B). Bu, spesifik inflamatuar kaspaz aktivasyonunun gerçek zamanlı bir okumasını sağlar.
İnsan MDM’si, tehlike sinyallerini ve patojen ürünlerini tanımlayan enflamatuar genleri ve patern tanıma reseptörlerini bolca eksprese eder. Bu, inflamatuar kaspaz yolaklarının sorgulanması için ideal bir hücre tipi sağlar. Ek olarak, periferik kandan ve hatta belirli bir hastalık durumunda inflamatuar kaspaz aktivasyonunu değerlendirmek için hasta örneklerinden türetilebilirler. Bu protokol, elektroporasyon tabanlı bir transfeksiyon yöntemi olan nükleofeksiyon kullanılarak BiFC kaspaz muhabirlerinin MDM’ye nasıl tanıtılacağını, inflamatuar kaspaz aktivasyonunu indüklemek için hücrelerin nasıl tedavi edileceğini ve mikroskopi yaklaşımlarını kullanarak aktif kaspaz komplekslerinin nasıl görselleştirileceğini açıklamaktadır. Ek olarak, bu metodoloji, bu komplekslerin moleküler bileşimini, hücre altı lokalizasyonunu, kinetik ve bu yüksek sıralı yapıların büyüklüğünü belirlemek için uyarlanabilir25,26,27.
Protocol
Representative Results
Discussion
Bu protokol, insan kan örneklerinden izole edilen monositlerden makrofajlar elde etmek için iş akışını ve enflamatuar kaspaz BiFC muhabirlerini hücre canlılığından ve davranışından ödün vermeden insan MDM’sine verimli bir şekilde tanıtmak için bir yöntemi açıklar.
Bu protokol, bölünmüş floresan protein Venüs’ün floresan olmayan fragmanları ile kaspaz işe alım alanındaki (CARD) inflamatuar kaspazları etiketlemek için BiFC tekniği35’ten…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Bu tekniğin geliştirilmesine katkıda bulunan LBH’nin geçmiş ve şimdiki laboratuvar üyelerine teşekkür ederiz. Bu laboratuvar NIH/NIDDK T32DK060445 (BEB), NIH/NIDDK F32DK121479 (BEB), NIH/NIGMS R01GM121389 (LBH) tarafından desteklenmektedir. Şekil 2, Biorender yazılımı kullanılarak çizilmiştir.
Materials
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
References
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) – Molecular Cell Research. 1867 (6), 118688 (2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761 (2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97 (1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813 (2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316 (2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502 (2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What’s the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).

