Visualisering av inflammatoriske caspaser indusert nærhet i humane monocytt-avledede makrofager
Summary
Denne protokollen beskriver arbeidsflyten for å oppnå monocytter-avledede makrofager (MDM) fra menneskelige blodprøver, en enkel metode for effektivt å introdusere inflammatorisk caspase Bimolecular Fluorescence Complementation (BiFC) reportere i human MDM uten å gå på kompromiss med cellens levedyktighet og oppførsel, og en bildebasert tilnærming for å måle inflammatorisk caspase-aktivering i levende celler.
Abstract
Inflammatoriske caspaser inkluderer caspase-1, -4, -5, -11 og -12 og tilhører undergruppen av initiatorpaser. Caspase-1 er nødvendig for å sikre riktig regulering av inflammatorisk signalering og aktiveres ved nærhetsindusert dimerisering etter rekruttering til inflammasomer. Caspase-1 er rikelig i den monocytiske cellelinjen og induserer modning av de proinflammatoriske cytokinene interleukin (IL)-1β og IL-18 til aktive utskilte molekyler. De andre inflammatoriske caspasene, caspase-4 og -5 (og deres murine homolog caspase-11) fremmer IL-1β-frigjøring ved å indusere pyroptose. Caspase Bimolecular Fluorescence Complementation (BiFC) er et verktøy som brukes til å måle inflammatorisk caspase indusert nærhet som en avlesning av caspase aktivering. Caspase-1, -4 eller -5 prodomainet, som inneholder regionen som binder seg til inflammasomet, smeltes sammen til ikke-fluorescerende fragmenter av det gule fluorescerende proteinet Venus (Venus-N [VN] eller Venus-C [VC]) som forbinder for å reformere det fluorescerende Venus-komplekset når caspasene gjennomgår indusert nærhet. Denne protokollen beskriver hvordan du introduserer disse reporterne i primære humane monocytt-avledede makrofager (MDM) ved hjelp av nukleofeksjon, behandler cellene for å indusere inflammatorisk caspase-aktivering, og måler caspase-aktivering ved hjelp av fluorescens og konfokal mikroskopi. Fordelen med denne tilnærmingen er at den kan brukes til å identifisere komponentene, kravene og lokaliseringen av det inflammatoriske caspase-aktiveringskomplekset i levende celler. Imidlertid må forsiktige kontroller vurderes for å unngå å kompromittere celle levedyktighet og oppførsel. Denne teknikken er et kraftig verktøy for analyse av dynamiske caspase interaksjoner på inflammasome nivå samt for avhør av inflammatoriske signalkaskader i levende MDM og monocytter avledet fra menneskelige blodprøver.
Introduction
Caspases er en familie av cystein aspartate proteaser som kan grupperes i initiator caspases og bøddel caspases. Bøddel caspases består av caspase-3, -6 og -7. De finnes naturlig i celler som dimmere og er spaltet av initiator caspases for å utføre apoptose1. Initiator caspases inkluderer menneskelig caspase-1, -2, -4, -5, -8, -9, -10 og -12. De er funnet som inaktive zymogens (pro-caspases) som aktiveres av nærhet-indusert dimerization og stabilisert av auto-proteolytisk spalting 2,3. De inflammatoriske caspasene er en undergruppe av initiator caspases2 og omfatter caspase-1, -4, -5 og -12 hos mennesker, og caspase-1, -11 og -12 i mus 4,5. I stedet for en apoptotisk rolle, spiller de en sentral rolle i betennelse. De formidler proteolytisk prosessering og sekresjon av pro-interleukin (IL)-1β og pro-IL-18 6,7, som er de første cytokinene som slippes ut som svar på patogene inntrengere 8,9. Caspase-1 aktiveres ved rekruttering til aktiveringsplattformen; et stort molekylvektproteinkompleks kalt inflammasomet (figur 1A)10. Dimerisering av caspase-4, -5 og -11 skjer uavhengig av disse plattformene gjennom en ikke-kanonisk inflammasomvei11,12.
Kanoniske inflammasomer er cytosoliske multimeriske proteinkomplekser som består av et inflammasomsensorprotein, adapterproteinet ASC (apoptose-assosiert flekklignende protein som inneholder et CARD), og effektorproteinet caspase-110. De mest studerte kanoniske inflammasomene er den NOD-lignende reseptorfamilien som inneholder et pyrindomene (NLRP), NLRP1 og NLRP3, NLR-familien som inneholder et KORT (NLRC), NLRC4 og fraværende i melanom 2 (AIM2). Hver av dem inneholder et pyrindomene, et KORT eller begge domenene. CARD-domenet formidler samspillet mellom KORT-inneholdende caspaser og deres oppstrømsaktivatorer. Stillasmolekylet ASC, som består av et N-terminalt pyrindomene (PYD) og et C-terminalt KORTmotiv13,14, er derfor nødvendig for rekruttering av caspase-1 til NLRP110, NLRP315 og AIM216 inflammasomes.
Hvert inflammasom er oppkalt etter sitt unike sensorprotein som gjenkjenner distinkte proinflammatoriske stimuli (figur 1B). Aktivatorer av denne banen kalles kanoniske stimuli. Inflammasomer fungerer som sensorer for mikrobielle komponenter og vevsstress, og monteres for å utløse en robust inflammatorisk respons gjennom aktivering av de inflammatoriske caspases17. Inflammasome montering initierer caspase-1 aktivering for å megle modning og sekresjon av sine viktigste substrater pro-IL-1β og pro-IL-18. Denne prosessen skjer via en to-trinns mekanisme. For det første oppregulerer en priming stimulus uttrykket av visse inflammasome proteiner og pro-IL-1β gjennom aktivering av NF-κB-banen. For det andre induserer en intracellulær (kanonisk) stimulus inflammasommontering og rekruttering av procaspase-1 6,7.
Caspase-4 og caspase-5 er de menneskelige ortologene av murin caspase-1111. De aktiveres på en inflammasomuavhengig måte ved intracellulær lipopolysakkarid (LPS), et molekyl som finnes i den ytre membranen av Gram-negative bakterier 18,19,20, og ved ekstracellulært heme, et produkt av rødblodcelle hemolyse 21. Det er foreslått at LPS binder seg direkte til CARD-motivet til disse proteinene og induserer deres oligomerisering20. Aktivering av caspase-4 eller caspase-5 fremmer IL-1β-frigjøring ved å indusere en inflammatorisk form for celledød kalt pyroptose gjennom spalting av poredannende proteingassdermin D (GSDMD)18,19. I tillegg induserer efflux av kaliumioner som følge av caspase-4 og GSDMD-mediert pyroptotisk død aktivering av NLRP3 inflammasome og påfølgende aktivering av caspase-122,23. Derfor anses caspase-4, -5 og -11 som intracellulære sensorer for LPS som er i stand til å indusere pyroptose og caspase-1-aktivering som svar på spesifikke stimuli11,24.
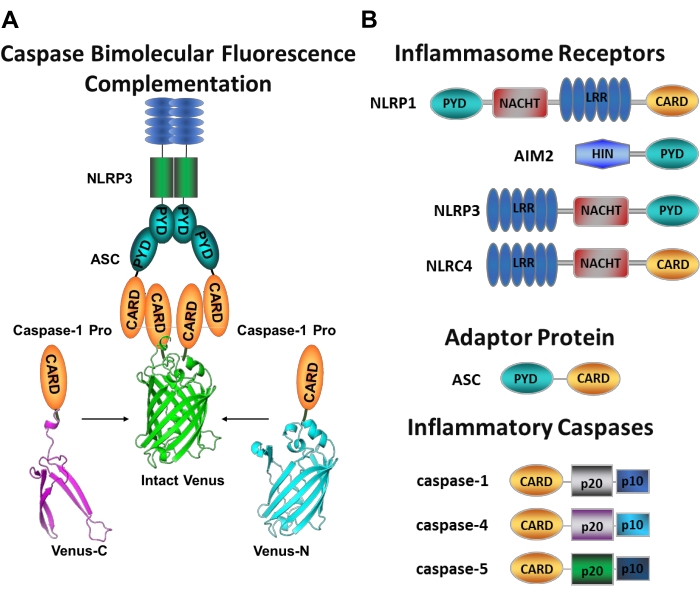
Figur 1: Inflammatoriske caspaser og caspase-bimolecular fluorescence complementation (BiFC) assay. (A) Diagram som viser caspase-BiFC-systemet, hvor to caspase-1 prodomainer (C1-pro) knyttet til hvert ikke-fluorescerende fragment av Venus (Venus-C eller Venus-N) rekrutteres til NLRP3-aktiveringsplattformen, og tvinger Venus til å refolde og fluorisere. Dette komplekset fremstår som et grønt sted under mikroskopet og fungerer som en avlesning for inflammatorisk caspase-indusert nærhet, som er det første trinnet i initiator caspase aktivering. (B) Skjematisk som viser domeneorganisasjonen av inflammasomkomponenter og inflammatoriske caspaser. Klikk her for å se en større versjon av denne figuren.
Det er vanskelig å måle spesifikk initiator caspases-aktivering, og det er ikke mange metoder tilgjengelig for å gjøre det ved avbildningsmetoder. Caspase Bimolecular Fluorescence Complementation (BiFC) kan brukes til å visualisere inflammatorisk kaspaseaktivering direkte i levende celler (figur 1A)25. Denne teknikken har nylig blitt tilpasset for bruk i humane monocytt-avledede makrofager (MDM)21. Caspase BiFC måler det første trinnet i inflammatorisk kaspaseaktivering, indusert nærhet for å lette dimerisering. Uttrykk for plasmider som koder det CARD-inneholdende caspase prodomain smeltet sammen til ikke-fluorescerende fragmenter av det fotostabile gule fluorescerende proteinet Venus (Venus-C [VC]) og Venus-N [VN]) brukes. Når de to caspase-prodomenene rekrutteres til aktiveringsplattformen eller gjennomgår indusert nærhet, blir de to halvdelene av Venus brakt i nærheten og tvunget til å brette og fluoresce (se figur 1A, B). Dette gir en sanntidsavlesning av spesifikk inflammatorisk kaspaseaktivering.
Human MDM uttrykker rikelig inflammasome gener og mønstergjenkjenningsreseptorer som identifiserer faresignaler og patogenprodukter. Dette gir en ideell celletype for avhør av inflammatoriske caspase-veier. I tillegg kan de avledes fra perifert blod og til og med fra pasientprøver for å vurdere inflammatorisk kaspaseaktivering i en bestemt sykdomstilstand. Denne protokollen beskriver hvordan man introduserer BiFC caspase-reportere i MDM ved hjelp av nukleofeksjon, en elektroporasjonsbasert transfeksjonsmetode, hvordan man behandler cellene for å indusere inflammatorisk caspase-aktivering, og hvordan du visualiserer de aktive caspase-kompleksene ved hjelp av mikroskopiske tilnærminger. I tillegg kan denne metoden tilpasses for å bestemme den molekylære sammensetningen av disse kompleksene, subcellulær lokalisering, kinetikk og størrelse på disse høyt bestilte strukturene 25,26,27.
Protocol
Representative Results
Discussion
Denne protokollen beskriver arbeidsflyten for å få makrofager fra monocytter isolert fra menneskelige blodprøver og en metode for effektivt å introdusere de inflammatoriske caspase BiFC-reporterne i menneskelig MDM uten å gå på kompromiss med cellens levedyktighet og oppførsel.
Denne protokollen drar nytte av BiFC-teknikken35 for å merke de inflammatoriske caspasene på caspase rekrutteringsdomenet (CARD) med ikke-fluorescerende fragmenter av det splittede fluo…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Vi takker medlemmene av LBHs lab fortid og nåtid som bidro til utviklingen av denne teknikken. Dette laboratoriet støttes av NIH/NIDDK T32DK060445 (BEB), NIH/NIDDK F32DK121479 (BEB), NIH/NIGMS R01GM121389 (LBH). Figur 2 ble tegnet ved hjelp av Biorender-programvare.
Materials
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
References
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) – Molecular Cell Research. 1867 (6), 118688 (2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761 (2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97 (1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813 (2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316 (2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502 (2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What’s the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).

